- +1
Cancer Cell:复旦大学刘杰/骆菲菲团队破解STING激动剂癌症治疗耐药之谜
原创 生物世界 生物世界
撰文丨王聪
编辑丨王多鱼
排版丨水成文
干扰素基因刺激因子(STING)通路在启动针对病原体和肿瘤的免疫反应中发挥着关键作用。STING 信号的激活对于多种癌症疗法的抗肿瘤效果至关重要,STING 激动剂在小鼠模型中治疗不同癌症方面展现出了令人瞩目的潜力。
然而,STING 激动剂单独使用在临床试验中仅显示出极小的疗效,这表明肿瘤对 STING 的单药治疗具有很强的耐药性。阐明其背后的具体机制,对于提高其癌症治疗效果至关重要。
2025 年 3 月 10 日,复旦大学附属华山医院刘杰教授、骆菲菲研究员团队(宋欢、陈琳、潘宣宣为共同第一作者)在 Cancer Cell 期刊发表了题为:Targeting tumor monocyte-intrinsic PD-L1 by rewiring STING signaling and enhancing STING agonist therapy 的研究论文。
该研究揭示了 STING 通路在癌症治疗中的双重作用,解析了 STING 激动剂通过诱导单核细胞内源性 PD-L1 介导免疫抑制的全新机制,进而提出了通过重编程 STING 信号提升癌症治疗疗效的新策略,为优化 STING 靶向治疗提供了重要的理论依据和临床前证据。

STING 是启动免疫应答的重要 DNA 传感机制,但靶向 STING 的治疗在临床试验中显示出较差的效果。这里存在着一个矛盾——STING的激活既能引发抗肿瘤免疫,又能通过上调 PD-L1 等免疫抑制分子来促进肿瘤的免疫逃逸。
在这项最新研究中,研究团队发现,STING 信号激活在触发抗肿瘤免疫的同时,还会诱导出高表达 PD-L1 的肿瘤单核细胞(PD-L1hi Tu.Mons),这些细胞在 STING 激动剂治疗的抵抗中占主导地位。研究团队将 STING-IRF3-IFN-I 信号轴诱导的细胞内源性 PD-L1 被确定为促肿瘤的 PD-L1hiTu.Mons的驱动因素。
值得注意的是,TLR2 激活的 Tu.Mons 细胞能够抵抗 STING 诱导的细胞内源性 PD-L1 的表达上调以及相关的促肿瘤功能。
从机制上讲,TLR2 刺激通过促进 STING 与 TRAF6 的相互作用来重塑 STING 信号转导,从而抑制 IRF3-IFN-I 通路,转向 NF-κB 激活,进而降低 PD-L1 表达,逆转单核细胞的免疫抑制功能。
最后,研究团队在小鼠模型中证实,将 STING 激动剂与 TLR2 激动剂预处理相结合,可显著提高抗肿瘤疗效。
该研究的核心发现:
STING 激活诱导的高表达 PD-L1 的肿瘤单核细胞(PD-L1hi Tu.Mons)主导了对 STING 激动剂治疗的耐药性;
STING-IFN-I 信号轴诱导的细胞内源性 PD-L1 驱动促肿瘤的 PD-L1hi Tu.Mons;
TLR2 激活会重塑 STING 信号转导,从而降低细胞内源性 PD-L1 表达;
STING 激动剂与 TLR2 预先激活联合使用,显示出增强的抗肿瘤效果。
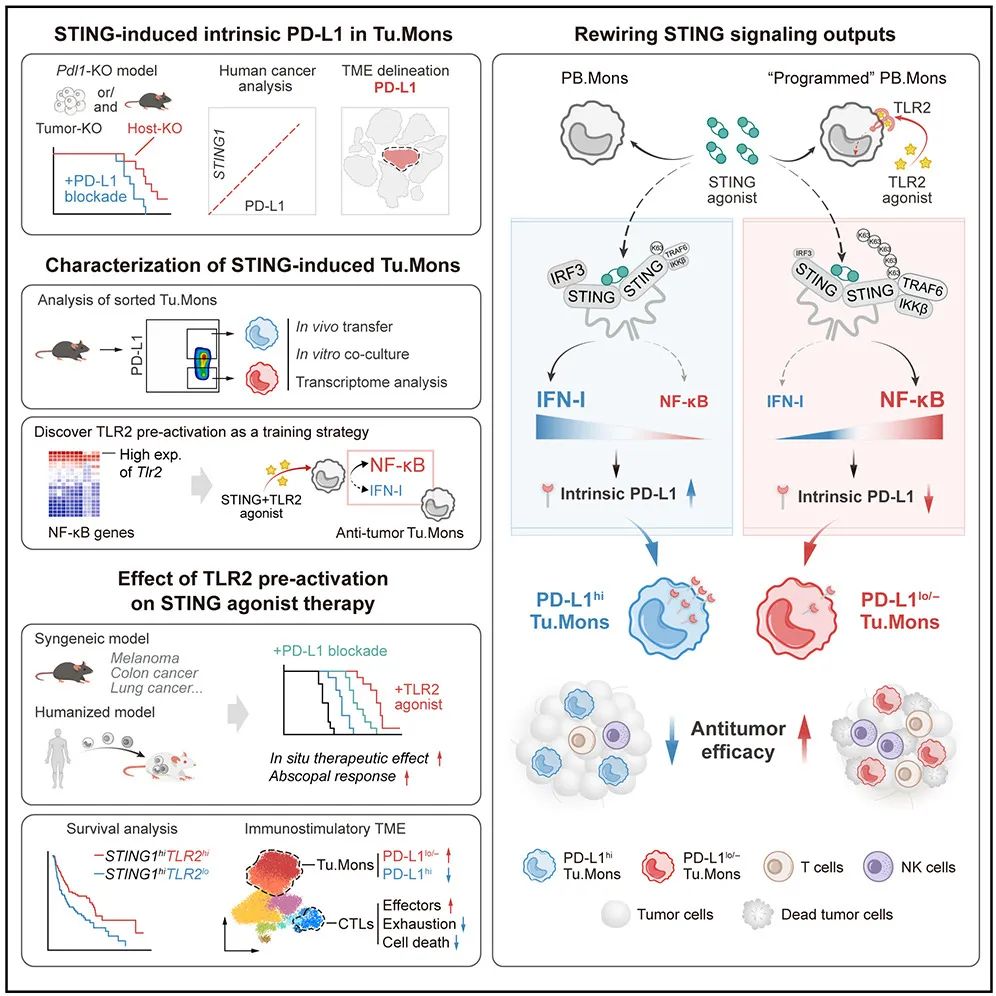
该研究提出了“细胞内源性 PD-L1”的新概念,超越了 PD-1/PD-L1 阻断的传统思路,揭示了 STING 信号输出平衡的调控机制(IRF3 vs NF-κB),验证了 TLR2 激动剂和 STING 激动剂序贯治疗(先 TLR2 激活,后 STING 激动剂)的转化潜力,从而提出了通过微调 STING 信号输出来增强抗肿瘤免疫的有前景的新策略,为优化 STING 靶向治疗提供了重要的理论依据和临床前证据。
论文链接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00066-2
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。

- 一键“入夏”
- 中日经济高层对话达成二十项共识
- 大陆打出“惩独”组合拳备受关注

- 北京市长殷勇会见英国阿斯利康公司全球首席执行官
- 哪吒系列电影总票房破200亿元


- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司





