- +1
【前沿科普】探秘TRPM7:身体中的离子通道守护神
以下文章来源于生物化学与生物物理进展 ,作者PIBB
生物化学与生物物理进展.
期刊宣传、为作者和审稿人提供移动终端的登录服务
作者 | 王龙
责编 | 霍麟
“天工开物,造化钟神秀。”
杜甫《奉和圣制天工开物将命宝诰》
在人体这座精妙绝伦的生命宫殿中,存在着许多微小而关键的“通道”,它们如同大自然中的溪流一样,允许离子(如钙离子、镁离子等)穿过细胞膜,从而调节细胞内环境的平衡。这些通道被称为离子通道,它们在维持正常细胞功能和生理活动中起着至关重要的作用。
1969年,瞬 时 受 体 电 位 (transient receptor potential,TRP) 离子通道家族在视觉传导受损的突变体黑腹果蝇中首次被发现,因视网膜电图显示该突变体对强光刺激表现出瞬时反应而得名[1-2]。TRPM 亚家族是 TRP 家族中最大的亚家族,包含 TRPM1~8,其中TRPM7是哺乳动物300多个离子通道中唯二(另一个为TRPM6)具有离子通道和蛋白激酶双重活性的离子通道,因在全身广泛表达而被科学家争相研究,可调控细胞兴奋性、代谢活性和表观遗传等,已经成为生物医学研究的一个重要焦点,这一神奇的离子通道在多种生物体中都有发现,包括人类、哺乳动物、昆虫等,是细胞内信号传递的重要分子之一。
TRPM7概述
TRPM7通道是一种具有独特结构的离子通道,它由一个大型蛋白质组成,包含六个跨膜区域构成的通道结构域和一个位于C端的钙依赖性磷酸酶结构域(图1),这种结构的特殊性使得TRPM7不仅能够作为离子通道调节钙、镁等离子的流动,还能够通过磷酸酶活性参与细胞信号的调节。
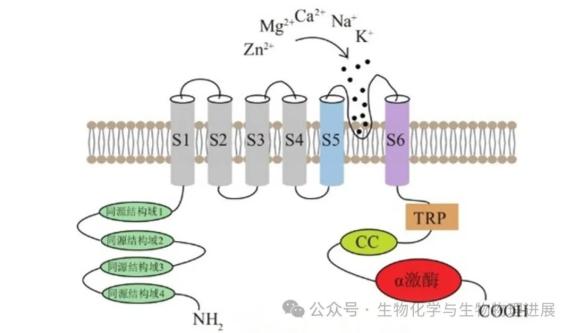
图1 TRPM7通道拓扑结构图
TRPM7通道是由四个相同的亚单位组成的同源四聚体,每个亚单位都有六个跨膜区段(S1~S6),S5和S6之间的区域形成通道的孔道,非选择性通透多种二价阳离子,如 Zn2+、Mg2+、Ca2+等[3]。Mg2+和Zn2+是许多酶的催化和结构辅助因子,是信号分子、DNA稳定性、细胞周期和转录因子的主要调节因子,Ca2+在细胞增殖、收缩、分泌、迁移和分化等细胞功能的控制中起关键作用,对Mg2+、 Zn2+和Ca2+等二价阳离子尤其是Mg2+的稳态调控作用使TRPM7在生物体中不可或缺。
TRPM7 α激酶结构域是TRPM7蛋白的一个重要组成部分,它位于蛋白质C端,包含有典型的激酶保守结构域,包括ATP结合位点和激酶活性位点,这个激酶结构域赋予了TRPM7激酶活性,使其具有自我磷酸化的能力,也可以磷酸化其他蛋白质,参与细胞信号转导,包括但不限于MAPK、PI3K/Akt和PLC等,这些信号通路在细胞增殖、分化、迁移和死亡等过程中起着关键作用[4-5]。TRPM7通道通过其磷酸酶活性去磷酸化特定的底物,从而影响这些信号通路的激活和抑制。
在疾病中的作用
TRPM7通道的异常活性与多种疾病的发生发展有关,其功能紊乱可引发心血管疾病、神经退行性疾病、疼痛以及癌症等病症。目前和TRPM7相关的多数疾病主要与TRPM7通道功能异常进而打破胞内离子平衡有关。在心血管系统中,TRPM7是人和小鼠心肌成纤维细胞主要的钙调控通道,TRPM7的过度激活可能导致心律失常和心肌肥厚,黄芪甲苷IV已被发现可以通过miR-135a-TRPM7-TGF-β/Smads途径抑制心脏纤维化,显示出其潜在的治疗价值[6]。在神经系统疾病中,TRPM7的异常表达与神经退行性疾病(如阿尔茨海默病、帕金森病和中风)以及神经性疼痛(前庭性偏头痛和三叉神经痛)有关。此外,TRPM7在某些癌症中的过度表达与肿瘤的增殖、侵袭和转移能力增强有关(图2)(详情请点击下方阅读原文)。
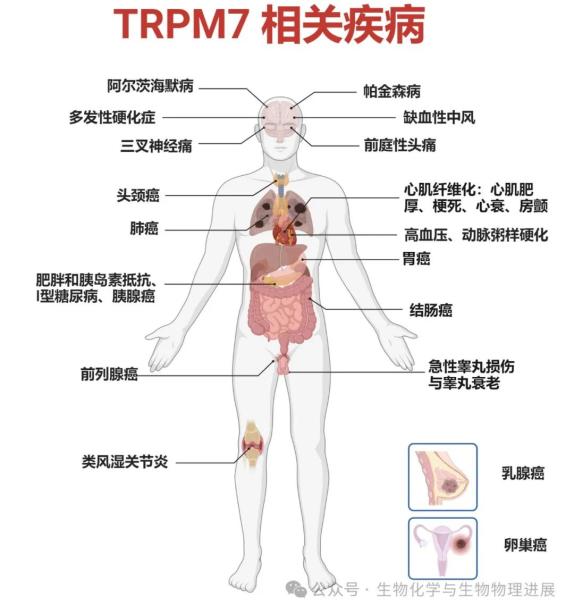
图 2 TRPM7相关疾病
最新研究表明,TRPM7在代谢性疾病与自身免疫性疾病中同样发挥作用。肥胖作为一种全球性的公共卫生问题,不仅仅是简单的体重过重,而是以体内脂肪含量过高为主要特征的代谢紊乱状态。中山大学的研究团队发现,TRPM7在肥胖小鼠脂肪细胞中的表达及活性上调[7]。TRPM7通过介导Ca⊃2;⁺内流调控TAK1-NFκB炎症通路,有效启动炎症因子转录,从而促进脂肪组织炎症,并诱导系统性胰岛素抵抗和其他肥胖并发症的发生。因此,靶向脂肪组织TRPM7的治疗方法可能是治疗肥胖、胰岛素抵抗及其相关代谢性并发症的有潜力的新策略。TRPM7通道在炎症反应和免疫细胞迁移过程中起作用,类风湿性关节炎是一种典型的自身免疫疾病,其中滑膜炎性反应的增强和免疫细胞向关节的募集可能是由TRPM7通道活性失调所驱动[8]。TRPM7也可通过调节中枢神经系统内免疫细胞的功能,包括T细胞和巨噬细胞,影响炎症级联反应和脱髓鞘过程,从而在多发性硬化(multiple sclerosi)的发病机制中扮演角色[9]。TRPM7在I型糖尿病中涉及到多个病理生理过程,包括胰岛β细胞的破坏、神经元功能障碍以及胰岛素分泌的调控[10]。此外,TRPM7在维持睾丸免疫稳态,治疗急性睾丸损伤和睾丸衰老过程中具有潜在作用[11]。
小分子调节剂
尽管TRPM7在多种疾病中扮演着重要角色,但是目前TRPM7特异性的调节剂仍然匮乏,早期研究发现,TRPM7可被多种内源性物质调节,如细胞内游离的Mg2+、PIP2、胞质的酸碱度,近年来小分子调节剂的开发成为热点,陆续发现了一些对TRPM7有相对特异性的小分子抑制剂和激动剂(详情请点击下方阅读原文),然而这些化合物存在特异性较差和作用位点不明确、有效剂量过高等问题,且TRPM7是否是临床药物开发的有前景的靶点仍然不明确,使得开展TRPM7小分子调节剂的发现和作用机制研究越发紧迫。此外,TRPM7通道的门控机制存在一定的争议,这可能影响小分子调节剂的设计和优化。
展望
在探索TRPM7通道的奥秘过程中,我们得以一窥这个在人体中扮演着守护者与调节者角色的离子通道。TRPM7不仅在维持细胞内环境平衡和生理活动中发挥着关键作用,而且在心血管疾病、神经系统疾病、癌症以及代谢性疾病等多种重大健康挑战中,显露出其不可或缺的重要性。随着研究的不断深入,TRPM7的多面性逐渐展现在我们面前,其在细胞信号转导、离子稳态调节以及细胞代谢等方面的复杂功能令人惊叹。
尽管目前对TRPM7的认识还有许多未知领域,但已有的研究成果为我们提供了治疗相关疾病的新思路和潜在靶点。特别是在阿尔茨海默病、心脏纤维化、前庭性偏头痛等病症中,TRPM7通道和激酶活性的调控展现出治疗的潜力。此外,TRPM7在肥胖和胰岛素抵抗中的作用也提示了其在代谢性疾病治疗中的应用前景。
未来,期待科学家们能够基于TRPM7的这些功能,开发出更多针对性的药物治疗策略。通过精确调控TRPM7通道和激酶活性,有望在治疗心血管疾病、神经系统疾病、癌症和代谢性疾病等方面取得突破性进展。同时,随着小分子调节剂研究的深入,我们也将拥有更多工具来探索TRPM7的生物学功能和治疗潜力。
[1] Cosens D J, Manning A. Abnormal electroretinogram from a Drosophila mutant. Nature, 1969, 224(5216): 285-287
[2] Pak W L, Grossfield J, White N V. Nonphototactic mutants in a study of vision of Drosophila. Nature, 1969, 222(5191): 351-354
[3] Monteilh-Zoller M K, Hermosura M C, Nadler M J, et al. TRPM7 provides an ion channel mechanism for cellular entry of trace metal ions. J Gen Physiol, 2003, 121(1): 49-60
[4] Kim T Y, Shin S K, Song M Y, et al. Identification of the phosphorylation sites on intact TRPM7 channels from mammalian cells. Biochem Biophys Res Commun, 2012, 417(3): 1030-1034
[5] Clark K, Middelbeek J, Morrice N A, et al. Massive autophosphorylation of the Ser/Thr-rich domain controls protein kinase activity of TRPM6 and TRPM7. PLoS One, 2008, 3(3): e1876
[6] Wei Y, Wu Y, Feng K, et al. Astragaloside IV inhibits cardiac fibrosis via miR-135a-TRPM7-TGF-β/Smads pathway. J Ethnopharmacol, 2020, 249: 112404
[7] Zhong W, Ma M, Xie J, et al. Adipose-specific deletion of the cation channel TRPM7 inhibits TAK1 kinase-dependent inflammation and obesity in male mice. Nat Commun, 2023, 14(1): 491
[8] Li X, Wang X, Wang Y, et al. Inhibition of transient receptor potential melastatin 7 (TRPM7) channel induces RA FLSs apoptosis through endoplasmic reticulum (ER) stress. Clin Rheumatol, 2014, 33(11): 1565-1574
[9] Depoil D, Fleire S, Treanor B L, et al. CD19 is essential for B cell activation by promoting B cell receptor-antigen microcluster formation in response to membrane-bound ligand. Nat Immunol, 2008, 9(1): 63-72
[10] Keymeulen B, Vandemeulebroucke E, Ziegler A G, et al. Insulin needs after CD3-antibody therapy in new-onset type 1 diabetes. N Engl J Med, 2005, 352(25): 2598-2608
[11] Chi A, Yang B, Dai H, et al. Stem Leydig cells support macrophage immunological homeostasis through mitochondrial transfer in mice. Nat Commun, 2024, 15(1): 2120

王龙
复旦大学与中国科学院上海药物研究所联合培养博士生
研究方向:靶向离子通道的镇痛和抗癫痫药物开发及相关机制研究。
原标题:《【前沿科普】探秘TRPM7:身体中的离子通道守护神》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。

- 无缝衔接上帆时间
- 廊坊4.2级地震,京津冀有震感
- 一批房产类“自媒体”被禁言

- 最高检依法对孙玉宁决定逮捕
- 恒生指数涨幅扩大至1%

- 鲁迅的第一篇白话文小说是
- 敦煌莫高窟的主要艺术形式是雕塑和

- 12假如AI欺骗了你
- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司