- +1
狡猾的β-冠状病毒“劫持”溶酶体进行自身传播
原创 Cell Press CellPress细胞科学
2020年1月31日,Cell Press新型冠状病毒资源中心正式开放。您可以在该资源中心页面上查找到COVID-19相关论文的投稿政策,以及Cell Press旗下期刊已发表的有关疫情和病毒的论文。网站正在不断更新中,所有内容都可以免费阅读。
最新在中心上线的发表在Cell Press细胞出版社旗下期刊Cell上的研究,名为“β-Coronaviruses use lysosomes for egress instead of the biosynthetic secretory pathway”来自美国国立卫生研究院(NIH)的研究团队发现,包括新冠病毒在内的β-冠状病毒能够劫持溶酶体作为自身传播工具,同时导致溶酶体中降解酶的失活。细胞中的溶酶体(lysosome)被称为细胞的“垃圾处理厂“,它通过消化细胞中错误折叠的蛋白、“废旧”的细胞器,产生氨基酸,为细胞合成新的蛋白质提供原料。溶酶体介导的蛋白降解也是细胞消灭病毒的有力工具之一。然而,日前美国国立卫生研究院(NIH)的研究团队发现,包括新冠病毒在内的β-冠状病毒,能够“劫持”溶酶体作为自身传播的工具,同时导致溶酶体中降解酶的失活,并且扰乱抗体呈现通路。研究人员表示,这一研究结果有助于解释COVID-19患者中出现的细胞和免疫异常,并且可能提供开发治疗手段的全新思路。
*以下中文内容仅供参考,请以英文原文为准。
摘要
β-冠状病毒是一类单正链包膜RNA病毒,包括导致COVID-19的SARS-CoV-2。既往许多研究揭示了它们的细胞进入和复制途径,但是它们排出细胞的方式尚不清楚。使用成像方法和病毒特异性报告基因,我们证明了β-冠状病毒利用溶酶体转运排出细胞,而不是利用其他包膜病毒更常用的生物合成分泌途径。这种非常规的细胞排出方式受到Arl8b(Arf-like small GTPase)的调控,并且可以被Rab7 GTPase竞争性抑制剂CID1067700所阻断。β-冠状病毒的这种非溶解释放导致溶酶体脱酸、溶酶体降解酶失活以及抗原呈递途径的破坏。本研究发现,β-冠状病毒利用溶酶体转运排出细胞,这为深入探索在患者中观察到的细胞和免疫异常提供了启发性的见解,并提出了新的治疗模式。
β-冠状病毒是一类单正链包膜RNA病毒,是冠状病毒科(Coronaviridae)的四个病毒属之一。这些病毒具有感染多种不同细胞类型的能力,包括肺、心血管、肝、胃肠、中枢神经和免疫系统中各种类型的细胞,这会导致复杂的多器官疾病表现,并且可能因人而异(Puelles et al., 2020; Ziegler et al., 2020)。尤其是在免疫系统方面,这些病毒似乎能够逃逸机体对病原体产生的典型先天性免疫和适应性免疫反应(Vardhana and Wolchok, 2020)。目前尚无任何治愈方法,抗病毒治疗的选择也很少(Williamson et al., 2020),是否可以通过自然途径或通过疫苗接种产生持久的免疫应答以对抗感染仍然是一个悬而未决的问题(Long et al., 2020)。
缺乏抗病毒治疗的主要原因之一在于,人们缺乏有关β-冠状病毒与宿主细胞结合界面的知识。一旦病毒包膜与质膜和/或内体膜融合,并将病毒RNA基因组释放到细胞质中,细胞就能转录、翻译产生细胞的非结构蛋白和结构蛋白。非结构蛋白在内质网膜上组装并复制产生病毒RNA(Snijder et al., 2020; Snijder et al., 2006)。尽管既往研究揭示了冠状病毒进入和复制的大量分子细节,但我们仍然对新组装的冠状病毒如何从细胞内排出知之甚少,包括它们利用的细胞途径以及它们是否诱导产生胞溶作用等(Fung and Liu, 2019; Machamer, 2013; Tooze et al., 1987)。
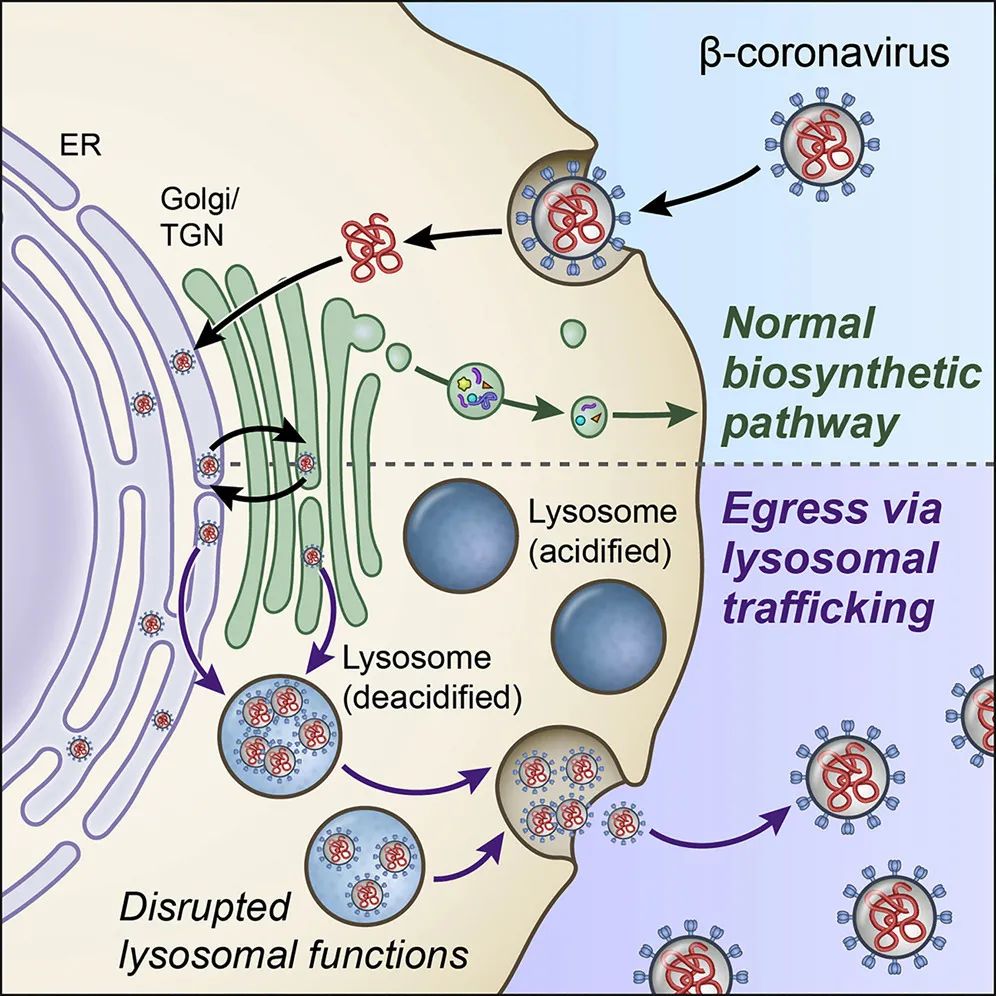
病毒感染细胞之后,会利用细胞生产蛋白的机制,合成自身复制所需的蛋白,在细胞内增殖,最后脱离细胞去感染其它的细胞。所有β-冠状病毒排出细胞途径均始于新合成的病毒基因组RNA,该病毒基因组RNA包被有病毒N蛋白,通过出芽方式进入内质网腔(ER)和ER-高尔基体中间腔(ERGIC)(Cohen et al., 2011; McBride et al., 2007; Perrier et al., 2019; Tooze et al., 1987; Tooze et al., 1988)。之后,病毒颗粒被包含病毒M、E和S跨膜结构蛋白的宿主膜所包被(de Haan et al., 1998; Ruch and Machamer, 2012; Siu et al., 2008)。一旦进入ER / ERGIC,病毒颗粒便进入高尔基体和反面高尔基网络(TGN)进行糖基化和其他翻译后修饰(Fung and Liu, 2018; McBride et al., 2007; Oostra et al., 2006; Tooze et al., 1987)。研究人员推测在高尔基体/TGN之后,冠状病毒利用生物合成分泌途径(biosynthetic secretary pathway)的囊泡结合细胞质膜并排出细胞(Machamer, 2013; Tooze et al., 1987),类似于其他包膜RNA病毒,例如丙性肝炎病毒、登革热病毒和西尼罗河病毒(Ravindran et al., 2016; Robinson et al., 2018)。此前,科学家们以为冠状病毒也采用同样的方式脱离细胞。
在此,美国国立卫生院(NIH)的科学家对小鼠肝炎病毒(mouse hepatitis virus, MHV)的脱离方式进行了研究。本研究探索了β-冠状病毒的排出途径,研究者发现这类病毒不是通过生物合成分泌途径排出细胞,而是利用溶酶体,以Arl8b依赖性的胞吐途径释放到细胞外环境中。这与其他RNA包膜病毒不同。其他RNA包膜病毒要么经生物合成分泌途径,要么直接通过与质膜融合和出芽排到细胞外(Robinson et al., 2018; Ravindran et al., 2016; Pornillos et al., 2002)。与先前的报道(Machamer, 2013; McBride et al., 2007; Tooze et al., 1987)一致。
“令我们惊讶的是,这些冠状病毒仍然能够正常脱离细胞。”这一研究的负责人,NIH国立心肺血液研究所(NHLBI)的Dr Nihal Altan-Bonnet说,“这是我们获得的第一个线索,冠状病毒可能在使用另外的通路。”
结果
本实验表明,分泌途径在被β冠状病毒感染的细胞中仍然具有很强的功能,新组装的病毒颗粒会通过出芽进入ER / ERGIC管腔,并在感染初期转运至高尔基体/TGN。但是,在达到高尔基体/ TGN后,他们的实验表明,β-冠状病毒输送至溶酶体,并使用胞吐溶酶体排出细胞,而不是生物合成的分泌途径(图1)。他们还显示了GRP78/BIP ER分子伴侣可通过此途径与β-冠状病毒共释放,从而增强冠状病毒的感染性(Chu et al., 2018; Ha et al., 2020)。由于病毒利用了溶酶体胞吐作用的结果,研究人员证明了晚期内体/溶酶体的脱酸和溶酶体蛋白酶的失活。尤其值得注意的是,他们发现溶酶体的生理紊乱对宿主细胞有重要的功能影响,包括抗原呈递途径的破坏。
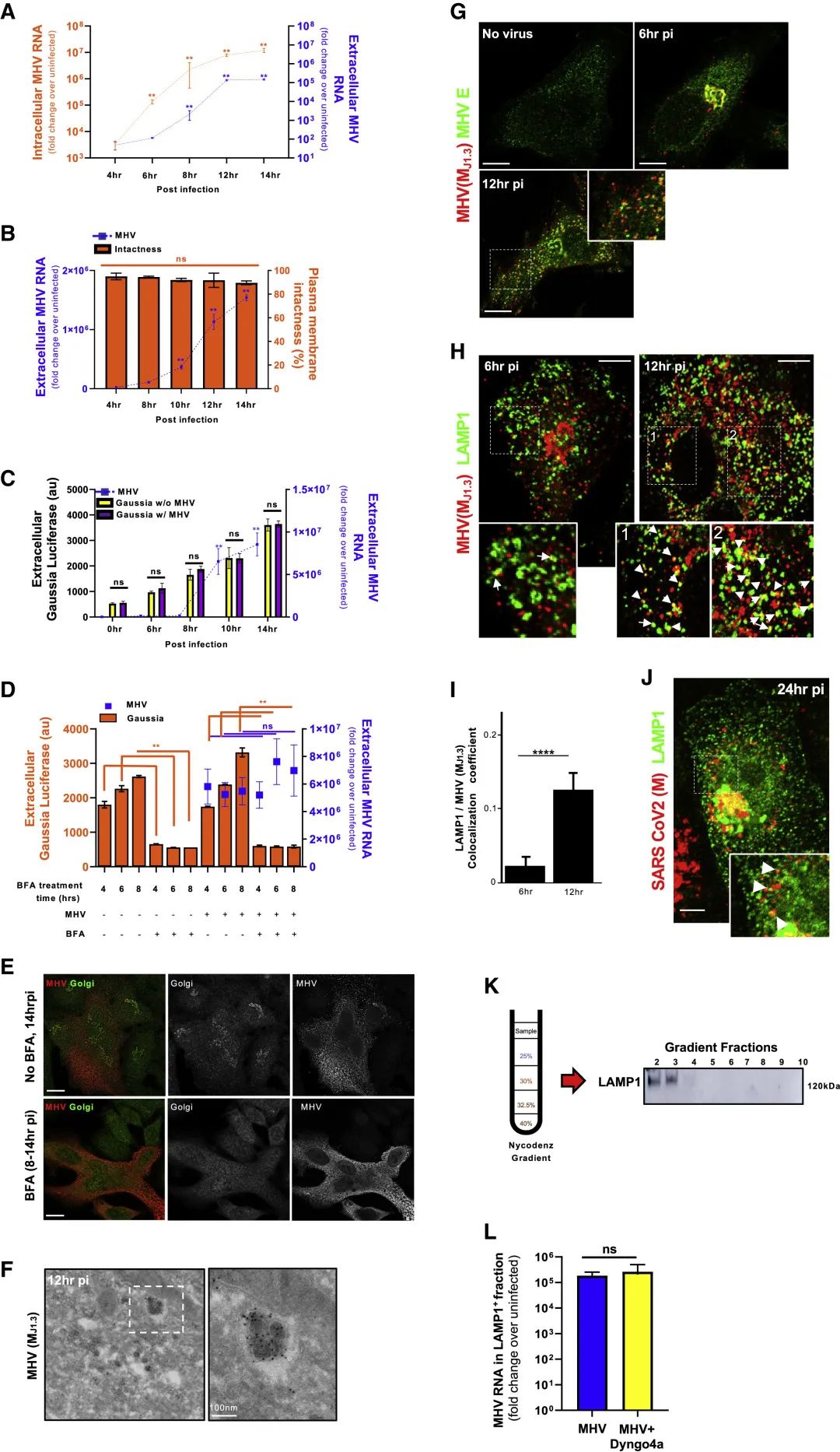
进一步的显微镜成像研究显示,冠状病毒会被运送到溶酶体中,并且在那里聚集。可是溶酶体里的环境通常是强酸性,那里有很多消化蛋白的酶。冠状病毒如果通过溶酶体脱离细胞,为什么不会被溶酶体消化掉?
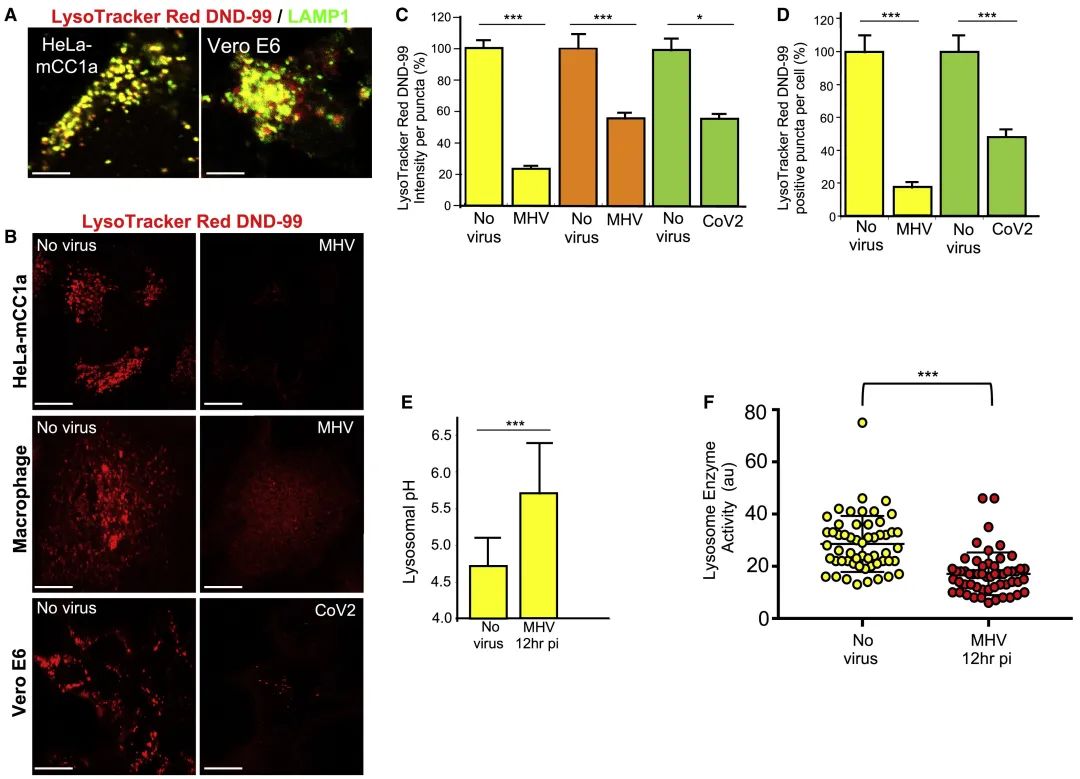
为此,研究人员用能够显示pH值的染料对被MHV感染的细胞进行了染色,他们发现,被MHV感染的细胞中,溶酶体的pH值显著升高,未感染的细胞中溶酶体的平均pH值为4.7,而被MHV感染的细胞中溶酶体的pH值则提高到5.7。以往的研究显示,溶媒体中的酶的活性与pH值有很大关联,pH值的微小上升就可以导致蛋白酶活性的显著下降。对蛋白酶活性的检测表明,被MHV感染的细胞中,溶酶体内的蛋白酶活性降低了40%。
所以,MHV病毒感染可以通过提高溶酶体的pH值,降低其中蛋白酶的活性,让溶酶体可以被病毒用于脱离细胞。研究人员还发现新冠病毒的ORF3a蛋白也会靶向溶酶体并且可能导致溶酶体酸性降低。
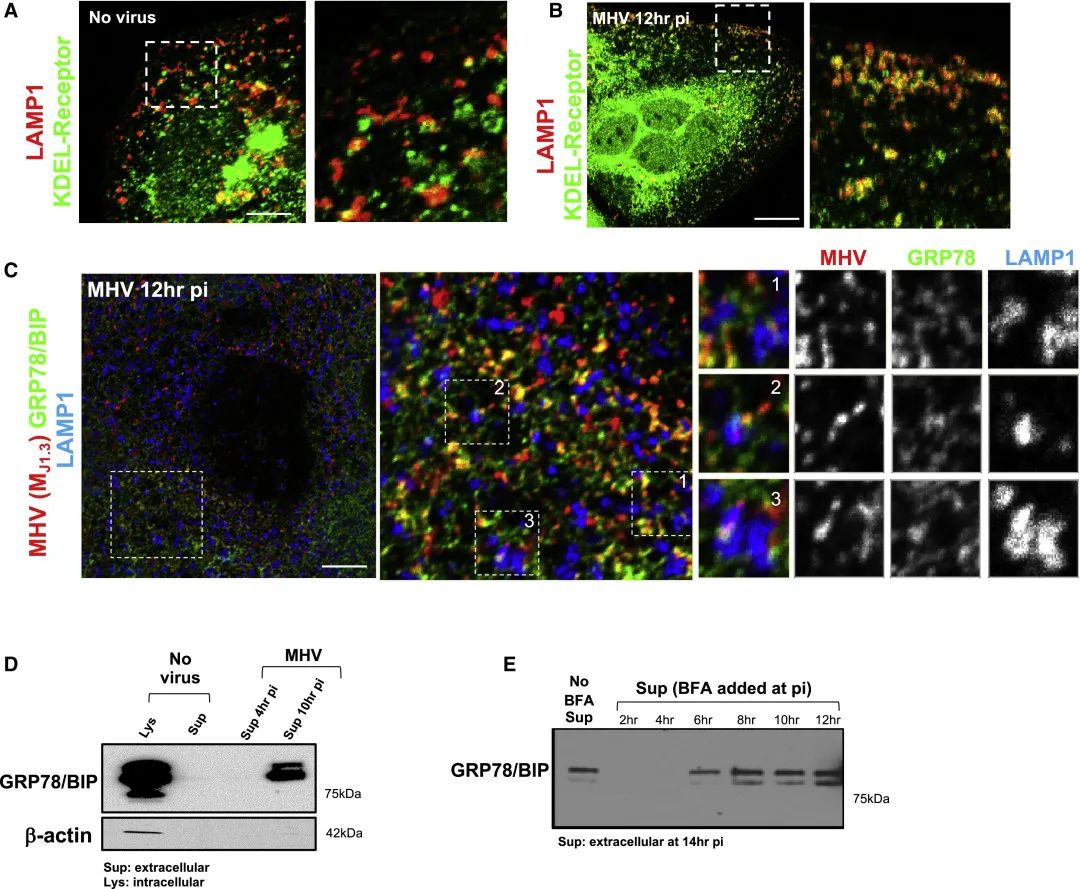
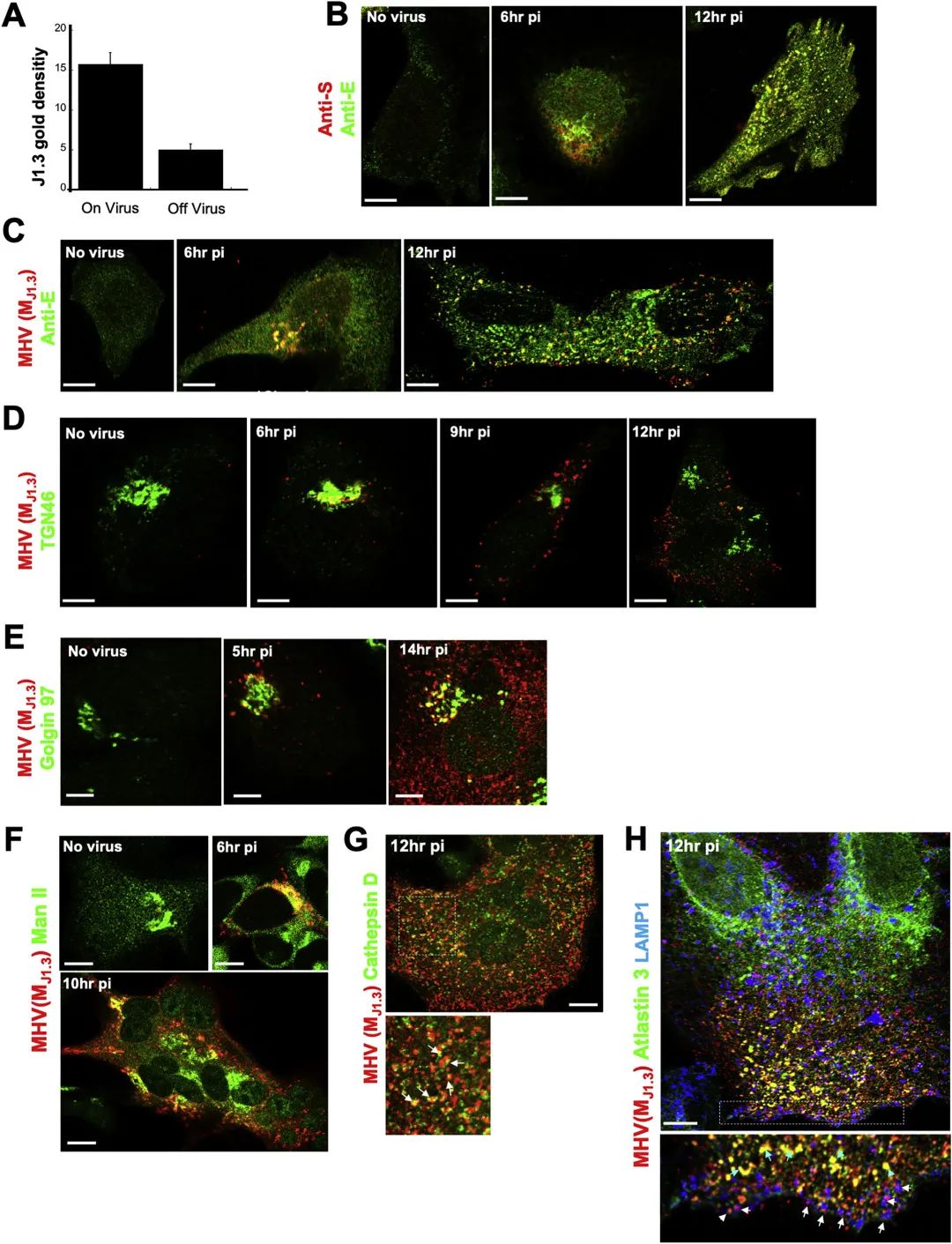
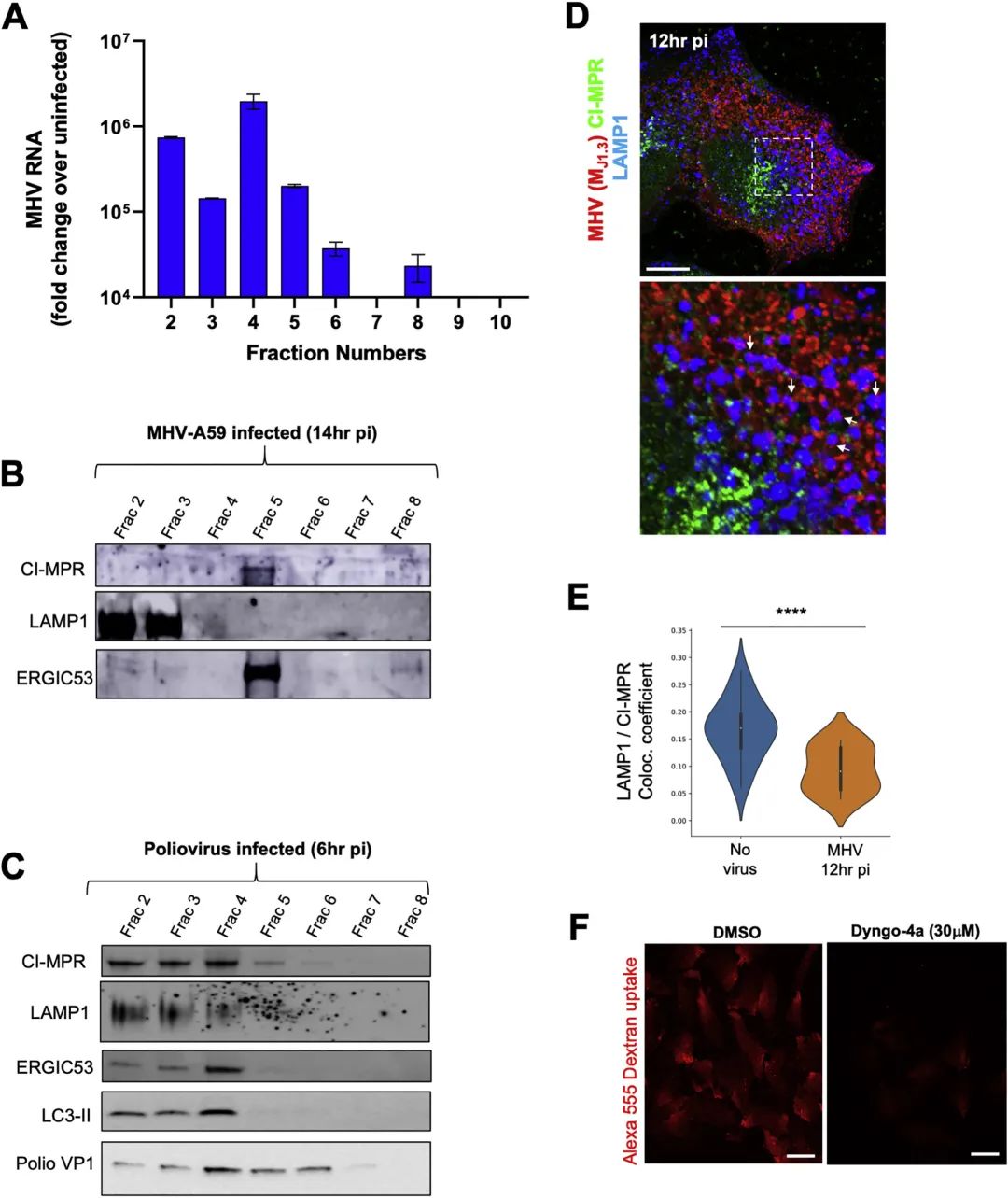
另外,研究人员在本文中报道了KDEL受体及其货物——含有ER伴侣GRP78/BIP和钙网蛋白(未显示)的KDEL序列与冠状病毒被选择性地共同转运至溶酶体,并与它们共同释放到细胞外(图2)。相反,其他分泌途径的驻留蛋白,如甘露糖苷酶II、TGN46,Golgin97、ERGIC53或CI-MPR仍然在细胞内,不与溶酶体共同运输(图3和图4)。在ER,GRP78/BIP作为分子伴侣可能会结合并帮助折叠新合成的冠状病毒蛋白。令人惊讶的是,研究人员的发现表明当冠状病毒通过胞吐溶酶体排出时,GRP78/BIP与病毒蛋白的这种相互作用得以维持。值得注意的是,跟据既往报道,在进入过程中,GRP78/BIP与SARS/MERS的相互作用增强了这些病毒的感染性(Chu et al., 2018),并且,据推测SARS-CoV2的S蛋白与GRP78/BIP直接结合(Ha et al., 2020)。因此,通过胞吐溶酶体维持这种相互作用的一个优点可能在于,冠状病毒一排出细胞外就准备好了感染附近的细胞,而无论细胞外是否存在GRP78 / BIP,都无法限制冠状病毒感染其他细胞。
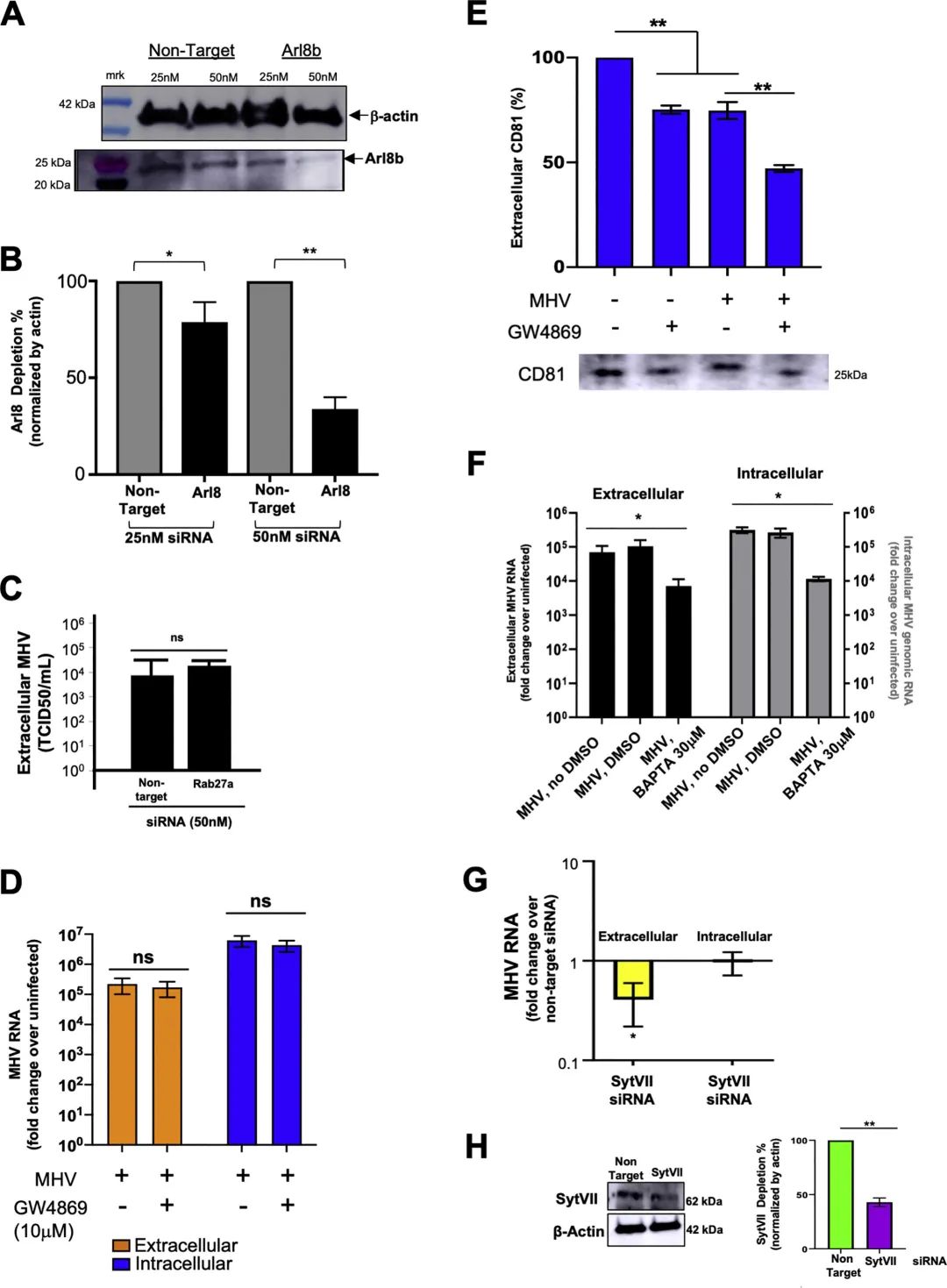
钙可调节溶酶体的胞吐作用(Rodríguez et al., 1997)。当细胞内的钙储存与BAPTA-AM螯合时,他们发现MHV排出细胞的水平下降了约~2-log。但是复制也减少了(图5F)。另一方面,突触结合蛋白VII(被认为是溶酶体与质膜融合的钙依赖性触发物)(Martinez et al., 2000)的耗尽导致病毒的排出减少,但不会显著地影响病毒复制(图5G和5H)。在β-冠状病毒的释放中,钙、突触结合蛋白和其他成分发挥的确切作用还有待进一步研究。
溶酶体蛋白水解酶的活性对于许多关键的细胞过程至关重要,包括细胞自噬、细胞运动、胆固醇代谢、T细胞释放细胞杀伤酶、巨噬细胞降解病原体,以及细胞呈递自身/非自身抗原。溶酶体酶的稳定性和酶活化需要溶酶体酸化,即使是pH值的小幅增加,也足以抑制这些酶并停止其关键的生物学功能(Mindell, 2012)。在此,研究人员显示,感染β-冠状病毒的细胞发生了溶酶体的显著脱酸,并伴随着溶酶体酶活性的降低(图6B-F)。此外,他们发现,受感染的细胞比未受感染的细胞向细胞外环境分泌了更多的溶酶体酶。脱酸的机理目前正在研究中。一种可能性是溶酶体因为装载过多的货物(即病毒)和/或质子泵或离子通道运输中的干扰而发生了间接脱酸(Ballabio and Bonifacino, 2020)。另一种可能性是,脱酸可能是特定冠状病毒蛋白作用的结果,其行为类似病毒孔蛋白。
既然冠状病毒通过溶酶体通路脱离细胞,那么抑制溶酶体通路能不能减少病毒的释放呢?为此,研究人员使用一种名为CID1067700的抑制剂来抑制溶酶体的生成。他们发现,虽然这种抑制剂不会影响细胞的活力,或者病毒的感染和复制,但是它显著降低了病毒的释放。在4 µM时将病毒释放降低了100倍,在40 µM时病毒释放降低了1000倍。
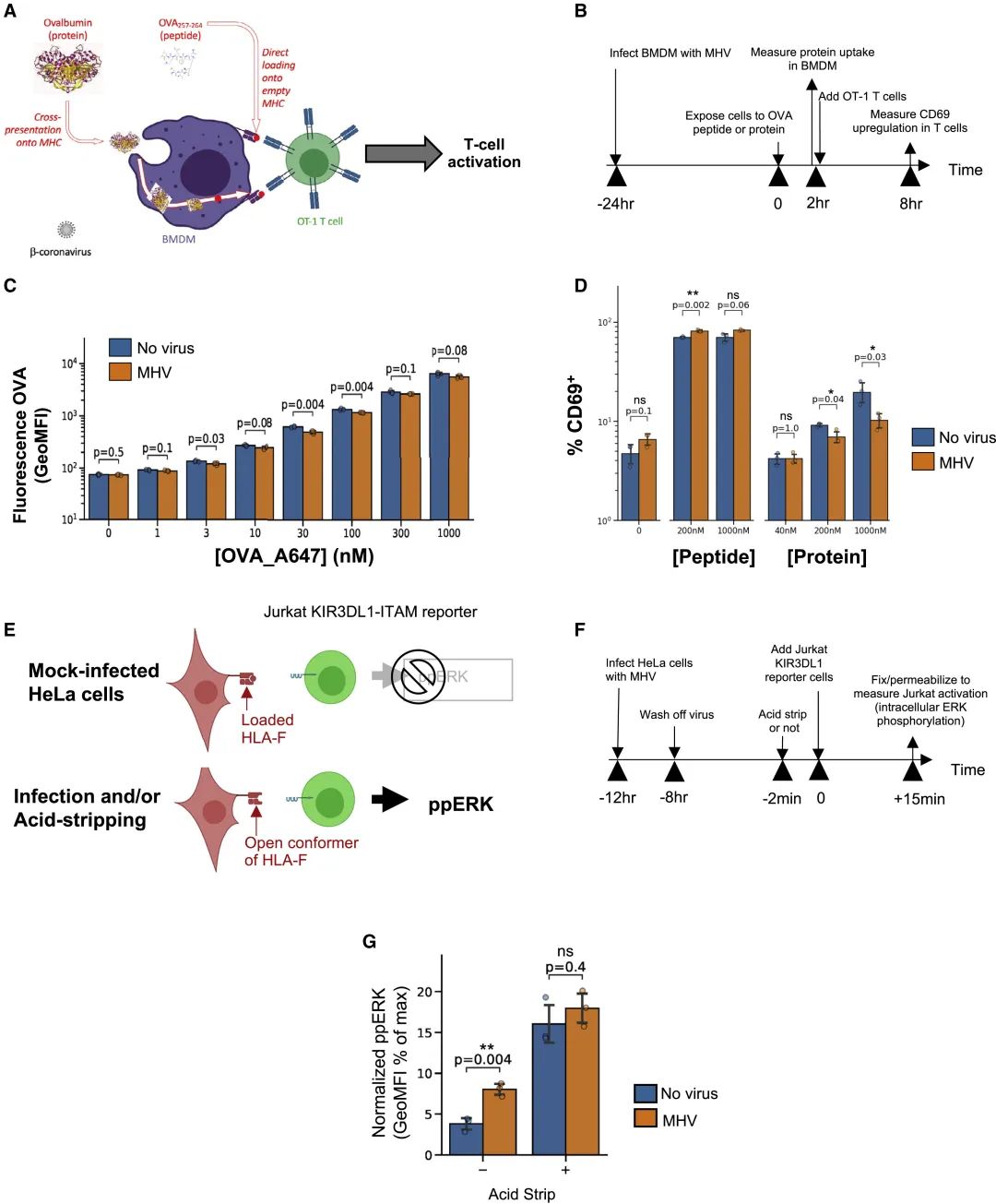
本研究的发现在此表明,感染β-冠状病毒的细胞溶酶体功能改变可导致抗原呈递的干扰并导致免疫应答反应发生改变(图7)。因为COVID-19大流行产生的大量研究表明,冠状病毒诱发的免疫应答可能是异常的和有问题的(Vardhana and Wolchok, 2020)。确实,临床医生和基础免疫学家难以根据他们目前对病毒或癌症的免疫应答知识来解释观察到的结果(Vardhana和Wolchok)。如果我们能够充分认识冠状病毒的细胞生物学及其在改变抗原呈递方面的功能结果,可能会开辟新的研究路径,例如探究NK细胞对冠状病毒感染细胞的反应。在感染HIV-1的患者中,表达KIR3DS1的NK细胞可能与延缓艾滋病进展有关(Martin et al., 2002),或与H1N1感染的严重程度加重有关(Aranda-Romo et al., 2012)。HLA-F(一种已知激活KIR3DS1并抑制KIR3DL1受体的配体)的开放构象体呈递增加的发现,可能对冠状病毒感染引发的免疫反应产生正面或负面的影响(Garcia-Beltran et al., 2016)。此外,这种通过溶酶体运输的排出细胞方式也可能导致需要破坏酸化的溶酶体Toll样受体信号转导通路(de Bouteiller et al., 2005)。最近有研究发现,一种非包膜病毒在其排出细胞时也使用了溶酶体(Fernández de Castro et al., 2020)。本研究发现了溶酶体在宿主细胞生理过程(包括抗原呈递和先天免疫)中发挥的功能作用,这很可能会让人们发现越来越多的病毒利用这些细胞器排出细胞。
小结
总而言之,本研究结果表明,β-冠状病毒使用溶酶体排出细胞,这是研究人员此前未曾预料的。这可能会开辟新的治疗途径,以减轻冠状病毒感染和病毒的缓慢传播,例如靶向溶酶体运输和生物发生的调节因子(如Arl8b和Rab7)、逆转脱酸反应和/或增强对抗溶酶体缺陷的免疫应答反应等。
“溶酶体通路提供了一种构建靶向疗法的全新思路。” Dr Altan-Bonnet说。她的研究团队正在进行进一步研究,检验这类药物干预能否有效降低冠状病毒的传播,以及是否有已经获批的药物能够阻断这一通路。她同时表示,这一研究可能帮助防治未来由其它冠状病毒引起的流行病。

原文刊载于CellPress细胞出版社旗下期刊Cell上,点击“阅读原文”查看论文
▌论文标题:
β-Coronaviruses Use Lysosomes for Egress Instead of the Biosynthetic Secretory Pathway
▌论文网址:
https://www.cell.com/cell/fulltext/S0092-8674(20)31446-X#%20
▌DOI:
https://doi.org/10.1016/j.cell.2020.10.039
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




