- +1
【学术前沿】小结构大用处|可影响与DNA结合的奇妙小分子们
以下文章来源于药学速览 ,作者Timothy

药学速览
药学与生命科学领域的文献,前沿,科普与趣闻分享。

关注我们,获取更多相关资讯

今天分享的是西班牙USC研究团队的在Accounts of chemical research上题名为Stimuli-Responsive DNA Binding by Synthetic Systems的一篇综述。文章中主要总结了通过合成得到的刺激响应的DNA binders的发展,主要是通过刺激效应改变了转录因子(人为合成的含有可被刺激响应的化学结构)对DNA结合与解离,进而调控下游的生理活动。突出强调了该团队在此过程中间的一些工作,由于篇幅有限,在这里我们不讨论谁完成了具体什么工作,仅陈述文献中提到的DNA binders的特点,目的是给大家展示一下概念,感兴趣的朋友可以阅读原文。
▉ 总览
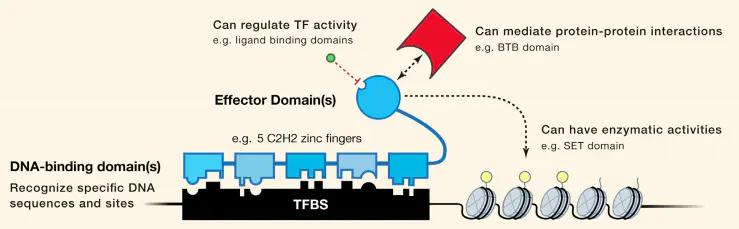
典型的转录因子功能示意图(Schematic of a prototypical TF)
DNA是生物体中负责储存和传递遗传信息的分子。这一信息的表达是受到高度管制的。在真核生物中,这主要是在转录水平上实现的,因为转录因子(transcription factors, TFs)可以识别特定的DNA序列,通过DNA-蛋白质相互作用来调节转录活性,从而促进或抑制特定基因的转录从而影响基因的的表达。在许多情况下,TFs以非活性形式存在于细胞中,但在外部信号的作用下变得活跃。
TFs通常由DNA结合域和转录激活域组成,常见的DNA结合域有:helix-turn-helix(HTH)结构、锌指(zinc finger)结构、碱性-亮氨酸拉链(basic-leucine zipper,bZIP)、碱性-螺旋-环-螺旋(basic-helix/loop/helix,bHTH)。本文讲的这些合成的DNA binders都是基于TFs的DNA结合域改造而成的。
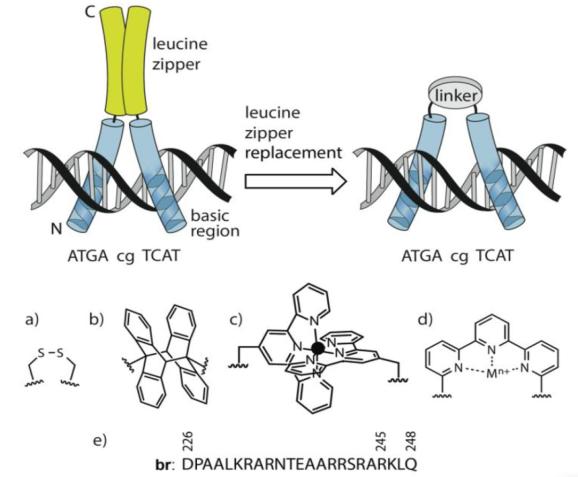
如上是结构域二聚体示意图,亮氨酸拉链用黄色高亮表示,碱性区域(DNA结合区域)用蓝色高亮显示,灰色的linker代表用合成连接剂替代亮氨酸拉链。
bZIP由亮氨酸拉链和碱性区域(这里碱性区域一般是带正电的,所以容易和负电的DNA结合)两者的二聚体构成,研究人员将亮氨酸拉链用合成linker化合物替换掉,且不影响与DNA结合能力。后面的工作则是在此基础上,设计不同的linker或以修饰bZIP等方式达到DNA binding可控的目的。
▉ 举例讨论
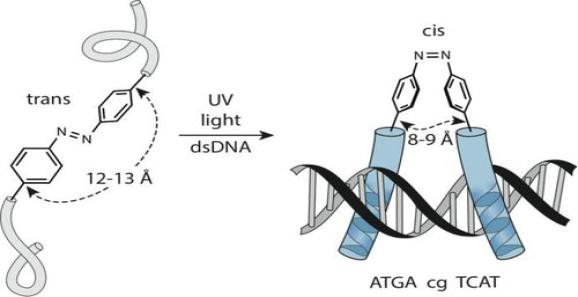
经UV照射后tran异构体转变为cis异构体
文中陈列了多种由光控制DNA结合能力的合成的binders,基本都是基于给DNA结合区域某个位置上加上光不稳定保护基团和光异构基团两种策略设计的。上图中,两个DNA结合的单体通过偶氮苯连接。cis异构体的DNA结合能力是trans异构体的60倍,偶氮苯反式构型时,两个与DNA结合的之间的距离较远不易同时结合DNA上的识别位点。经UV照射后tran异构体转变为cis异构体,此时的构象更易结合到dsDNA上。
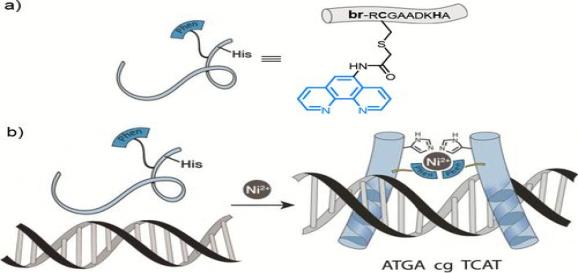
由金属离子激活的DNA binder
金属粒子的配位作用在生物体内广泛存在,研究人员受到锌指结构的启发,设计了一系列金属离子调控的DNA binders。下面分别是由金属离子激活(上图)和失活(下图)的DNA binder。此外,金属离子还被用作多组分dsDNA binders的连接器。
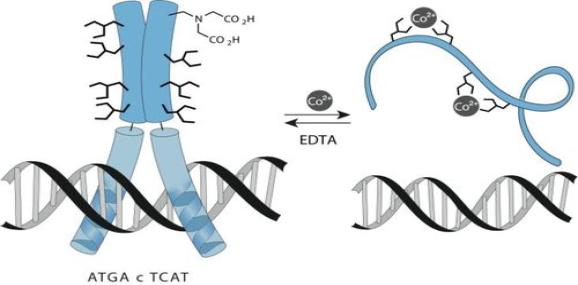
由金属离子失活的DNA binder
在生理条件下,大部分的DNA都是B型双螺旋DNA,然而其他形式也是可能的。G-quadruplexes (GQs,主要结构类型见下图)在端粒和启动子中较为常见,有着重要的细胞调控作用。可以稳定GQs的分子已经被证明可以抑制端粒酶的活性、基因的表达; 相反,破坏四倍体结构的分子会增强端粒酶的活性。GQ DNA binders也同上述一样,基于光调节、金属离子调节两种策略进行设计,结合并影响GQs的结构,从而影响GQs的功能。
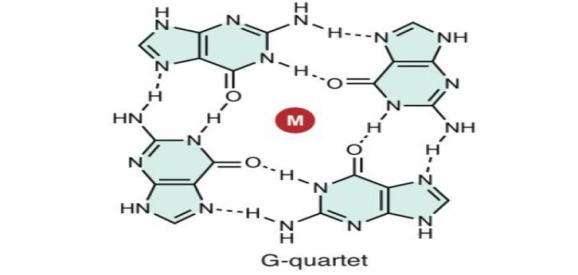
鸟嘌呤四分体在GQ中的化学结构
▉ 总结讨论
文章中各类调控相应的这些工作虽然很抓人眼球,但目前还面临很大的挑战。要设计一个对靶序列有很高的亲和力和选择性是极为困难的事,而且将这些技术应用到生命体中去也是极具挑战的,该文中所陈列的光控的分子目前只有一个应用在活细胞中调控基因转录。此外,进入细胞的能力也是分子设计需要着重考虑的。
来源:药学速览

1980-2020
喜欢此内容的人还喜欢
原标题:《【学术前沿】小结构大用处|可影响与DNA结合的奇妙小分子们》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




