- +1
【学术前沿】张宏团队总结膜生物学中的相分离:有膜细胞器与无膜细胞器的相互作用
以下文章来源于BioArt ,作者BioArt

BioArt
高屋建瓴,提供专家点评,引导学术争论,展现学术批评;诚心实意,关注科研生态,推广科研经验,倡导师生交流。

关注我们,获取更多相关资讯
真核细胞相较于原核细胞,重要区别之一是真核细胞中存在着各种由膜包裹形成的细胞器,如细胞核、内质网、线粒体、溶酶体及脂滴等。这些有膜细胞器把细胞分隔成一独立的空间,进而保障细胞内各种反应能够在特异空间内发生。同时这些细胞器又可以通过囊泡运输和膜互作等多种方式进行着物质、信息和能量的交流。近年来,人们发现细胞内还存在着一类无膜细胞器,如P小体(processing body)、应激颗粒(stress granule)、旁斑(paraspeckles)等。这些无膜细胞器通过液-液相分离(liquid-liquid phase separation,LLPS)形成()。相分离解释了在没有膜结构参与的情况下(),细胞内特定分子如何聚集并维持成具有一定流动性的液体状态,在细胞内的特定区域完成其生理功能【1-3】。最近越来越多的研究发现有膜细胞器和无膜细胞器之间存在着紧密的联系,协同参与多种生理活动。
2020年10月12日,中国科学院生物物理研究所张宏研究员应邀在Developmental Cell杂志上发表题为:Phase separation in membrane biology: the interplay between membrane-bound organelles and membraneless condensates的综述文章。此文章作为Developmental Cell封面进行展示,首次系统地总结了现有关于有膜细胞器与无膜细胞器相互作用方面的研究,通过多个方面探讨了两种细胞器互相影响的方式,以及如何彼此协调从而实现细胞内各种重要的生命功能。

封面图:图正中橱窗内球状结构代表蛋白质(小棒状结构)形成的无膜细胞器;右侧橱窗内呈现了蛋白凝集体在内质网(深灰色网状结构)表面形成;左侧橱窗内展示了线粒体(肾形结构)聚集在蛋白凝集体中(如早期发育阶段卵细胞内的Balbiani小体)。此封面为清华大学美术学院张善锐创作。

1. 细胞膜为无膜细胞器形成提供平台
虽然细胞里很多凝集体在细胞质或核质内形成并呈球状,如P小体和应激颗粒;但也存在另一类凝集体可以在膜表面形成,且形状多数不规则。细胞膜做为细胞内外沟通的关键结构,可以直接激活蛋白相分离过程。细胞膜受到外界信号刺激后,通过限制蛋白分子扩散和/或促进蛋白相互作用等途径,降低下游蛋白发生相分离的浓度,促进蛋白相分离形成凝集体,以实现特定功能。
例如,细胞膜表面的肾素粘附复合物(nephrin adhesion complex)和T细胞受体(T cell receptor,TCR)被激活后,通过自身的SH2和SH3结构域或下游含SH2和SH3结构域的蛋白及PRM蛋白发生多价结合,引起相分离,进而激活下游反应【4,5】。相分离也通过在局部细胞膜下形成凝集体,参与细胞不对称分裂过程和细胞紧密连接(tight junction)的建立。
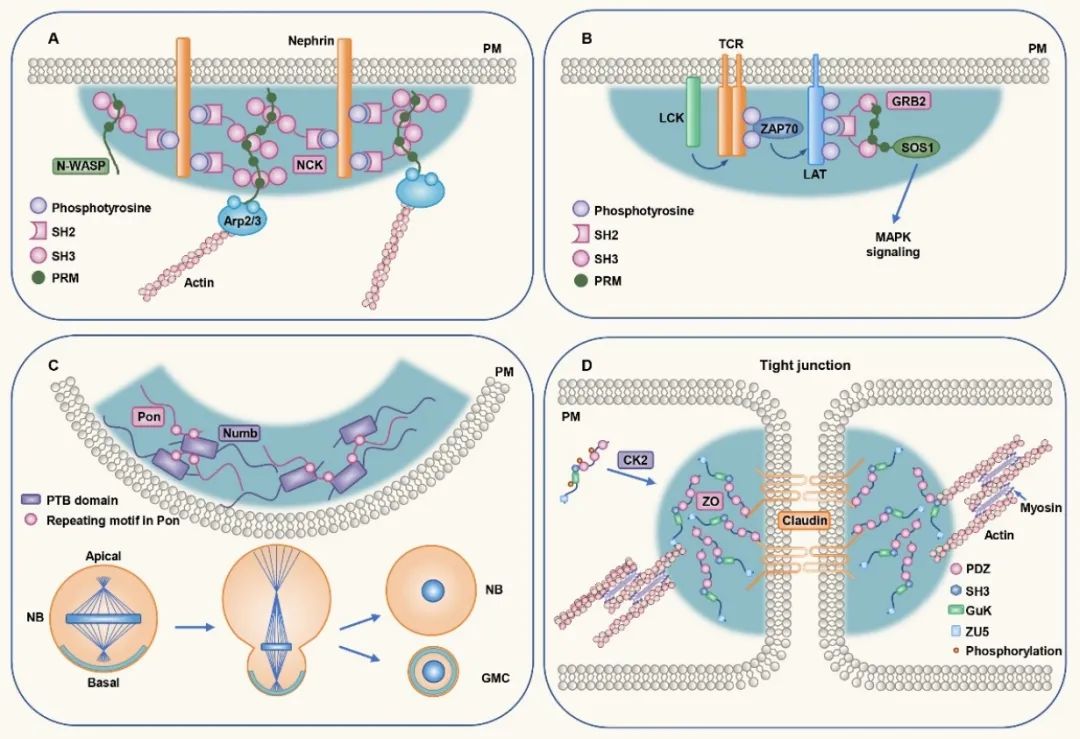
图1. 蛋白凝集体在细胞膜表面形成
2. 内质网调控无膜凝集体的生成和动态变化
内质网作为细胞内最大的细胞器,由片状和管状两种形态交互形成网状结构。内质网是蛋白翻译的重要场所,也是多种细胞器形成的关键部位。在调控无膜细胞器方面,内质网同样发挥了重要作用。
哺乳动物中,不同的膜蛋白mRNA剪切体,由于3’非翻译区(3’untranslated region,3’UTR)的差异,可以引导同样的蛋白定位于细胞不同部位并发挥功能。Ma等人发现RNA结合配体蛋白TIS11B可以发生相分离,形成TIS颗粒。TIS颗粒与内质网相互交织形成网状结构,从而将含有富含AU序列的mRNA局限其中,促进mRNA与效应蛋白SET的相互作用,最终帮助蛋白正确定位【6】。饥饿条件下,分泌途径COPII组分在内质网输出位点(ER exit site, ERES)形成凝集体,作为一种保护机制帮助细胞存活。自噬早期蛋白也在内质网特定位点发生相分离,触发自噬小体的成核和延伸。另外,内质网还可以与调控P小体和应激蛋白的形成,并通过与这些核糖核蛋白(ribonucleoprotein,RNP)小体直接接触调控其分裂【7】。
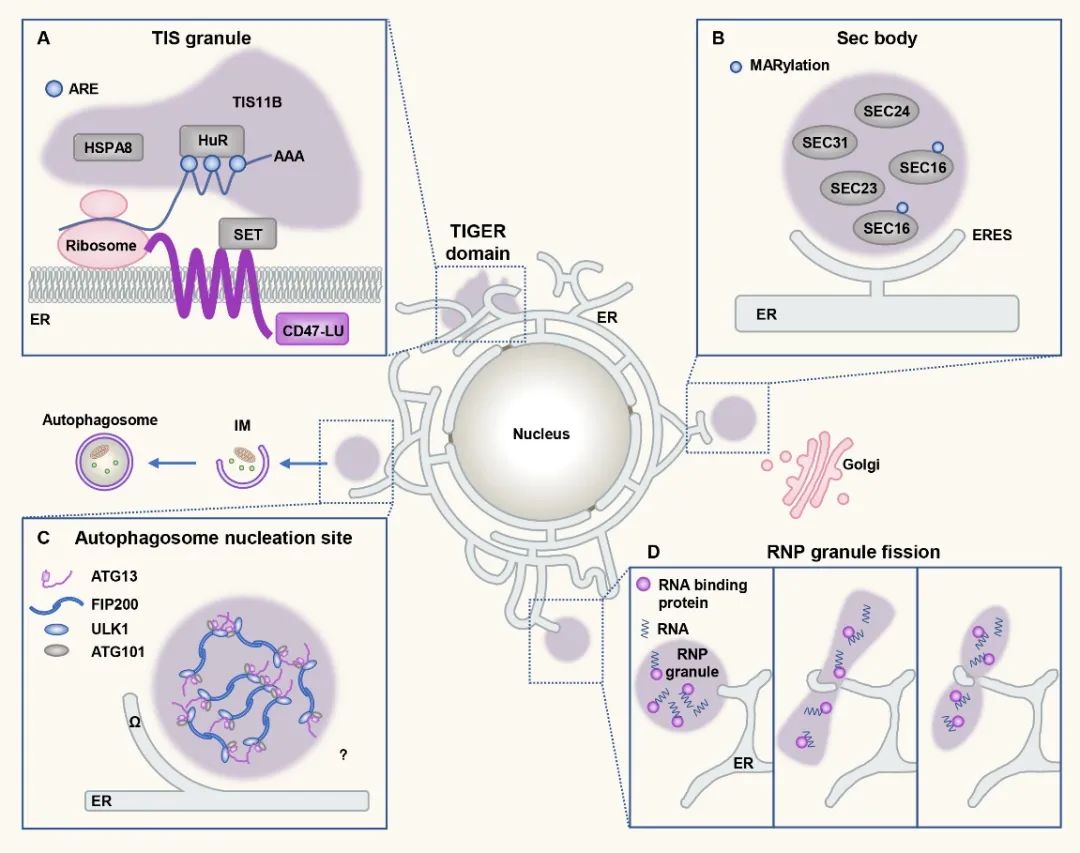
图2. 内质网为无膜细胞器形成提供位点,参与无膜细胞器的分裂
3. 蛋白相分离帮助有膜细胞器形成聚集体
相分离过程不仅存在于蛋白分子之间,脂类也可以发生相分离,形成特异的膜结构如脂筏。囊泡膜上的脂类通过与蛋白质相互作用,可以形成蛋白囊泡凝集体。这种凝集体结构兼具相对稳定且易于调控的特性,不仅有助于囊泡的局部储存,而且在受到刺激后囊泡可以快速解离并释放。
例如,神经突触中的突触小泡表面蛋白synapsin 1,富含SH3结构域,可以通过相分离形成液滴样凝集体,从而使突触小泡形成聚集体。当突触受到刺激时局部钙浓度发生变化,CaMKII被激活并磷酸化synapsin 1,破坏聚集体的稳定性,最终引起突触小泡的解离和释放【8】。分泌途径、病毒感染和卵细胞发育等过程中,均存在相似的相分离调控囊泡聚集现象。
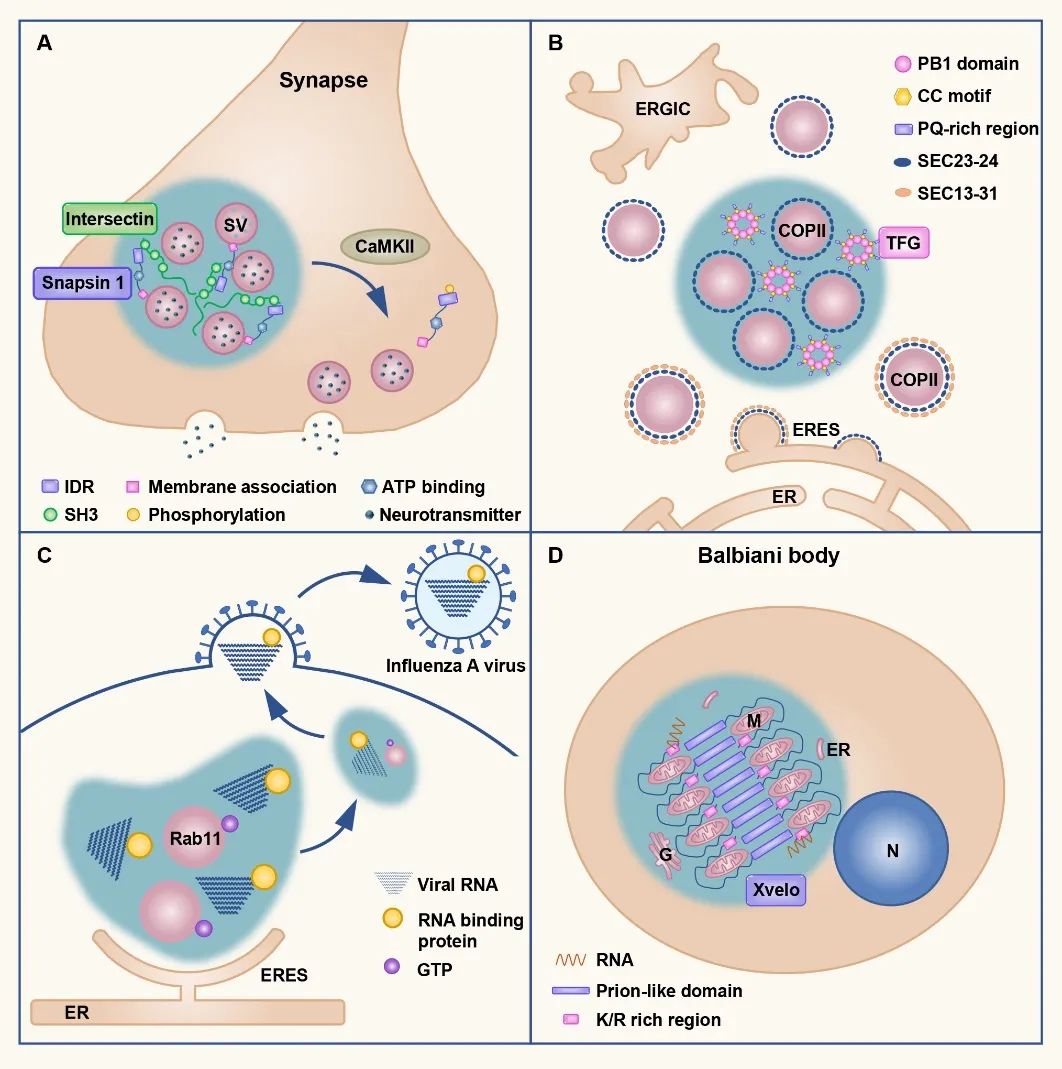
图3. 相分离介导有膜细胞器的聚集和储存
4. 有膜和无膜细胞器协同完成蛋白质转运
蛋白质在内质网合成后,需要通过多种途径定位到正确部位发挥功能。除经典的分泌和转位子(translocon)途径外,相分离也可以促进蛋白的转运。相分离形成的各种核糖核蛋白小体,可以通过蛋白间的相互作用锚定在细胞器上,并随着细胞器定向运动达到远距离运输目的。为了达到特异的跨膜转运,蛋白也会通过相分离形成凝集体,然后与膜上的转位子复合体结合并解离,最终达到亚细胞器定位。另外,核孔复合体也是典型的液滴结构,核孔蛋白(nucleoporin,Nup)通过相分离形成筛状结构,小分子可以自由进出,而大分子需通过核受体运输。核受体表面的疏水结构可以局部破坏核孔蛋白的相互作用,进而帮助大分子穿过核孔。
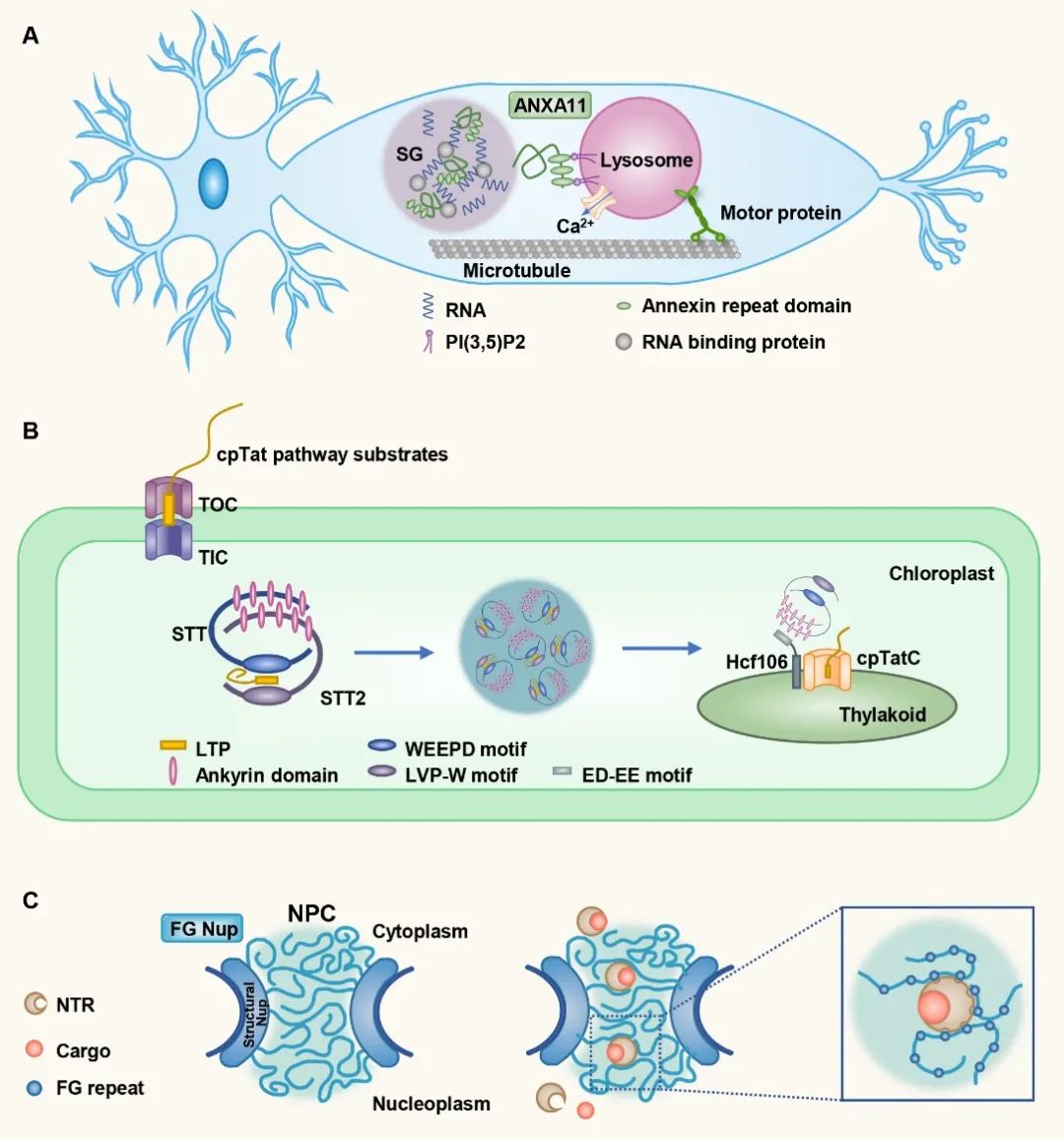
图4. 有膜和无膜细胞器协同完成蛋白质转运
5. 蛋白通过相分离形成聚集体并被自噬小体包裹运输
自噬选择性降解底物的过程,也受到了相分离的调控。底物蛋白首先在各种受体和支架蛋白调节下发生相分离,然后自噬膜围绕聚集体形成。此过程受到了精细的调控,液滴的大小和状态均影响了底物蛋白的自噬降解效率。
张宏实验室通过研究线虫发育早期生殖细胞特有蛋白PGL-1和PGL-3的分布,发现这些蛋白也可以随生殖细胞的不对称分裂进入体细胞,但体细胞中的PGL-1/3会很快被自噬降解。PGL-1/3首先经过相分离聚集成液滴,然后被支架蛋白EPG-2包裹形成流动性较低的胶化状态,最终引起自噬小体围绕液滴形成【9】。酵母中自噬底物蛋白Ape1的降解需要经过类似的相分离和胶化过程【10】。自噬底物p62和应激颗粒的凝集状态也影响其自噬降解效率,且与疾病状态密切相关。这些结果说明凝集体的胶化状态可能对于膜的延伸或形变有重要影响。
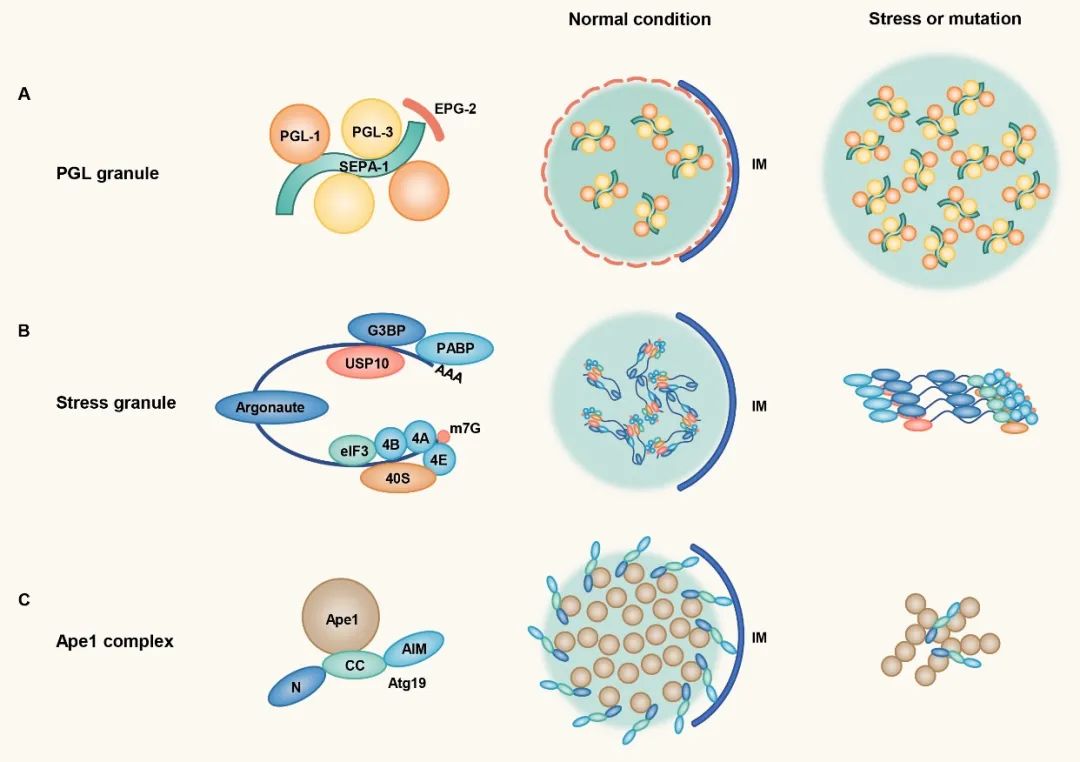
图5. 自噬小体围绕特定状态的蛋白凝集体形成
总结和展望
以上这些研究揭示了有膜细胞器和无膜细胞器之间存在着广泛的相互作用,并参与了一系列生命过程。膜结构为相分离提供了平台,同时也主动参与了相分离过程的调控。反之,相分离也影响了有膜细胞器的组织、储存和释放。无膜细胞器的形成帮助了蛋白的高效转运,也促进了底物蛋白的自噬降解。但是这些研究仅是个开端,这个领域有更多的问题未能解决,更多的未知有待发现,对两种细胞器之间的调控和功能进行深入探索将帮助我们破解更多细胞生物学的未解之谜。
中国科学院生物物理研究所张宏研究员为本文通讯作者,麻省大学医学院赵燕(近期加入南方科技大学生命科学院)为本文第一作者。
原文链接:
https://www.cell.com/developmental-cell/pdf/S1534-5807(20)30541-4.pdf
参考文献
1. Banani, S.F., Lee, H.O., Hyman, A.A., and Rosen, M.K. (2017). Biomolecular condensates: organizers of cellular biochemistry. Nat. Rev. Mol. Cell Biol. 18, 285-298.
2. Boeynaems, S., Alberti, S., Fawzi, N.L., Mittag, T., Polymenidou, M., Rousseau, F., Schymkowitz, J., Shorter, J., Wolozin, B., Van Den Bosch, L., et al. (2018). Protein Phase Separation: A New Phase in Cell Biology. Trends Cell Biol. 28, 420-435.
3. Shin, Y., and Brangwynne, C.P. (2017). Liquid phase condensation in cell physiology and disease. Science 357, eaaf4382。
4. Li, P., Banjade, S., Cheng, H.C., Kim, S., Chen, B., Guo, L., Llaguno, M., Hollingsworth, J.V., King, D.S., Banani, S.F., et al. (2012). Phase transitions in the assembly of multivalent signalling proteins. Nature 483, 336-340.
5. Su, X., Ditlev, J.A., Hui, E., Xing, W., Banjade, S., Okrut, J., King, D.S., Taunton, J., Rosen, M.K., and Vale, R.D. (2016). Phase separation of signaling molecules promotes T cell receptor signal transduction. Science 352, 595-599.
6. Ma, W.R., and Mayr, C. (2018). A Membraneless Organelle Associated with the Endoplasmic Reticulum Enables 3 ' UTR-Mediated Protein-Protein Interactions. Cell 175, 1492-1506.
7. Lee, J.E., Cathey, P.I., Wu, H., Parker, R., and Voeltz, G.K. (2020). Endoplasmic reticulum contact sites regulate the dynamics of membraneless organelles. Science 367, eaay7108.
8. Milovanovic, D., Wu, Y., Bian, X., and De Camilli, P. (2018). A liquid phase of synapsin and lipid vesicles. Science 361, 604-607.
9. Zhang, G.M., Wang, Z., Du, Z., and Zhang, H. (2018). mTOR Regulates Phase Separation of PGL Granules to Modulate Their Autophagic Degradation. Cell 174, 1492-1506.
10. Yamasaki, A., Alam, J.M., Noshiro, D., Hirata, E., Fujioka, Y., Suzuki, K., Ohsumi, Y., and Noda, N.N. (2020). Liquidity Is a Critical Determinant for Selective Autophagy of Protein Condensates. Mol. Cell 77, 1163-1175.
来源:BioArt

1980-2020
喜欢此内容的人还喜欢
原标题:《【学术前沿】张宏团队总结膜生物学中的相分离:有膜细胞器与无膜细胞器的相互作用》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




