- +1
【科技前沿】Protein & Cell综述:前列腺癌中先锋转录因子FOXA1的过去、现在和未来
前列腺癌是北美男性中最常被诊断的非皮肤癌,主要由雄激素受体(Androgen Receptor, AR)信号所驱动。鉴于此,靶向AR信号传导已成为主要的治疗策略。尽管AR通路抑制剂治疗已有进展,但转移性疾病,例如转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)和神经内分泌前列腺癌(neuroendocrine prostate cancer, NEPC),仍存在于30%的患者中。由于缺乏有效的靶向疗法来克服耐药性,mCRPC和NEPC仍然具有致死风险。因此,需要新策略来应对前列腺癌,尤其是在晚期转移性阶段。
近日,来自加拿大多伦多玛格丽特公主癌症中心的Mathieu Lupien课题组和Housheng Hansen He(何厚胜)课题组在Protein & Cell 杂志上发表了一篇题为“Pioneer of prostate cancer: past, present and the future of FOXA1”的综述,作者总结了近些年来先锋转录因子FOXA1在前列腺癌中的最新研究,并基于这些发现为临床治疗提供了有价值的观点。

一、FOXA1在前列腺癌中的突变率
FOXA1(Forkhead box A1)的编码序列分别在高达9%的原发性前列腺癌和13%的mCRPC发生反复突变。在另一种转移癌NEPC中,一项针对29个肿瘤组织的研究确定了约25%的肿瘤存在定位于FOXA1的单核苷酸变异(single nucleotide Variants, SNVs)。最近一项数据表明,FOXA1的突变频率与种族背景相关。对中国前列腺癌基因组和表观基因组图谱队列的分析显示,在41%的原发前列腺肿瘤中存在FOXA1突变,且这一比例显着高于西方人群。
尽管在整个FOXA1编码序列中都可能发生突变,但其中有50%以上映射到编码Forkhead DNA结合域的核苷酸。发生在Forkhead域的突变主要包含错义点突变和插入缺失突变(indels),且大多数都位于编码第二翼环残基(Wing2,残基247-269)的核苷酸处,这对于DNA结合和核运动十分重要。Wing2突变被认为存在于前列腺癌诊断时病灶处于原位阶段(localized stage),而在转移性前列腺癌中没有丰富的表现。除Forkhead域中的突变外,截短移码占FOXA1突变的20%,仅限于Forkhead域下游C端,且在转移性前列腺癌中显着富集。
二、FOXA1的编码突变引起转录因子活性改变
有研究报道,影响Forkhead Wing2 loop的突变,例如M253K,FENG254-7> C和F266S可以降低FOXA1的DNA结合亲和力。这些突变体表现出功能丧失的表型,比如在野生型FOXA1敲低的LNCaP细胞中,它们无法恢复FOXA1介导的基因表达。此外,FOXA1突变体可以重塑前列腺癌中可及染色质景观。通过使用ATAC-seq,可以观察到与对照组相比,过表达野生型FOXA1的在小鼠前列腺类器官中导致可及染色质峰超过1000个。有趣的是,与野生型相比,FOXA1 Forkhead突变体(例如ΔF254/ E255和R219S)增强了先锋转录因子活性,即可以诱导产生更多的染色质可及位点,且开放速率也快约5倍。尽管这两种突变体引起类似的结果,但这些位点的无监督聚类分析却显示出截然不同的模式。具体而言,ΔF254/ E255突变体在与野生型FOXA1相似的基因组位置显示出可及的染色质峰;相反,R219S突变体诱导出新的可及染色质区域,该区域富集了非经典的Forkhead结合基序。其他Forkhead突变体(例如D226G和M253K)也导致从经典Forkhead结合基序到非经典基序的偏好发生变化。
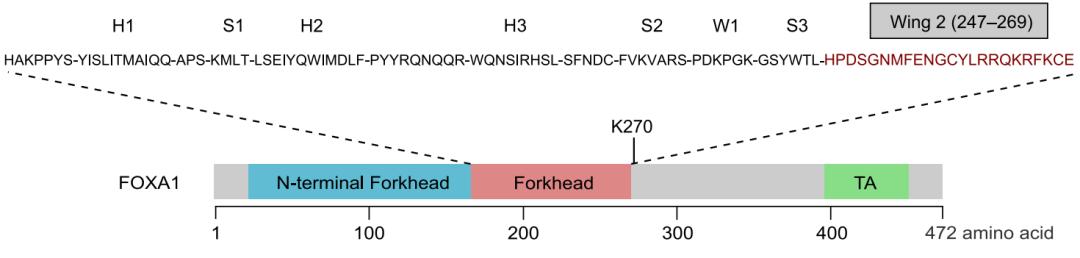
图1,FOXA1功能域示意图
FOXA1作为AR的关键调节因子,其突变可影响两者的相互作用,从而改变雄激素信号传导。已有研究报道FOXA1可以促进和抑制AR的功能,提示两者之间的复杂相互作用。诸如TCGA等大型肿瘤队列分析显示,与正常组织和其他前列腺肿瘤亚型相比,具有FOXA1突变的肿瘤具有更高的AR转录特征,小鼠前列腺类器官研究进一步支持了TCGA中的发现。相反,也有研究报告指出FOXA1突变体导致AR信号转导下调,表明存在抑制功能。在表达Forkhead突变体(例如D226G,H247Y和M253K)的LNCaP细胞中,FOXA1和AR在AR调控基因(例如NKX3-1和KLK3)增强子处的结合显着降低。这些突变体由于与AR的相互作用增加但染色质结合能力降低而可能阻止AR与染色质的结合。
结合以上两点,FOXA1编码突变的研究显示出在调节AR信号传导和开放的染色质景观方面的独特活性。FOXA1突变体由于突变不同而具有不同的活性,从而影响前列腺癌进展的特定阶段。
三、FOXA1的编码突变可以促进EMT和癌转移
有研究表明,表达FOXA1 C端截短突变体的22RV1前列腺癌细胞显示出转录活性β-catenin的累积,这表明WNT通路被激活。这些细胞在体外显示出2至3倍的侵袭增加,并在斑马鱼胚胎中显示出更高的转移能力。就机制而言,C端截短突变体激活上皮-间充质转化(epithelial-to-mesenchymal transition, EMT)可能是由于与作为WNT阻遏物的TLE3的相互作用丧失有关。几个错义突变和插入缺失突变的Forkhead突变体也显示出相似的诱导EMT和转移的能力。值得注意的是,表达FOXA1突变体R219S的小鼠前列腺类器官的RNA测序结果显示EMT基因的富集,这在其他Forkhead突变体(例如D226N和ΔF254/ E255)中并未观察到。EMT在表达D226G,H247Y和M253K FOXA1的 Forkhead突变体的CWR22-RV1 mCRPC细胞中也被激活。
然而,目前尚不清楚这些FOXA1突变体如何诱导EMT,是抑制EMT的能力丧失还是直接诱导基因表达变化的突变体功能增强?尽管如此,EMT抑制仍可能作为治疗具有FOXA1突变的转移性前列腺癌的新策略。FOXA1突变体激活EMT的能力可能在某些类型(例如NEPC)的前列腺癌转移和进展中起作用。

图2,正常前列腺(A)和前列腺癌(B)中FOXA1活性的示意图
四、富集于FOXA1 CREs的突变
驱使致癌基因表达
基因组通过顺式调控元件(cis-regulatory elements, CREs)之间的三维染色质环化相互作用而被组织调控,这促成了细胞类型特异性基因表达程序。在癌症中,包括SNVs和结构变异(structural variants, SVs)在内的突变可以改变CRE之间的活性和相互作用,从而驱动异常的基因表达,这在FOXA1中尤其明显。
FOXA1的表达被前列腺癌各个阶段的非编码突变所影响,功能研究揭示了6个参与调节FOXA1 mRNA表达的CREs,每个CRE的缺失导致FOXA1 mRNA表达和LNCaP前列腺癌细胞的生长显着降低。在原发性前列腺癌中,来自5/200名患者的6例SNVs(占2.5%)映射到这6个CREs。此外,在mCRPC中存在两种涉及FOXA1 CREs的易位事件。第一,涉及将来自其他染色体(即ASXL1,ERG,ETV1,MYC和SKIL)的基因重新定位在称为FOXMIND的FOXA1 CRE的附近。第二,涉及在FOXA1启动子上游插入强力的癌基因,即WNT1,HOXA1和CCNA1。两种易位事件都劫持了FOXA1 CREs的顺式调节活性,从而显着上调了mCRPC中这些基因(包括FOXA1)的致癌表达。
五、非编码突变改变了FOXA1与全基因组的结合
种系单核苷酸多态性(single-nucleotide polymorphisms, SNPs)和体细胞SNVs可以调节FOXA1的基因组结合和转录调控。全基因组关联研究(GWAS)确定了160多个与前列腺癌易感性相关的风险基因座,其中大多数SNPs定位于非编码基因组。这些SNPs具有通过调节转录因子(例如FOXA1)与CREs的结合而赋予疾病风险的能力。对前列腺癌风险SNPs和体细胞SNVs进行全基因组分析,发现它们在FOXA1及其他主要转录因子(包括AR,HOXB13和SOX9)的结合位点富集,更深入的分析表明从200例原发性前列腺肿瘤中鉴定出的> 270000例SNVs在这些主要转录因子的肿瘤特异性和共享结合位点富集。
六、翻译后修饰改变FOXA1活性
除了转录调控外,还存在乙酰化、磷酸化、甲基化以及添加小泛素样修饰剂(small ubiquitin-like modifiers, SUMO)的形式来调节翻译后FOXA1的活性。据报道,FOXA1被组蛋白乙酰转移酶p300在11个的赖氨酸残基处乙酰化,其中5个聚集在Forkhead域内,而乙酰化可以减弱FOXA1与DNA的结合并降低其重塑染色质的能力。同样,在FOXA1的赖氨酸残基上添加SUMO也会导致其转录活性和核迁移性下调,此外还有关于FOXA1被c-Abl磷酸化的报道。这些都表明FOXA1会经历各种翻译后修饰。
值得注意的是,赖氨酸特异性脱甲基酶1(Lysine specific demethylase 1, LSD1)介导的甲基化已被确定为调节FOXA1活性并具有作为靶向FOXA1通路的临床治疗潜力的另一种机制。LSD1被称为转录阻遏物,可以使甲基化的H3K4me1 / me2脱甲基。除了其阻遏物功能外,LSD1还作为AR信号的共激活因子参与前列腺癌的治疗。在LNCaP细胞中用siRNA敲低LSD1后,雄激素刺激的基因被广泛抑制。通过免疫沉淀发现FOXA1以与AR无关的方式与LSD1发生物理结合。尽管LSD1被描述为组蛋白脱甲基酶,但它也可以使非组蛋白蛋白质脱甲基化。最近的一项研究表明,LSD1能够使FOXA1的K270残基脱甲基化()。该残基位于Wing2区的羧基末端,并已显示出对FOXA1与核心组蛋白相互作用的重要作用。LSD1使FOXA1 K270脱甲基化是其与染色质的最优结合所必需的。LSD1受到抑制后,大部分FOXA1仍在K270处发生甲基化,这导致整体结合力和诱导染色质开放的能力降低,进而导致FOXA1的先锋转录活性受损,AR信号传导发生显着改变。
结合上述内容,FOXA1活性的调节机制可以通过翻译后修饰(如LSD1)得到解释,打破了多年来对其调节方式“一知半解”的局面,为靶向FOXA1的治疗开辟了一条新途径。
七、基础研究发现到临床应用转化
尽管最近研究提供了有关FOXA1的令人兴奋的新见解,但有关其临床实用性的问题仍然存在,针对FOXA1在前列腺癌不同阶段影响的研究表明了与预后,治疗反应和靶向治疗相关的新功能。
化学拮抗FOXA1及其下游通路
已知诸如FOXA1之类的转录因子由于其核定位和作用机制而难以直接抑制。现代技术正在扩展我们的“工具箱”,从其他角度抑制FOXA1。一个例子是LSD1调节FOXA1活性的新发现,这表明使用LSD1抑制剂可能是拮抗前列腺癌FOXA1活性的可行方法。在临床前动物模型中,使用和不使用enzalutamide的LSD1抑制剂(例如GSK2879552和SP-2509)已显示出抑制前列腺肿瘤细胞生长的功效。此外,靶向LSD1具有优势,因为几种抑制剂(例如IMG-7289和ORY-1001)目前正处于针对原发性血小板增多症,急性髓细胞性白血病和其他疾病的2期临床试验中。将LSD1抑制剂与现有疗法(例如恩杂鲁胺enzalutamide)组合使用可在前列腺癌控制中实现协同作用。
除表观遗传因素外,参与DNA损伤修复途径的PARP-2也可能是治疗靶标,因为据报道它是FOXA1的相互作用因子,可促进AR募集和转录。靶向FOXA1调节的途径(如EMT)也可能是与抗雄激素治疗相结合的治疗策略。FOXA1的下调显示会导致TGF-β信号传导和EMT激活,而TGF-β受体I抑制剂LY2157299可以阻止FOXA1的表达。LY2157299的使用证明与enzalutamide结合具有协同作用,可有效抑制mCRPC临床前小鼠模型中的肿瘤生长和转移。
同样,FOXA1 Forkhead编码突变(例如D226G,H247Y和M253K)也会导致EMT激活。因此,在mCRPC异种移植模型中,表达这些突变型FOXA1的细胞对EMT抑制剂克唑替尼治疗敏感,该模型靶向已知诱导EMT的c-Met蛋白。总而言之,针对FOXA1调控的途径(如EMT)可能是改善疾病控制的另一条途径,尤其是对于涉及EMT的转移病例。
考虑到特定FOXA1突变所赋予的普遍性和差异性FOXA1活性,未来的研究可能会考虑使用FOXA1突变体模型系统进行抑制筛选。带有FOXA1突变体的前列腺小鼠类器官的最新发展显示出有望成为鉴定突变体特异性FOXA1抑制剂的有力资源。因为FOXA1也在正常组织中表达,这对于通过最小化毒性来最大化药物化FOXA1的治疗指数尤其重要。这些策略增强了精准肿瘤学的思想,根据患者的FOXA1突变状态选择针对患者进行的个性化治疗。
FOXA1突变检测可用于追踪前列腺癌进程
在前列腺癌各个阶段发现的FOXA1突变提供了追踪疾病进展的机会。由于正常组织不应表现出FOXA1突变,因此将它们列入来自体液(尿液或血液)的靶向测序组可作为追踪微小残留病(minimal residual disease)的方法。
对具有mCRPC患者的血浆游离DNA(plasma cell-free DNA)中的72个前列腺癌驱动基因进行了靶向测序,发现34/290(12%)的患者中有37个体细胞突变定位于FOXA1 3'UTR。实际上,FOXA1在所有72个感兴趣的基因中都具有最高的3'UTR突变率,而插入缺失是主要的突变类型。这些插入缺失可以在前列腺肿瘤的早期发现,并且在其他癌症类型(例如膀胱癌)中不存在,表明前列腺癌具有特异性。上述结果表明FOXA1突变可以在液体活检中很容易检测到,并且有可能充当前列腺癌特异性的生物标记。
最近有研究报道,FOXA1突变在前列腺癌各个阶段的普遍性存在差异,例如,原发疾病中Forkhead Wing2编码突变的早期出现以及转移疾病中截短突变形式和SVs的富集。这恰恰支持了通过FOXA1的突变状态可以推测疾病进展的观点。根据FOXA1突变体的功能变化,应在未来研究中进一步评估不同FOXA1突变的预后价值。
综上所述,通过鉴定可拮抗特定FOXA1突变体的抑制剂,该方法可增强个性化治疗。随着肿瘤细胞更新释放游离DNA,用于FOXA1突变的液体活检允许纵向追踪微小残留病灶并早期发现复发前兆。
讨论
总的来说,这篇综述向我们展示:FOXA1作为前列腺癌的先锋转录因子,可以诱导染色质构象开放以便与其他转录因子结合;通过与雄激素受体的直接相互作用,影响AR信号传导,从而驱动正常前列腺和前列腺癌细胞的生长和存活;在前列腺癌中,突变多富集于FOXA1的编码序列和顺式调控元件上,以导致功能改变;FOXA1的活性可以通过多种机制(例如LSD1介导的蛋白质去甲基化)进行翻译后修饰的调节等。最后,基于上述基础研究内容,作者认为对体细胞突变和调控机制的更深入了解可能会产生新颖的生物标志物和治疗策略,利用当前高通量手段和模型系统,有望将有关FOXA1的过去、当下和未来的生物学发现转化为临床应用。
原文链接:
https://doi.org/10.1007/s13238-020-00786-8
本文转载自公众号“BioArt”(BioGossip)
由中国生物物理学会主办的
“第十八次中国暨国际生物物理大会”
将于2020年11月15-18日
在广东省广州市召开
欢迎全国各研究机构、高等院校
和企业的科技工作者参加
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
微信号:BSC-1979
原标题:《【科技前沿】Protein & Cell综述:前列腺癌中先锋转录因子FOXA1的过去、现在和未来》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




