- +1
雄性好战?试试抑制这类神经元 | Paper Alert
原创 NR 神经前研 收录于话题#Paper Alert12个
认知与行为
男生爱打架?试试抑制这类神经元
Chen et al., Neuron
@Veronica
新的一部007开演了!当你走进电影院,风度翩翩的硬汉James Bond正和一位有着八块腹肌、面目狰狞的敌人对峙。隔着屏幕你似乎都能嗅出双方荷尔蒙的味道——哈,一场肉搏战马上就要开始了。
电影里的情形或许过于夸张,但这种同性相斥的现象,确实在生物界普遍存在。近日,来自中科院神经所的许晓鸿团队发现,位于下丘脑(hypothalamus)腹侧乳头体核(ventral premammillary nucleus,PMv)的一类特异表达多巴胺转运体的神经元PMvᴰᴬᵀ⁺,在感知与雄性小鼠相关的信息和调控攻击行为中,起了重要的作用。
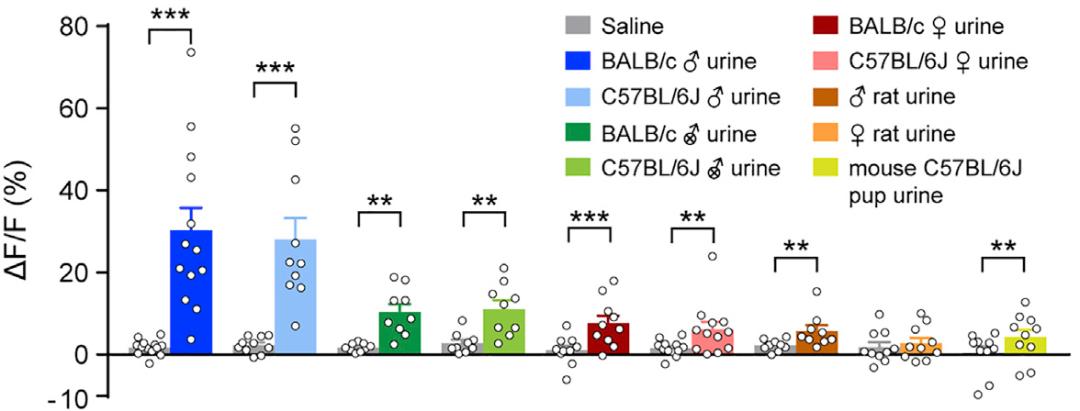
研究者让没有交配经历的“处男鼠”分别去嗅性腺完好的雄性小鼠、去势雄性小鼠、雌性小鼠、幼鼠、雄性或雌性大鼠(大鼠会捕食小鼠)的尿液,和作为对照的生理盐水,同时通过钙信号记录技术(fiber photometry)记录PMvᴰᴬᵀ⁺神经元的活动情况。他们发现,PMvᴰᴬᵀ⁺神经元对各种尿液的反应普遍高于生理盐水,尤其对性腺完好雄性小鼠尿液的反应强度竟然是其他尿液的3至5倍。而相比于雄鼠,雌鼠似乎对不同的尿液并没有特别明显的选择性。也就是说,“处男鼠”的PMvᴰᴬᵀ⁺神经元,似乎能特异性地“嗅出”同类雄性小鼠的尿液信号。
通过对尿液的组分分析,研究者发现尿液中高分子量(high molecular weight)的成分在这个过程中起了重要的作用。如果将高分子量成分中的尿蛋白纯化出来,同样能引起“处男鼠”PMvDᴰᴬᵀ⁺神经元的特异性反应。
- Chen et al., Neuron -
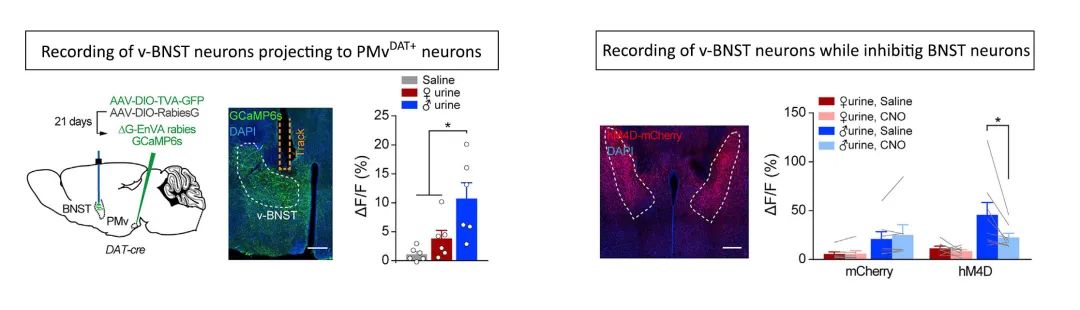
接着,研究者导演了小鼠版的007桥段,将一只雄性小鼠扔到了“处男鼠”的笼子里,让两只自由活动的雄鼠单独相处,同时记录PMvᴰᴬᵀ⁺神经元的钙信号。他们发现,在两只雄鼠身体相互接触、互嗅对方生殖器,以及攻击对方时,PMvᴰᴬᵀ⁺神经元被选择性激活了。尤其是在嗅对方生殖器时,钙信号强度是身体接触或攻击对方时的2.5到5倍。有趣的是,如果杀死或者抑制这类神经元,则发现“处男鼠“对雄性侵略者的攻击性行为大大减少,而且对性腺完好雄鼠尿液的偏好也很大程度地减弱了。
- Chen et al., Neuron -
究竟是哪个脑区接收了上游的嗅觉信号,然后投射到PMvᴰᴬᵀ⁺让其产生选择性反应呢?通过逆行示踪(retrograde tracing)的方法,研究者将目标最终锁定在v-BNST(腹侧终纹床核)脑区。v-BNST位于感知化学信号的鼻犁器的下游,如果在给“处男鼠“嗅各种尿液的同时记录投射到PMvᴰᴬᵀ⁺的v-BNST神经元的钙信号,他们发现,同PMvᴰᴬᵀ⁺一样,这一群神经元对性腺完好的雄鼠尿液也能产生选择性反应。如果抑制掉v-BNST神经元活性,PMvᴰᴬᵀ⁺对雄鼠尿液的选择性反应也同时消失了。
doi: 10.1016/j.neuron.2020.08.025
时间间隔学习少不了内嗅皮层
Heys et al., Cell Rep
@航迹云
类似于“心里默数10秒”的能力,依赖于我们对时间流逝的感知与判断。从神经科学的角度上来讲,时间的流逝可以粗略分为两大类:内隐时间(implicit time)和外显时间(explicit time)。这两者的本质区别在于,生物有意识地使用后者积极主动用来控制行为,而前者只是生物被动感知而得的。前人的实验经验告诉我们,大脑里可能有很多个“钟”在记录着时间流逝,这些“钟”可能同步工作,控制着一个统一的时间(single-clock hypothesis),也可能分别独立记录不同的时间(multiple-clocks hypothesis)。
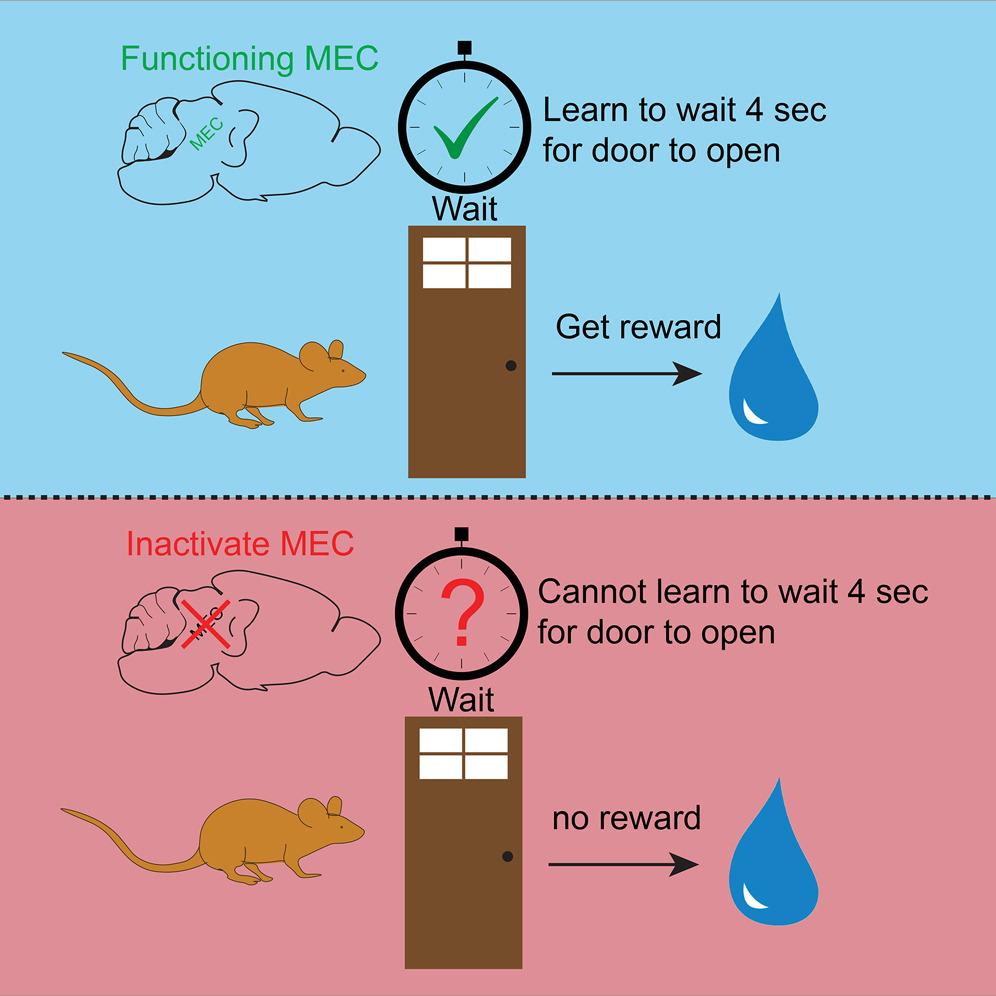
MEC(medial entorhinal cortex,中侧内嗅皮层)有编码内隐时间的功能,但它是否对外显时间及其相关的行为有影响呢?在这篇研究里,小鼠在虚拟现实环境下,被训练在一道门前静等4秒,4秒过后,通往奖励的道路才会打开,而没等够4秒就不能前进。训练后的实验里,这道门被隐藏起来了,但小鼠仍然需要等待相同的时长以继续前往奖励方向。这样“默数4秒才能前进”的任务,就得靠大脑对外显时间的编码了。利用光遗传学,在训练期间抑制MEC,能导致小鼠无法学习4秒门前静等的任务(门前等待时长显著小于对照组),然而在已经学会任务的小鼠里,抑制MEC并不会影响小鼠的等待时长。这说明,在学习过程中,MEC的活动是必不可少的;但是外显时间一旦内化,就不再需要MEC了。
然而需要注意的是,在一个静等间隔任务里,不仅仅只需要外显时间,还需要及时的动作抑制以及合时宜的动作激发。自己是否等待了足够的时间,也可以通过前进后的反馈来判断。这些因素也是学习该任务的关键,抑制MEC也不一定只是打乱了外显时间。
doi: 10.1016/j.celrep.2020.108163
系统与网络
该怎么记住你的朋友?
试试海马体CA2区的尖波涟漪
Oliva et al., Nature
@图图
当你的脑海中重复放映某个片段,久而久之,记忆就会被深深地固定在你大脑中。目前,我们只知道空间记忆(spatial memory)的巩固依赖于NREM睡眠(non-rapid-eye-movement sleep)时的海马体SWRs(sharp-wave ripples,尖波涟漪)。这种极高频的神经振荡可以重新激活相关的海马体位置细胞,就像给大脑的空间记忆按下了重播键。
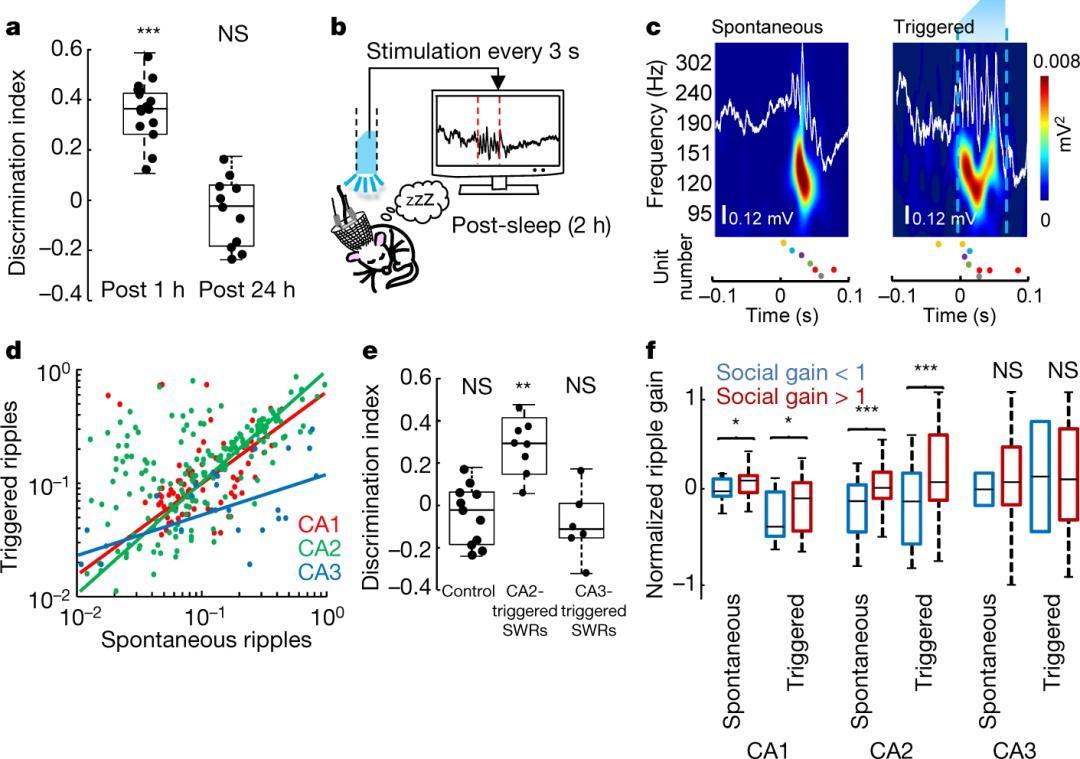
然而,海马体不仅仅编码空间记忆,也与很多其他类型的陈述性记忆有关,其中就包括社会记忆。所以,海马体的SWRs是否也可以加固这些非空间记忆呢?近日,来自哥伦比亚大学的研究者们发现,与社会记忆密不可分的海马体CA2区中,部分锥体细胞(pyramidal neurons)在小鼠对陌生同类的社会探索中激活,并且这些在探索中活跃的细胞群体也会在SWRs期间经历二次激活。研究者们利用闭环式光激活系统打乱CA2的SWRs,发现社会记忆的召回受到损伤;相反,如果在后睡眠期触发CA2的SWRs,则会促进社会记忆的巩固。
同时,他们注意到,海马体不同区域的SWRs功能并不相同,例如CA3的SWRs对空间记忆至关重要,但CA2的SWRs则更针对社会记忆。
因此,这篇研究揭示了SWRs介导的海马体细胞“重播”,可以将近期活动经历的时空及感知信息整合成更高级的记忆表征。如果你能想起昨天宴会上遇到的新朋友,很有可能是你的海马体CA2神经元在你睡着的时候悄悄“告诉”你的。
doi: 10.1038/s41586-020-2758-y
MoSeq:小鼠动作片的科学打开方式
Wiltschko et al., Nat. Neurosci
@Veronica
在一个漆黑的房间,一只小鼠孤零零地站在圆形平台上,不时旋转,奔跑,匍匐,起身,仿佛正陶醉在自己的独角戏里。此时此刻,它不知道头顶正有一台深度相机在捕捉着它的一举一动。它也不知道,在舞台隔壁的房间,有一群来自哈佛大学的“数据黑客”正在试图解码它动作的语言。
这群 “数据黑客”并没有企图破坏地球,他们其实正在验证一个大胆而绝妙的设想:正如人类的语言由不同的音节(syllables)组成,由特定的语法(grammar)串联,动物的行为是否也可以被解构成不同的音节和语法呢?比如起立,转身,飞奔等这些短暂的动作,就是行为学“音节”(behavioural ‘syllables’),动作之间过渡的方式,就是行为学“语法”(behavioural ‘grammar’)。如果掌握了这些音节和语法,我们是否就能理解动物行为的语言呢?
当然,这群来自哈佛医学院的研究者理解动物语言的目的,并不在于如何科学地饲养宠物。他们更关心如何更好地检测药物的有效性。在给将近700只小鼠们分别喂食了16种不同的精神药物后,研究者用深度相机,给每一只小鼠分别拍下20分钟的3D行为视频。通过机器学习,他们将这些行为视频的信息解码成了代表不同动作组分的“音节”,以及动作组分之间过渡规律的“语法”。最后,他们将这些信息投喂给线性分类器(linear classifier),以此来“逆向推测”不同的小鼠所服用的药物以及剂量。他们称这种方法为“动作测序”(Motion Sequencing,MoSeq),相比于用传统的2D信息(比如速度,位置等参数)线性分类,采用“音节、语法”的动作测序法能更准确地预测药物的种类和喂食的剂量。

- Wiltschko et al., Nat. Neurosci -
不仅如此,利用他们的算法,不论是不同大类的药物之间(比如兴奋剂,抗抑郁药,抗焦虑药),还是同一大类的药物之间(比如同属于神经安定剂的氟哌啶醇和利培酮),大多数情况下只需要大约5个行为“音节”就可以互相区分这些药物诱发的不同行为特征。也就是说,只需要少量的特征行为“音节”,算法就能描述出小鼠服用特定药物后产生的表型。比如,甲基安非他命5个特征的行为“音节”中主要包含了几种向前运动的姿势,其中有3个和莫达非尼的特征行为“音节”相同,而莫达非尼的另外2个行为“音节”则与探索性动作有关。
最后,为了证明MoSeq的实际应用价值,研究者通过同样的方法检测药物是否可以纠正自闭症小鼠模型(Cntnap2突变小鼠模型)的异常行为。他们发现,相比于野生型小鼠,自闭症小鼠模型有16个行为“音节”和和野生型小鼠显著不同。在临床上,利培酮常用于治疗自闭症患者过度活跃和攻击性行为,当给小鼠喂食利培酮后,这16种显著不同的行为“音节”中有7种被完全纠正了,7种被部分纠正了,另外2种则没有明显改变。但不容忽视的是,利培酮也造成了不少其他行为“音节”的变化,这说明利培酮在治疗自闭症小鼠的异常行为的同时也会引发副作用。和利培酮相似,另外两种新药(洛沙平、舒必利)也会不同程度地纠正自闭小鼠模型的异常行为,但同时也不可避免地带来了副作用。

-Wiltschko et al., Nat. Neurosci-
MoSeq如果能运用在药物研发上将会大有潜力,这些行为“音节”不仅可以检测已有药物的疗效,也可以作为考量新药效果和副作用的标准。开个脑洞,如果有一天MoSeq能学会解析人类行为的“音节”和“语法”,读懂人类的肢体语言是不是只需要电脑和相机就足够了?
doi: 10.1038/s41593-020-00706-3
编码目光的神经元
Pryluk et al., Nature
@狗尾巴花
目光(gaze)是灵长类动物社交的重要组成部分,我们通过目光来判断潜在的利害。其中,直接目光接触(direct gaze)常常具有攻击性,而回避目光(averted gaze)则是顺服的表现。此前的研究表明,直接目光接触能引起灵长类动物的焦虑情绪,并激发杏仁核(amygdala)活动。杏仁核活动异常与目光回避(gaze avoidance)有关,后者是许多神经发育障碍和社交障碍的典型症状。
目光不仅本身是一种效价信号(valence,指情感品质,涉及事件、对象或情况的内在吸引力或厌恶性),也可以用作预测潜在的奖赏与惩罚。因此,我们有理由推测,大脑对目光与效价的编码(coding)可能有相似的机制,而目光和结果预测(outcome expectation)可能也有共同的神经元编码;并且,在这三项认知功能中,杏仁核都应当扮演了重要角色。
为了验证这些猜测,研究人员采取了HIT(human intruder test,人类入侵者试验),对两只猴子被试进行了底外侧杏仁核(basolateral complex)及ACC(anterior cingulate cortex,前扣带皮层)单细胞记录,并观察分析了它们的眼动信号、面部表情和生理活动指标等一系列行为学表现。
在HIT中,猴子面对着液晶显示器,显示器中的百叶窗后“坐着”一个人类入侵者。每次百叶窗开启时,人类要么与猴子进行EC(eye contact,直接目光接触),要么NEC(no eye contact,移开目光)。而经典条件反射实验中有两种情况:欲望条件反射(appetitive conditioning,实验中为液体奖励)和厌恶条件反射(aversive conditioning,实验中为喷气)。HIT和经典条件反射实验以伪随机顺序出现。
眼动追踪结果表明,猴子在HIT中对人类的眼部区域的兴趣更浓厚。研究人员进一步量化了猴子的面部表情,发现它们在入侵者进行直接目光接触的时候会做出更多表情。这些结果与猴子的心率和心率变化(heart-rate variability)一起表明,在面对人类入侵者的直接目光接触时,猴子会出现应激、威胁和防御反应。
在各个经典条件反射实验中,猴子们迅速学会了区分和预测百叶窗开启后的结果。它们只会在喷气前后闭眼、在液体奖励出现前吸气;欲望和厌恶条件反射中的心率及心率变化模式,则分别与EC或NEC类似。这表明,猴子对两种经典条件反射实验中的结果(outcome,即US,实验中的“液体奖励”或“喷气”)和预测(expectation,即CS,实验中的“百叶窗开启”)有不同的反应。
那么,与之相对的杏仁核与ACC中的神经元活动又如何呢?
单细胞记录结果显示,经典条件反射实验中,杏仁核与ACC中的神经元都对欲望/厌恶条件反射中的US和CS作出反应,且能区分CS的效价,但杏仁核中的神经元更多地参与US的效价区分(图1c/d)。更多的杏仁核神经元会参与HIT,并对不同目光情况(EC和NEC)进行分辨(图1f)。在杏仁核与ACC中,鲜有同时响应目光和效价的神经元(图1g)。与此前的研究结果相符的是,相比响应效价的神经元,杏仁核中响应目光的神经元数量并不多。然而,单个神经元在群体层面的贡献并不一定需要显著响应;研究人员对神经元群体进行分析后发现,杏仁核与ACC能够在群体层面区分CS和US的效价,但只有杏仁核能够分辨目光的效价(图1h)。
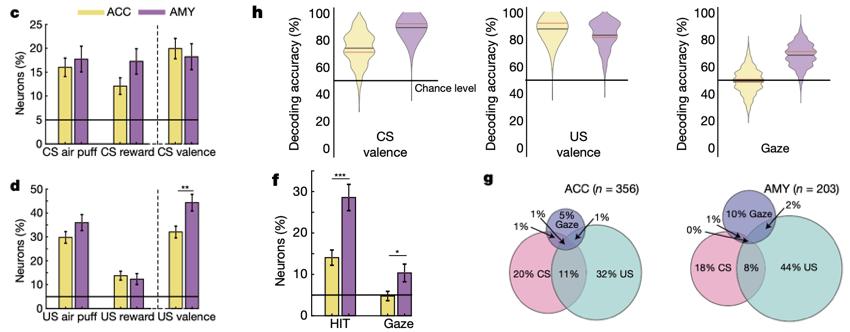
- Pryluk et al., Nature -
因此,这项研究发现,对效价的判断(奖赏和厌恶)和对目光的区分(直接目光接触和移开目光)共享一套神经回路;这说明,社会价值(social value)可能是从原始增强物(primary reinforcer,生物本能的一部分)的价值中进化而来,或者两者相互平行。另外,研究人员发现了两种根据目光解码价值的方式。目光和结果(US)之间的“总体活动”支持了传统的HIT结果:厌恶性结果与捕食者的凝视/同伴的威胁相似。
这项研究对灵长类杏仁核的社交互动(目光)、效价和结果预测编码方式提供了一些启示,并为我们理解社交焦虑提供了一个框架,更有可能帮助我们理解为什么焦虑症、抑郁症和社交受损常常一同发作。

细胞与网络
会痛的神经元能介导炎症
Michoud et al., Nat. Biotechnol
@图图
我们可以尝酸甜苦辣,听虫鸣鸟叫,感受人生百态,是因为我们周身上下都遍布着高度分化的感觉神经元(sensory neuron),这些神经元可以将我们接触到的任何刺激转换为信息传递给大脑。疼痛,作为一种不愉快的感觉,实际对人体有着警示作用,它的出现告诉我们可能存在的机能损伤。通常,有害刺激可激活伤害感受器(nociceptors)的感受神经元造成疼痛,同时也会增加毛细血管的通透性加大血流量从而产生神经炎症。然而引起疼痛的伤害感受器,是否能与免疫系统直接相互作用,还犹未可知。
近日,来自哈佛医学院、波士顿儿童医院和苏黎世联邦理工学院的科学家们,合作开发了一种可完全植入的充电式的无线光电神经激活技术,亚毫米级别的发光二极管被嵌入在坐骨神经中可以选择性地光控伤害感受器的神经调节。利用这项新技术,他们发现感觉神经元不仅可以引发疼痛,也可以直接与免疫系统沟通激发炎症。他们在自由活动的小鼠中精确地激活伤害感受神经元,小鼠不仅表现出疼痛的症状,证明这些神经元可以正常的将信息传递给脊髓,同时,研究者们注意到小鼠的后爪出现轻微地发红,进一步分析发现发红的皮肤处免疫细胞数量及细胞因子的分泌都显著增加。这个研究利用改进的光激活技术揭示了伤害感受神经元与免疫系统的紧密联系,为将来的炎症治疗提供了新的方向。
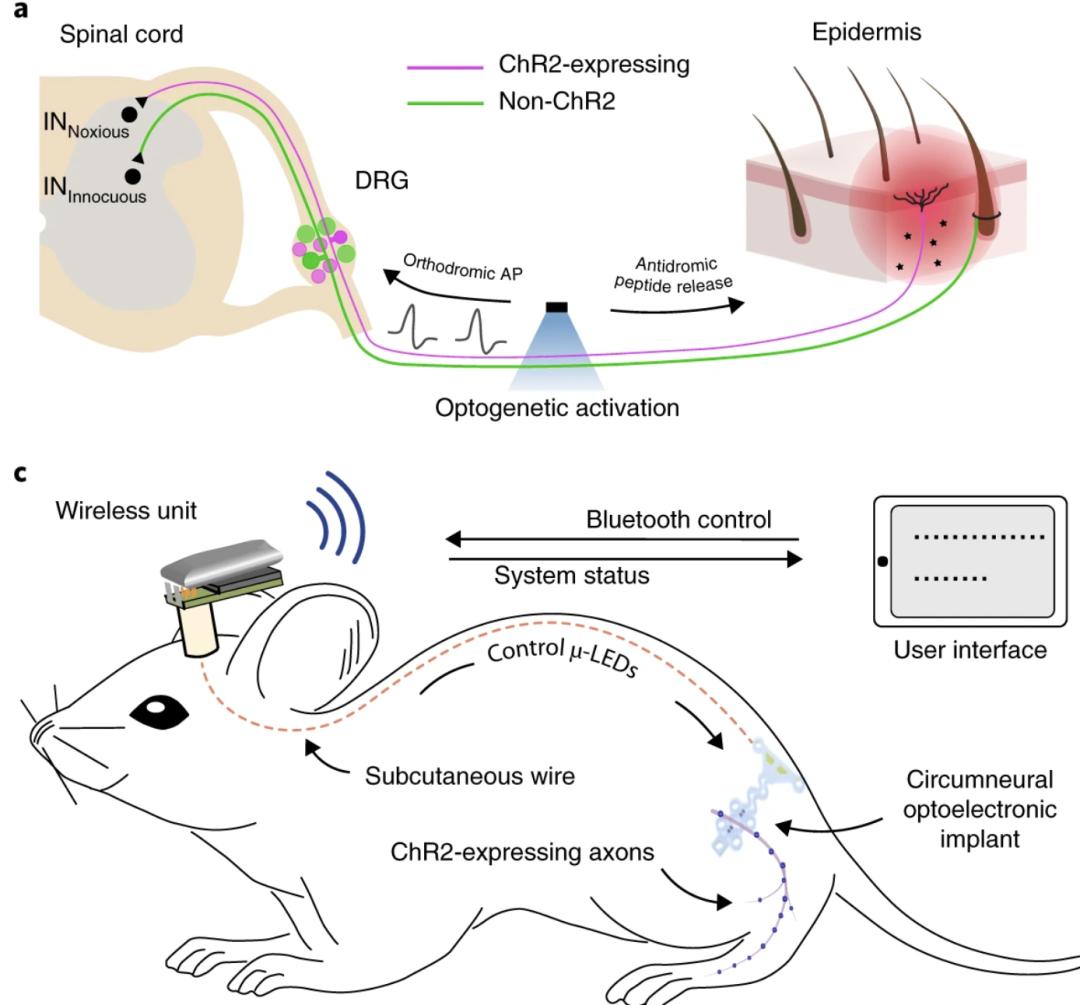
doi: 10.1038/s41587-020-0673-2
LTP后的突触间交流,
多亏胶质细胞趁早“收手”
Henneberger et al., Neuron
@阿莫东森
突触交流,很多时候靠的都是谷氨酸(glutamate)。这种兴奋性神经递质,在释放后,就会迅速被围在突触周围、高效的星形胶质细胞(astrocytes)吸收,分解,从而限制后突触神经元受到的兴奋性信号。然而,在LTP(long-term potentiation,长时程增强)中,突触之间的交流效率经受上调,这个上调的介导机制,或许也包括了星形胶质细胞的特定细胞过程。在本周的一篇论文中,作者团队描述了LTP能使星形胶质细胞撤回“触手”,从而使得谷氨酸的吸收、分解更加缓慢的过程。
首先,通过对星形胶质细胞进行双光子成像,作者团队发现,在海马体CA3-CA1突触中诱导LTP,能使星形胶质细胞的PAP(peri-synaptic processes,即上文提到的“触手”,包裹着突触,并吸收和分解释放出的谷氨酸)体积减少(图1)。
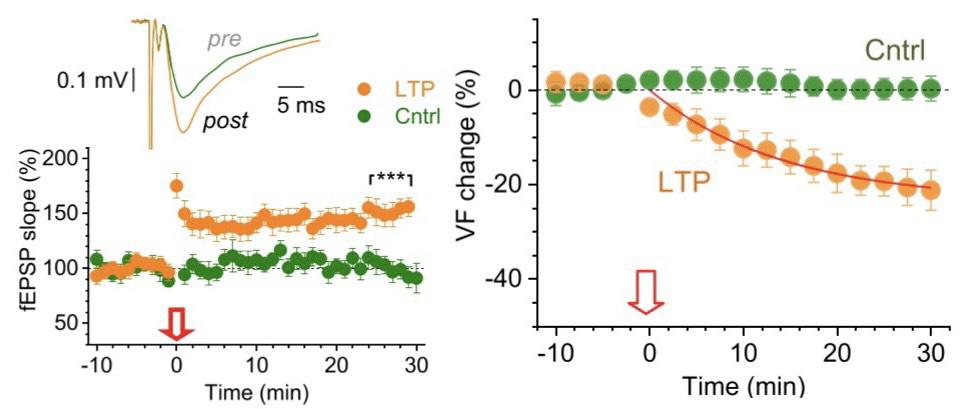
- Henneberger et al., Neuron -
确认PAP体积下降之后,研究人员用FRAP(fluorescence recovery after photobleaching,光漂白后的荧光恢复)进一步确认了PAP之间的扩散耦合度(diffusion coupling),并发现耦合度在LTP实验组下降了。团队猜测,这很可能是由于PAP在LTP诱导后被撤回所导致的。紧接着这个猜想,研究人员用双色STED(STimulated Emission Depletion,受激放射消去)显微法,终于确定在神经元经过LTP诱导的树突棘周围,PAP的体积比显著下调了,更多的PAP出现在远离树突棘的地方。
接下来,团队想要阐明LTP诱导导致的PAP撤回,究竟有什么样的分子机制。他们探究了可能影响PAP活动的各种机制,最后发现如果抑制NKCC1,一个钠、钾、氯离子共同运输蛋白(co-transporter),就能防止PAP的体积比下降。
抓住NKCC1这个线索,研究人员探究了NKCC1的一个下游细胞机制,即cofilin-1的磷酸化调控。Cofilin-1是一个根据pH调控肌动蛋白纤维多聚化(actin filament polymerisation),从而控制PAP变化的结构蛋白。他们发现,cofilin-1的磷酸化,能防止LTP诱导导致的PAP撤回。
有趣的是,通过进一步对谷氨酸进行成像,研究人员发现PAP撤回能导致谷氨酸扩散距离变远,因此能激活突触外的谷氨酸NMDA受体(extrasynaptic NMDARs),这可能在学习与记忆中有重要意义。另外,团队还将这个假说搬到了活体小鼠上,发现胡须刺激导致的LTP也能在活体小鼠脑中导致PAP体积比下调。
doi: 10.1016/j.neuron.2020.08.030
疾病与治疗
家族性精神疾病风险下,
大脑会有怎样的成长轨迹?
Sugranyes et al., J. Child Psychol. Psychiatry
@肖本
SzO(schizophrenia,精神分裂症)和BpO(bipolar disorder,双相情感障碍)都受遗传因素影响,都可能表现出精神病谱系(psychotic spectrum)上的症状,且均与儿童与青少年时期的大脑发育有密切联系。来自西班牙的研究团队对六至十七岁、具有FHR(Familial High Risk,高家族性风险)的青少年和对照组进行了为期四年以上的追踪调查,观察皮层厚度(cortical thickness)和皮层表面积(cortical surface area)等指标的发展轨迹,并用量表区分经历过精神病症状和没有经历过症状的人群。
观察实验伊始的数据,他们发现,表现出症状的FHR组,起初其皮层厚度并无区别,而表面积则比其他组小。进一步分组,则可以看出SzO组的表面积整体更小,与是否表现出症状无关,而BpO组则是只有症状者的表面积较小。研究者解读称,表面积方面的差别或许反映了SzO组的某种普遍特性,而对于BpO组则标志着具体症状方面的区别。
随着时间的变化,有症状的FHR组,其皮层将更快地变薄。令人惊讶的是,两个FHR组的表面积却均比对照组下降得慢。分组来看,无症状SzO组表面积的缩减要慢于有症状组,因此这或许反映了某种具有保护性的变化;有症状的BpO组,虽然表面积变化是最小的,但其皮层厚度的减少仍较多,因此并没有改变该组成员前额叶灰质体积缩水的局面。
总之,该研究在影像学层面考察了家庭风险对精神疾病的影响,指出了使用多个形态指标(morphometric measures)刻画大脑发展轨迹的重要性,也为日后更细致地分析家庭风险、保护高危人群的研究或措施打下了基础。
doi: 10.1111/jcpp.13321
不同压力下的小鼠,各有各的不幸
Du Preez et al., Transl. Psychiatry
@肖本
无论是反复的腹腔注射(intraperitoneal injection)还是社交孤立(social isolation),都会给小鼠带来压力,造成生理上的变化,以至于引发焦虑样或抑郁样的行为(anxiety- and depressive-like behaviours)。但是,这两种物理性和社会性的压力所带来的不良影响有什么具体区别呢?近日,来自伦敦国王学院的研究团队系统性地研究了这一问题。他们所对比的四组小鼠分别是对照组、连续六周经历每日腹腔注射的物理压力组(physical stress)、连续六周独处的心理压力组(psychological stress)和两种压力皆有的复合压力组(combined stress),每个组别的行为变化、压力下的激素变化、免疫因子指标乃至神经元和胶质细胞的不同均得到了记录。
结合他们所收集的多种数据,作者认为,物理压力组的注射导致了HPA(hypothalamus-pituitary-adrenal axis,下丘脑-垂体-肾上腺轴)的过度激活(hyperactivity)。同时,物理压力组中,小鼠大脑内小胶质细胞(microglia)的激活程度更高,而小胶质细胞可导致新生神经元凋亡,这或许可以解释行为层面上小鼠表现出来的焦虑样行为。与之相对的是,心理压力组中小鼠的HPA有所减退(hypoactive),小胶质细胞凋亡更频繁。种种生理变化的结果可能是突触修剪(synaptic pruning)的减少,由此而产生抑郁样的行为。
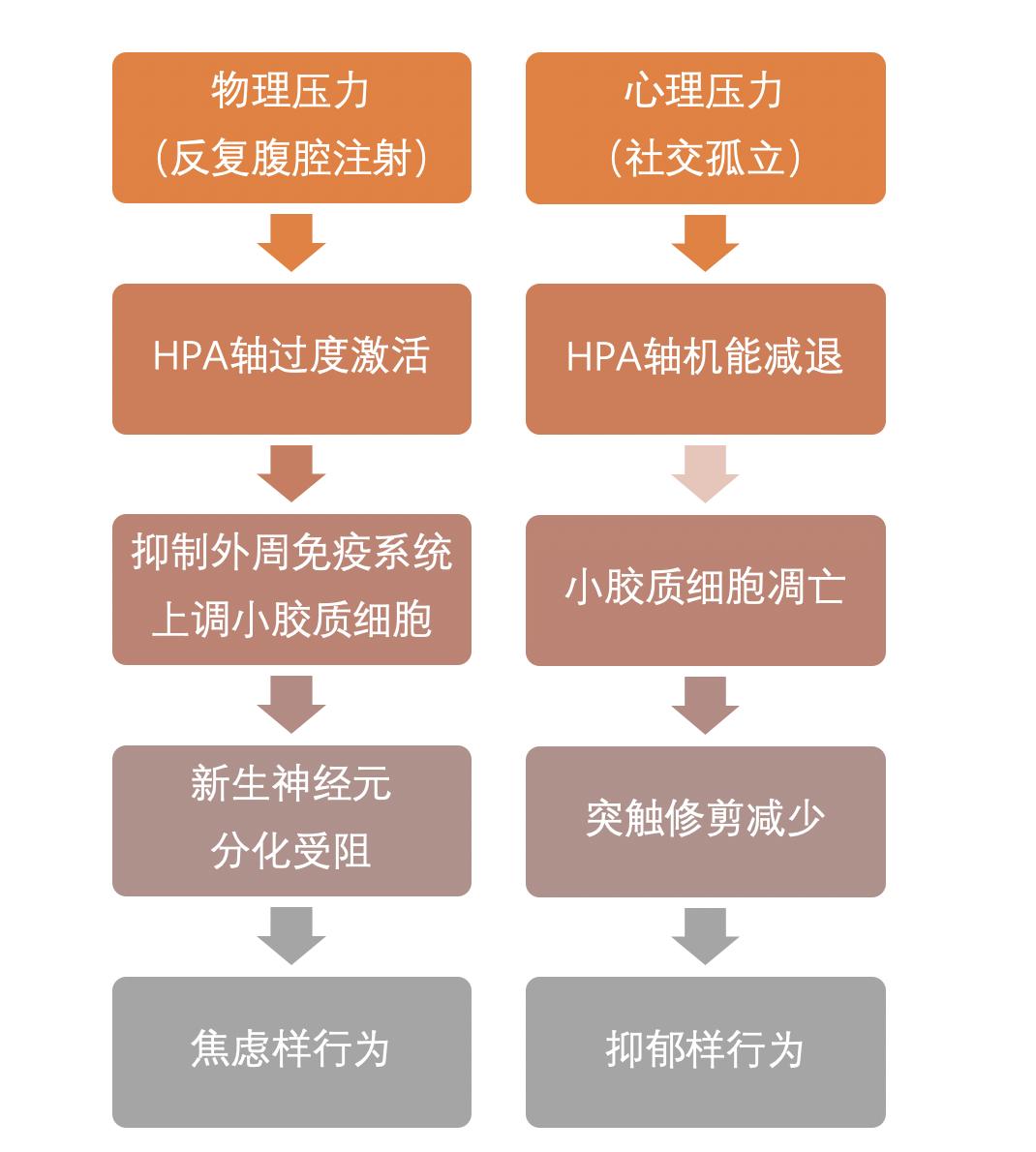
非常有趣的是,在复合压力组中的小鼠虽然“风雨交加”,其所表现出来的生理与行为变化却并非前两组的简单叠加。研究人员并没有观察到HPA轴或神经免疫方面的变化,而不同主要集中在血清中各个免疫因子的水平和海马体细胞分化的减少上,且小鼠亦只表现出焦虑样的行为。研究人员表示,心理压力所产生的的效应可能在一定程度上被物理压力覆盖掉了,因为后者与痛觉系统(nociception)有着更紧密的联系。
最后,值得一提的是,三组小鼠中的神经元和胶质细胞方面的变化全部集中在海马体的齿状回(dentate gyrus)处,而没有在前额叶的样本中观察到。
doi: 10.1038/s41398-020-01000-3
星形胶质细胞,阻碍恐惧记忆形成,不怕!
Li et al., Neuroscience
@小田
在背书的时候, 有多少同学幻想自己可以拥有过目不忘记住一切的能力呢?但是,不是所有记忆都是我们需要的,或者我们有时候大脑会忘记一些恐惧记忆,来自我保护。反复回忆创伤性事件(traumatic event)可能是有害的。大约三分之一经历过严重创伤的人会发展成创伤后应激障碍(post-traumatic stress disorder,PTSD),以闪回(flashbacks)和噩梦的形式重新经历创伤事件,其他人则会出现恐慌症(panic disorder)、恐惧症(phobias)或抑郁症(depression)。
那有什么办法阻止回忆创伤性事件对人们的二次伤害呢?目前的治疗方法包括让患者重新面对创伤性事件。有控制的再暴露可以帮助个体学习新的应对策略。但是,现有方法并不能抹去最初的恐惧记忆。
那么如果可以利用新记忆不稳定的特性呢?通过阻止新恐惧记忆的巩固从而避免产生长期记忆痕迹的形成。段树民教授团队的研究人员李玉兰等人用通过光遗传学(optogenetics)在体内特异性激活(specific activation)大鼠脑内星形胶质细胞(Astrocyte)的方式,阻止大鼠大脑的记忆巩固(memory consolidation),防止动物形成对压力事件的持久记忆(脚部电击)。在这项研究中,大鼠在特定房间内习得将足部电击与声调联。之后,大鼠每当进入房间时就开始呆滞,这是一种恐惧的迹象。即使没有声音刺激,这种情况也会发生。
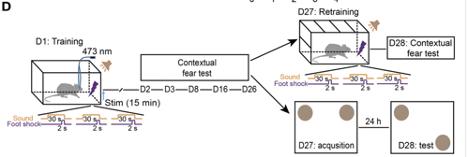
通过光遗传学方法激活GFAP-ChR2-EYFP大鼠脑内的星形胶质细胞,增加了细胞外ATP和腺苷(adenosine)的浓度,从而在学习事件短期时间窗内破坏记忆固化,减少情景恐惧记忆(contextual fear memory)。此外,颅内(intracerebral)或腹腔(intraperitoneal)注射A1R拮抗剂(agonist)可以直接激活这些腺苷A1受体(A1Rs),与激活星形胶质细胞相同。
这种类型的药物有一天可能会帮助那些患有与恐惧相关的疾病,如创伤后应激障碍和恐惧症的患者。
doi: 10.7554/eLife.57155
空气污染如何影响孤独症?
Frye et al., Mol. Psychiatry
@狗尾巴花
孤独症是一种病因复杂的神经发育障碍,目前学界认为它是一系列基因和环境因素共同作用的结果。空气质量是环境因素的重要组成部分,细颗粒物(PM2.5)浓度则更是人们熟知的空气质量量化标准。此前的研究表明,包括PM2.5暴露(exposure)在内的空气污染与孤独症风险的增加有关。然而,我们对“PM2.5如何影响孤独症”依然知之甚少。
考虑到环境因素暴露与疾病发病之间通常相隔时间较长,我们需要找到一种能够长期存在的影响——研究人员认为,线粒体是一种能够被环境因素(PM2.5)影响的细胞器,而其功能紊乱则与孤独症有关。因此,研究人员作出假设,空气污染可以通过影响线粒体而影响孤独症。为此,他们收集了全美国范围内102名儿童的血液样本(96名孤独症患者,3名孤独症患者的正常兄弟姐妹,3名正常发育的儿童),并通过一系列量表测量了他们的行为(Aberrant行为检测表和社会响应量表,Aberrant Behavior Checklist and Social Responsiveness Scale)和神经发育状况(Vineland适应性行为量表,Vineland Adaptive Behavior Scale)。被试的父母则提供了其出生时家庭住宅的邮编,以供研究人员在官方系统内搜索母亲在孕中期和孕晚期的PM2.5暴露情况,计算PM2.5暴露的平均值和最大值。
研究结果表明,在没有神经发育退行(neurodevelopmental regression)历史的孤独症患者中,产前暴露于高PM2.5平均值/最高值与低线粒体呼吸作用相关;有神经发育退行的孩子则相反,产前高PM2.5暴露与高线粒体呼吸作用相关。确立了PM2.5对线粒体的影响后,研究人员进一步进行了中介作用(mediation)分析和结构方程建模(Structural equation modeling),以研究PM2.5、线粒体活动和孤独症之间的关系。最终,研究人员发现了三者之间的一系列直接或间接关联,且主要根据孤独症患儿是否有神经发展退行历史建立了两个模型(下图左为有退行历史,右为没有)。
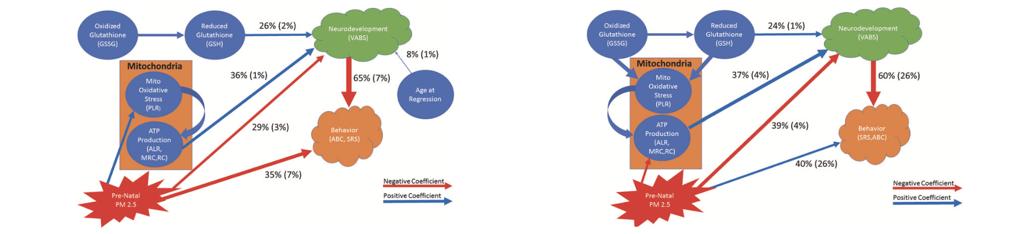
研究人员认为,这项研究揭示了空气污染通过对线粒体造成长期影响,进而导致疾病的发生/增加日后患病风险。他们提出,未来对孤独症的研究需要考虑将环境因素纳入风险评估,且对线粒体的保护/干预有可能能够帮助预防/治疗孤独症。
前景很光明,现实却未必。这项研究有几个比较大的局限,在使用其结果时需要格外注意。首先,作为一个“全美国范围”的实验,102个样本确实比较小,对照组也几乎形同虚设;这直接导致了作者指出的问题:实验结果的效果量都比较小,其可靠性还有待更多的后续实验来验证。其次,实验的设计不够严谨。尽管研究者们开创性地将线粒体活动纳入了模型,数据的收集还有一定的局限。比如,母亲孕中后期暴露的空气污染是根据孩子出生时的家庭住址和相关官方PM2.5数据进行的估测,忽略了母亲怀孕期间的经历(如是否有常住其他地区)和作息(如是否经常出门、有没有可能大量接触除PM2.5外的空气污染物)。此外,线粒体活动是根据孩子长大后的样本得出的,由于时间间隔较长且缺乏有效的对照组,这些不同在多大程度上受母亲孕期经历的空气污染的影响似乎有待商榷。更重要的是,即便研究者们使用了“有影响(have an effect on)”的表述,在最后的结论(Conclusion)中他们仍然谨慎地使用了“有关(associated with)”;他们对空气污染、线粒体活动和孤独症行为之间的关系本质的定义并不明确,即没有明确究竟有没有因果关系。本实验采取的方法是收集数据然后建模寻找关系,而非真正进行对比实验,若说如此便得出因果关系,似乎还缺少一点说服力。诚如作者所言,本研究为后续的孤独症研究提供了一个新思路(空气污染影响线粒体活动),却也忽视了许多其他可能的致病因素和机制,要走的路无疑还很长。
doi: 10.1038/s41380-020-00885-2
其余要闻
新冠病毒 | 本周研究日记
@阿莫东森
1
9月21日周一
普林斯顿大学研究预测疫情五年后,
全球医疗状况
普林斯顿大学研究团队在Science发文,利用流行病学模型预测了新冠疫情未来五年的走向、疫苗接种,和其他药物介入的结果。研究指出,虽然我们仍需非常多的额外数据,但现有数据表明,未来疫情大流行的可能性仍然存在。
— Saad-Roy et al., Science, doi: 10.1126/science.abd7343
新冠病毒封闭结构有游离脂肪酸结合口袋,
或提供新的药物靶点
布里斯托大学在Science发表报告,利用冷冻电镜(Cryo-EM)表明在新冠病毒刺蛋白(spike protein)的封闭结构(locked structure)中,存在游离态脂肪酸的结合口袋(free fatty acid binding pocket)。这些结合口袋能与亚油酸(linoleic acid,机体不可或缺的一种脂肪酸)紧密结合,并在此前造成大流行的非典病毒和中东呼吸综合症冠状病毒中都存在。亚油酸与新冠病毒的结合口袋结合后,可稳定刺蛋白的封闭结构,下调刺蛋白与人类细胞表面ACE2受体的交互程度,从而下调细胞感染率。在培养的人类细胞中添加亚油酸与瑞德西韦(remdesivir),可显著降低新冠病毒的感染率和复制率。这或许能提供一个新颖的药物靶点。
—Toelzer et al., Science, doi: 10.1126/science.abd3255
2
9月22日周二
非裔和西班牙裔美国人感染新冠可能性更高
PLOS Medicine的一篇来自美国退伍军人事务部(Department of Veterans Affairs)的流行病学研究表示,即使考虑地理位置、人文环境、健康状况等情况,非裔与西班牙裔美国人检测出新冠阳性的可能性,仍然是白人的两倍。文章没有进一步推测这个差异的成因。
— Rentsch et al., PLoS Med., doi: 10.1371/journal.pmed.1003379
天气如何影响新冠传播,这对我们又意味着
什么?
两名塞普洛斯尼科西亚大学(University of Nicosia)的研究员在Physics of Fluids上发表论文,模拟了不同天气对新冠病毒传播的影响。他们发现,高温和低相对湿度,能导致含病毒的唾沫颗粒更容易蒸发,从而显著降低病毒的存活率和传播率。而风速则是所有变量里最重要的之一,高风速能明显增强病毒的传播率。
— Dbouk & Drikakis, Phys. Fluids, doi: 10.1063/5.0024272
新冠病毒与神经系统病变
新冠病毒或能加剧,甚至引起帕金森病。新的综述文章表示,对新冠肺炎患者的神经系统检测刻不容缓。
— Beauchamp et al., J. Parkinsons Dis., doi: 10.3233/JPD-202211
3
9月23日周三
Science文章确认新冠病毒能损伤心脏
“新冠病毒能损害心脏。”斯克里普斯研究中心(Scripps Research)总部的Eric Topol今日在Science上发表Perspectives,表示根据如今证据,已能确认新冠病毒能感染心脏细胞,引起心肌炎、心脏细胞凋亡、心率异常等症状。对一些感染新冠病毒的患者来说,心脏症状甚至是唯一的显性症状。与之相比,此前造成大流行的的冠状病毒(例如非典病毒和中东呼吸综合症冠状病毒)都只有少数此类报告。Topol称现有证据表明,这种无差别入侵是由于新冠病毒上的Furin蛋白酶切点跟其他冠状病毒上的结构不同。
— Topol, Science, doi:10.1126/science.abe2813
新冠肺炎的小鼠模型再进一步
8月底,北卡罗来纳大学教堂山分校的Ralph Baric实验室在Nature上发表了第一个能感染小鼠,帮助模拟人类新冠肺炎的改造新冠病毒——SARS-CoV-2 MA,利用小鼠的mACE2受体进入细胞。今日,Baric等人又在Cell上发文,称造出了改进版的SARS-CoV-2 MA10,能在实验室最常用的小鼠基因型(C57BL/6J)中引起致命性的重症新冠肺炎。在小鼠内模拟人类新冠肺炎,可以说在这半个月内正式起步了。
— Leist et al., Cell, doi: 10.1016/j.cell.2020.09.050
聚合酶链式反应检测新冠病毒新进展
直接在热失活(heat-inactivated)或溶解(lysed)的检测样本上,进行逆转录聚合酶链式反应(Reverse Transcription Polymerase Chain Reaction,RT-PCR,先利用逆转录酶,将一段待测的RNA序列转为cDNA,再利用常规PCR技术复制这段cDNA),可以大量节省聚合酶链式反应检测新冠病毒RNA的时间和精力。
— Smyrlaki et al., Nat. Commun., doi: 10.1038/s41467-020-18611-5
两篇Nature综述,详述动物模型和疫苗进展
一篇来自哈佛医学院团队的Nature综述,讲述了新冠肺炎的各种动物模型。
— Muñoz-Fontela et al., Nature, doi: 10.1038/s41586-020-2787-6
一篇纽约西奈山伊坎医学院Florian Krammer主笔的Nature综述,详述了对新冠病毒的疫苗发展,并指出,有效且能广泛使用的疫苗将在近几个月(而非几年)内出现。
— Krammer, Nature, doi: 10.1038/s41586-020-2798-3
4
9月24日周四
两种抗体高效抵抗新冠病毒
华盛顿大学和瑞士Vir生物科技的Veesler和Fink实验室发现了两种有效针对新冠病毒的超高效抗体:S2E12和S2M11。这两种抗体可以抢在新冠病毒前,与ACE2受体结合,还能够封闭病毒的刺蛋白。
— Tortorici et al., Science, doi: 10.1126/science.abe3354
巴西城市或已获得“群体免疫”
今日,圣保罗大学(University of São Paulo)的Sabino团队在medRxiv上发文表示,巴西马瑙斯(Manaus)市的COVID-19新增病例数在近期出现的下降,有可能是由于本市66%的居民在八月底已被感染,并发展出了抗体。论文作者表示,这或许已经达到了“群体免疫”的标准。这项研究尚未经过同行评审。
— Buss et al., medRxiv, doi: 10.1101/2020.09.16.20194787
5
9月25日周五
Science论文说明重症患者体内存在高水平的
抗1型干扰素抗体,严重损害机体抗病毒系统
今日Science的两篇论文,详述了1型干扰素(interferon,IFN)与重度新冠肺炎(令人困惑)的相关性;1型干扰素在病毒入侵机体后快速局部上调,让被感染的细胞启动抗病毒机制,可看作细胞的“病毒预警信号”。
第一篇论文来自洛克菲勒大学(The Rockefeller University)和巴黎大学的Bastard与Casanova实验室,分析了987名重症新冠患者的血液样本;结果显示,至少有十分之一的重症患者体内出现了对1型干扰素的抗体,能使这个“预警信号”失效;在健康人群中,这个比例仅为0.33%;在663名轻症和无症状人群中,无人携带这种抗体。有趣的是,94%的抗1型干扰素抗体携带者都是男性。研究人员设想,或许携带两条X染色体,可以抑制这种抗体的生成。随后他们发现,一名重症女性患者体内的一条X染色体被抑制了,她体内与男性一样存在这种抗体。
— Bastard et al., Science, doi: 10.1126/science.abd4585
第二篇论文同样来自上述实验室。通过对659名重症患者和534名轻症或无症状人群的样本进行DNA测序分析,他们发现3.5%的重症患者携带抑制1型干扰素合成的罕见突变;这些患者的确拥有更低水平的1型干扰素。与上一篇论文一并,Bastard与Casanova实验室的结果表明,1型干扰素是一种非常重要的抗新冠病毒免疫分子;并且,我们需要重新考虑使用“康复者血浆疗法”,因为其中可能携带抗1型干扰素的抗体,或使接受治疗者的病情加重。
— Zhang et al., Science, doi: 10.1126/science.abd4570
美国民众对新冠研究的看法
一篇Science Advances论文调查了疫情期间,6000名美国民众对新冠病毒研究的看法。
— Kreps & Kriner, Sci. Adv., doi: 10.1126/sciadv.abd4563
编者:阿莫東森、小田、航迹云、Veronica、图图、狗尾巴花、肖本
排版:兵书、小葵花
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




