- +1
【学术前沿】苏士成团队揭示线粒体环状RNA调控肝脏免疫代谢性炎症新机制丨CellPress对话接学家
以下文章来源于CellPress细胞科学 ,作者Cell Press

CellPress细胞科学
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。

关注我们,获取更多相关资讯
免疫代谢性疾病包括非酒精性脂肪性肝炎(NASH)、糖尿病和肥胖等。非酒精性脂肪肝(NAFLD)影响世界约1/4的成年人,NASH是其中一种较重的亚型,部分病人会进展至肝硬化和肝癌,又与其他代谢紊乱如胰岛素抵抗和高脂血症密切相关。近日,中山大学苏士成/高志良/许小丁团队揭示了线粒体环状RNA调控肝脏免疫代谢性炎症新机制,研究成果于2020年9月14日发表在Cell Press(细胞出版社)旗下期刊Cell《细胞》上,题为“Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output”。

▲长按识别二维码阅读论文
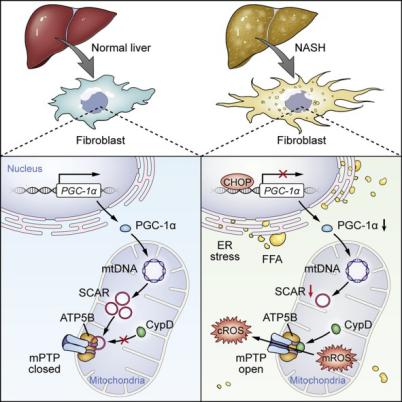
团队发现了线粒体定位的环状RNA在代谢性炎症中发挥重要功能。NASH患者的成纤维细胞中线粒体定位的环状RNA显著下调,针对其中的一个环状RNA(SCAR)开展深入研究发现,脂肪酸导致的内质网应激诱导CHOP表达上调,CHOP抑制PGC1α,而后者调控SCAR表达,因此脂质导致SCAR减少。SCAR在线粒体内通过结合mPTP的亚基ATP5B而阻止其开放,抑制线粒体ROS和成纤维细胞活化。SCAR介导的线粒体调控通路对于理解NASH发病过程中肝脏的纤维化的发生机制有重要意义。另外,研究团队率先构建靶向线粒体环状RNA的纳米递送系统,实现在体内外干预线粒体环状RNA,为靶向线粒体信号治疗代谢性免疫疾病提供新思路。
随着生活方式的改变,NAFLD已经取代病毒性肝炎成为当前主要的慢性肝病。单纯的NAFLD是可逆的,但NASH已有肝纤维化导致的永久性肝脏病变。如何减缓和逆转肝脏纤维化是NAFLD/NASH研究的重点和难点。本研究通过构建靶向线粒体RNA的纳米递送系统,揭示了线粒体定位circRNA功能,阐明高脂压力导致的内质网-细胞核-线粒体跨细胞器信号轴失衡导致免疫代谢性疾病进展的新机制。
参考资料:苏士成团队揭示线粒体环状RNA调控肝脏免疫代谢性炎症新机制(http://www.syshospital.com/Item/469063.aspx)
作者专访
Cell Press特别邀请苏士成研究员/副主任医师进行了专访,
请他为大家进一步详细解读。
CellPress:
由于全球性的高热量饮食、久坐的生活方式,免疫代谢疾病成为公共卫生挑战。您和您的研究团队将目光标准了非酒精性脂肪性肝炎(NASH),可以介绍一下此项研究的背景和初衷吗?
苏士成研究员/副主任医师:
我是一名乳腺外科医生,目前也在中山医学院免疫教研室负责免疫和临床的融合式教学工作。在临床实践中,我连续遇到几位20多岁的年轻乳腺癌患者同时患上非酒精性脂肪肝。这临床现象引起我注意。经过查阅文献,我惊讶的发现:在女性中乳腺癌是与非酒精性脂肪肝关系最密切的肝外恶性肿瘤(Kim et al. J Hepatology,2017)。
免疫代谢疾病是由于营养过剩导致的免疫应答紊乱,进而导致的一系列炎症疾病。非酒精性脂肪肝影响世界约1/4的成年人,而在我国发病率在不断升高,发病年龄日趋年轻化。非酒精性脂肪性肝炎(NASH)是非酒精性脂肪肝中一种较重的亚型,是典型的免疫代谢疾病,部分病人会进展至肝硬化和肝癌,又与其他代谢紊乱如胰岛素抵抗和高脂血症密切相关。
我所在的中山大学孙逸仙纪念医院乳腺肿瘤中心学术带头人是宋尔卫院士。宋院士在国际上率先提出增设与肿瘤相关的内分泌、心血管、康复、生殖和精神心理等支持专科,围绕乳腺癌患者尤其是年轻患者提供全方位、全周期、一站式的整合。在宋院士领导的大方向下,我从日常临床发现的问题出发,结合我免疫学研究背景,和中山大学附属第三医院肝病专家高志良教授以及我院纳米材料专家许小丁教授合作,开展了这个关于NASH发病机制的研究。
CellPress:
环状RNA(circRNA)与传统的线性RNA不同,呈封闭环状结构,不受RNA外切酶影响,表达更稳定,不易降解,是RNA领域最新的研究热点。您认为对线粒体内环状RNA进行研究最大的意义是什么?线粒体在纤维化和炎症反应中都发挥关键作用,但线粒体信号是如何调节其功能仍然不清楚。您和您和研究团队研究了线粒体内环状RNA在代谢性炎症中的作用,可以简单介绍一下主要发现吗?
苏士成研究员/副主任医师:
circRNA绝大多数是由真核细胞的核基因组转录的前体mRNA的外显子经剪切和头尾连接而形成,其定位有显著的组织、细胞甚至亚细胞特异性。
线粒体是个非常特殊的细胞器。目前有观点认为线粒体来源于14亿年前原核细胞吞噬的细菌,因此线粒体有独立的环状基因组。之前有报道来源于线粒体定位细胞浆circRNA有重要生物学功能。但由于线粒体双层膜的存在,之前缺乏线粒体RNA的高效递送系统,这使得线粒体定位的非编码RNA功能在很大程度上尚不清楚。因此,本研究的最大意义在于为线粒体定位的RNA研究提供新思路。
线粒体是代谢的枢纽,在纤维化和炎症反应中都发挥重要作用,我们是从circRNA芯片分析入手,发现NASH患者的成纤维细胞中下调的circRNA有近40%是线粒体基因组转录的circRNA,而线粒体基因组来源的circRNA在整个基因组中所占比例不到0.1%,这一发现提示肝成纤维细胞中线粒体来源的circRNA与NASH的发生发展相关。我们通过构建靶向线粒体RNA的纳米递送系统对线粒体circRNA进行干预,发现线粒体的circRNA SCAR可以显著抑制活性氧ROS的生成和释放、成纤维细胞的激活、和炎症因子的产生等代谢炎症表型,上游研究中发现脂肪酸导致的内质网应激通过上调CHOP来抑制PGC1a,进而调控circRNA SCAR表达。这一系列的实验验证阐明了高脂压力导致的内质网-细胞核-线粒体跨细胞器信号轴失衡导致免疫代谢性疾病进展的新机制。
CellPress:
此项研究工作将如何改变临床实践?
苏士成研究员/副主任医师:
我们的发现对阐明高脂负荷如何通过线粒体信号诱发免疫疾病有一定意义。同时,我们率先构建了靶向线粒体circRNA的纳米颗粒递送系统,实现在体内、体外干预线粒体定位circRNA。利用这个系统,在高脂饮食动物模型中发现SCAR可以减轻高脂负荷导致的代谢炎症表型、肝纤维化表型和胰岛素抵抗。这提示线粒体来源的非编码RNA可以作为疾病,特别是免疫代谢疾病的生物学标记。同时显示靶向线粒体circRNA纳米载体的治疗潜能。
CellPress:
基于此项研究的发现,后续研究还有哪些工作要进行?您的团队下一步的研究方向如何?
苏士成研究员/副主任医师:
在分子机制方面,我们鉴定到高拷贝数的circRNA SCAR形成的稳定茎环结构可以稳定结合ATP5B,这提示高表达的和具有特定结构的环形RNA可能更倾向于具有生物学功能,我们下一步会开发更多相关的研究手段,在分子机制和病理关联等方面解析更多环形RNA的生物学功能。在临床方面,我们发现的这个circRNA介导的线粒体调控通路对NASH进程的贡献,在肝实质细胞和其他免疫细胞等的作用是值得下一步深入研究。另外,我们建立的具有特点的靶向线粒体circRNA的纳米颗粒递送技术实现了体内外线粒体circRNA的干预,其作为靶向线粒体信号治疗代谢性免疫疾病的治疗手段有待下一步更深入的探讨。
论文通讯作者简介

苏士成
研究员/副主任医师
任中山大学孙逸仙纪念医院乳腺癌研究中心主任、乳腺肿瘤中心副主任、中山医学院免疫教研室副主任。兼任中国抗癌协会青年理事会常务理事、中国抗癌协会肿瘤免疫代谢学组副组长、中国抗癌协会肿瘤转移专业委员会委员、欧洲免疫治疗协会会员。主要研究兴趣是炎症微环境和肿瘤免疫以及免疫相关疾病关系。近5年以通讯作者在Cell (2篇),Nature,Nature Immunology, Nature Cell Biology, Nature Communications (2篇),Clinical Cancer Research, Cancer Research等期刊发表论文。主持国家重点研发青年专项、国家自然重点、优秀青年等项目。获得“求是杰出青年奖”、科技部首届生物技术创新大会“优秀青年科学家”等奖项。改良保乳保腋窝的乳腺癌精准手术,被授予共青团中央 “全国青年岗位能手”、“广州市实力中青年医生”、“羊城青年好医生”等称号。推动外科学和免疫学的融合式教学改革,获得教育部“长江青年学者(普外科)”、“霍英东教育基金会高等院校青年教师奖”、指导学生获得“第五届全国大学生基础医学设计大赛一等奖”(唯一指导老师)。

高志良
教授
任二级教授、中山大学肝病医院副院长、中山三院感染科主任、教研室主任、中山大学名医。兼任中华预防医学会感染病防控分会主任委员、中国医师协会感染科医师分会副会长、中华医学会感染病学分会肝衰竭与人工肝学组副组长、广东省预防医学会副会长、国家精品课程及国家双语示范课程负责人。《中国病毒病杂志》副主编、人民卫生出版社统编教材《Infectious Diseases》第1版主编、人民卫生出版社本科统编教材《传染病学》第八版副主编。享受国务院“政府特殊津贴”、广东省干部保健专家。获得“科学中国人(2017)年度人物”、“国之名医·卓越建树”荣誉称号。承担国家“十三五”科技重大专项,“973”等课题十余项。发表论文近300余篇,代表作在《Hepatology》、《J Hepatology》和《JCI》等发表。获得包括广东省科学技术奖一等奖等五项。

许小丁
研究员
研究员、博士生导师,科研科副科长。入选广东省 “杰出青年医学人才”、中山大学百人计划“中青年杰出人才”,担任广东省抗癌协会肿瘤转移专业委员会委员、广东省抗癌协会遗传性肿瘤专业委员会委员。Advanced Materials, Advanced Functional Materials, ACS Nano , Nano Letters, Angewandte Chemie International Edition , Small, Biomaterials , PNAS 等国际SCI期刊发表论文80余篇(其中第一作者/通讯作者论文40篇),他引3000余次,H因子35,4篇研究论文入选ESI高被引论文。授权/受理权利5项(中国专利1项,美国专利2项,国际专利2项)。研究成果被Nature Middle East, PNAS Feature News, Nanowerk, Cell Therapy News, Prostate Cell New, Pharmacy Choice以及Gene Therapy Net等专题报道。现担任ACS Nano, Biomaterials, Chemical Communications, Polymer Chemistry, Journal of Materials Chemistry B, ACS Applied Materials & Interfaces, ACS Biomaterials Science & Engineering, International Journal of Nanomedicine, Soft Matter, Colloids and Surfaces B: Biointerfaces,等国际著名SCI期刊审稿人。
相关论文信息
研究成果发表于Cell Press期刊Cell上,
点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Outpu
▌论文网址:
https://www.cell.com/cell/fulltext/S0092-8674(20)31000-X
▌DOI:
https://doi.org/10.1016/j.cell.2020.08.009
▲长按识别二维码阅读论文
来源:CellPress细胞科学

1980-2020
原标题:《【学术前沿】苏士成团队揭示线粒体环状RNA调控肝脏免疫代谢性炎症新机制丨CellPress对话接学家》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




