- 40
- +1
《自然》:新冠病毒进入细胞的操作太溜了
原创 奇点糕 奇点网 收录于话题#新冠病毒研究进展73个

来自弗朗西斯·克里克研究所的科学家,借助于冷冻电镜技术,记录下了新冠病毒S蛋白与其受体ACE2结合的10个重要瞬间。
基于此,他们发现,新冠病毒S蛋白的受体结合域(RBD)一旦与ACE2结合,就会让S蛋白三聚体变得更不稳定,并逐步张开一个直径为50Å(1Å=0.1nm),深为60Å的“血盆大口”,以暴露出隐藏在三聚体下面、负责完成与细胞膜融合的S2三聚体。
这也是科学家首次对新冠病毒S蛋白与其受体ACE2的结合过程,进行完整的研究。这一研究成果也会让科学家对疫苗和药物的研发产生新见解。
弗朗西斯·克里克研究所的结构生物学家Steven J. Gamblin是本研究的通讯作者,Donald J. Benton和Antoni G. Wrobel是共同第一作者兼通讯作者,中山大学第七附属医院的Pengqi Xu对本研究也有贡献。

自新冠疫情爆发以来,新冠病毒入侵细胞的蛋白和相应的受体就成为科学家的关注焦点。
在全球科学家的努力之下,我们很快就知道,新冠病毒是借助于S蛋白结合人细胞表面的受体蛋白ACE2,才得以感染人体细胞。
时至今日,大量的基础研究让我们认识到,S蛋白由S1和S2两部分组成,其中由N端结构域(NTD)和RBD组成的S1负责与ACE2结合,而S2主要负责与人细胞膜的融合,完成遗传物质的释放。S蛋白以三聚体的形式存在,形如花朵,其中S2三聚体以螺旋的形式构成柄部结构,而三个S1则覆盖在S2三聚体的顶部。
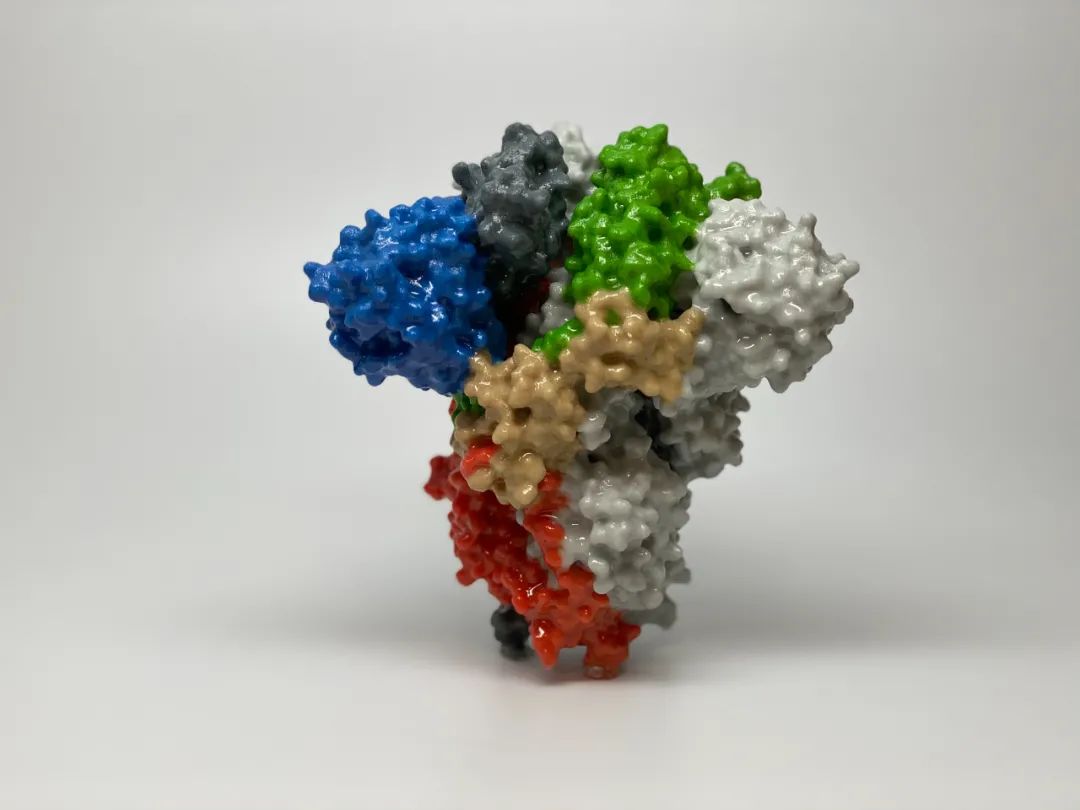
正常情况下,在病毒的膜上,S蛋白是以封闭的形式存在的,以S1的三个RBD盖在S2的顶部,此时ACE2没办法与S蛋白三聚体结合。在S1和S2之间的Furin蛋白酶切位点被切割之后,S蛋白变得不稳定,S1打开,RBD竖起来,与ACE2结合,最终实现病毒的侵染。
虽然把之前的研究结果放在一起,我们大致可以推测出S蛋白与ACE2结合的机制,但是目前还没有一个研究能完整地记录下S蛋白与ACE2结合过程中,以及S蛋白整体构像的变化。
为了搞清楚这个问题,Gamblin和他的同事将经过Furin蛋白酶处理过的S蛋白三聚体与ACE2混合,然后将它们放到液态乙烷中冷冻处理,用冷冻电镜观察。
在整个研究过程中,研究人员共拍摄了数万张不同结合阶段的高分辨率图像。
经过对图像的分析,研究人员得到了10个不同阶段的S蛋白,以及S蛋白-ACE2的复合体:从完全关闭,没有结合ACE2的S蛋白三聚体,到完全打开且与三个ACE2结合的S蛋白-ACE2复合体,以及已经从复合物上解离下来的S1-ACE2复合物。
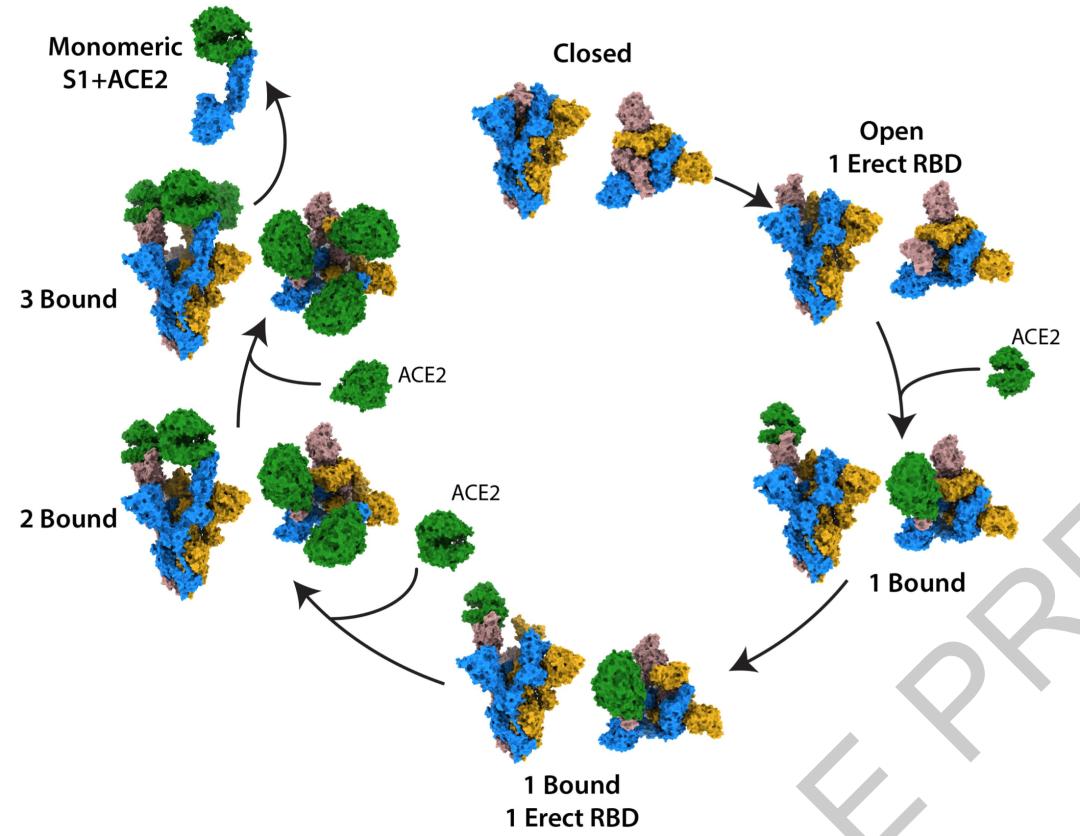
总体上看,在所有的S蛋白三聚体中,有三分之二的三聚体与ACE2结合。绝大部分没有结合ACE2的S蛋白三聚体处于完全封闭状态,只有16%的未结合S蛋白三聚体存在一个竖起的RBD。在那些与ACE2结合的S三聚体中,有一半的S蛋白三聚体结合的是一个ACE2。
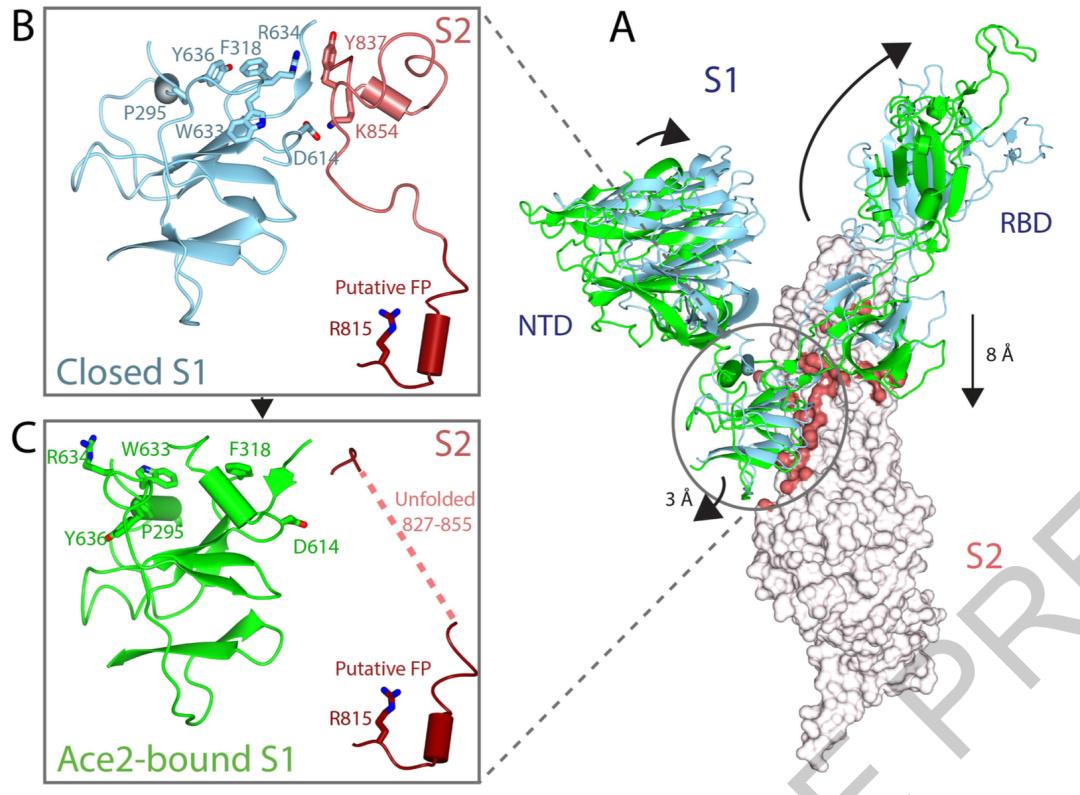
将存在一个竖立RBD且不与ACE2结合的复合体,与存在一个竖立RBD且与ACE2结合的复合体相比较,研究人员发现:ACE2的结合改变了RBD的位置,导致RBD远离三聚体纵轴心约5.5Å。这说明ACE2结合会促进RBD的打开。
除此之外,S1和S1之间的接触面积大幅缩小,S1和S2的接触面积也大幅缩小,它们之间相互作用的关键氨基酸残基的位置也发生改变。这意味着,ACE2与RBD的结合,会促使S1和S2之间的相互作用消失。
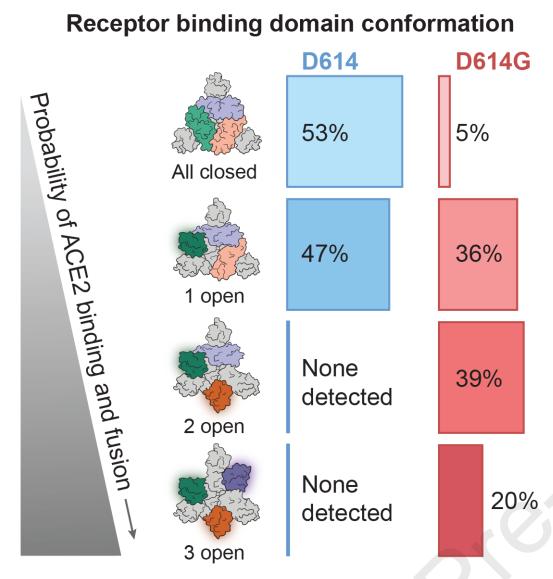
在本研究中,研究人员还特地注意到了S1中与S2的Lys854形成盐桥的Asp614;因为这两个残基形成的盐桥,在维持S蛋白的封闭上起到了一定的作用。而目前最常见的D614G突变,其实就是发生在这里,原本的天冬氨酸(Asp,D)变成了甘氨酸(Gly,G)。
这个突变化不仅导致盐桥丧失,还会促使S1形成一个与S2不相容的新α螺旋。这种变化可能会导致S蛋白封闭形式稳定性的降低,促进RBD的开放,以及与ACE2的结合。
随后,研究人员又进一步研究了ACE2与S1的结合后,S蛋白三聚体的构像变化。他们注意到,在S蛋白三聚体完全开放的情况下,三个S1的偏离,会导致中间出现一个直径为50Å,深为60Å的空腔。在这个空腔的底部,就是能与细胞膜融合的关键部分。
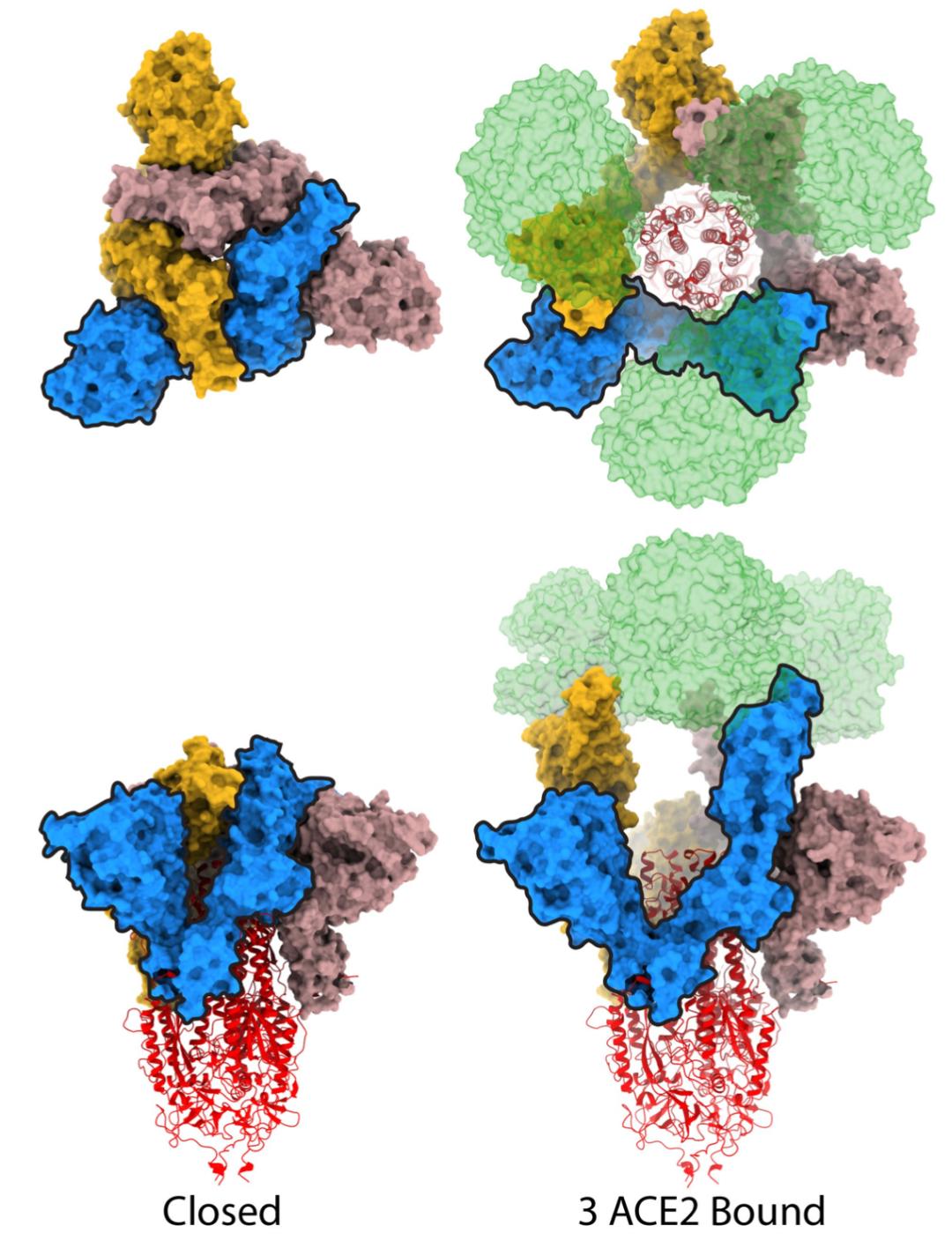
研究人员推测,为了让膜融合的发生,S2蛋白三聚体很可能经历一次主要的螺旋重排,通过重构生长和延伸,最终将融合肽捅到宿主的细胞膜上。在此过程中,已经与ACE2结合的S1会以单体的形式,从复合体上解离下来,促进S2的重构。
Gamblin和他的同事还注意到,由于一个ACE2与RBD的结合就足以完成细胞膜的融合,因此只需要S蛋白上有一个S1处于开放状态,也就是RBD竖起,就足以有效地起动S2中这些发生在膜融合过程中的重排。
而且,研究人员认为:触发融合构象的可能性,随着结合的ACE2受体数量的增加而增加。实际上关于这一点,D614G突变株就是最好的证据。因为科学家已经发现,。
“随着我们揭开感染最早阶段的分子机制,新的治疗靶点可能会显露出来,”Antoni Wrobel说,“或者我们还可以了解哪些现有的抗病毒疗法可以更好地对抗新冠病毒感染。”
参考文献:
[1].https://www.nature.com/articles/s41586-020-2772-0


冷冻电镜果然厉害
原标题:《《自然》: 新冠病毒进入细胞的操作太溜了!科学家首次看到S蛋白与ACE2结合全过程,一接触,S蛋白就张开“血盆大口”丨科学大发现》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。













- 曲终人不散
- 3起整治形式主义典型问题被公开通报
- 六部门发文优化离境退税政策

- 创新药ETF“霸屏”涨幅榜,基金经理看好新消费
- 公募基金年内分红超800亿元,ETF分红猛增182%

- 中国载人航天工程的第二十艘神舟系列载人飞船
- 歇后语,“芝麻开花”的后半句

- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司






