- +1
Nature子刊:同济大学高绍荣团队建立大幅降低基因编辑模式动物嵌合率的新方法

然而,注射的Cas9一旦开始发挥作用即具有持续切割的能力,很难在时间及空间水平上精确地控制Cas9的活性,这限制了Cas9注射方法的应用范围并且突显出了许多弊端。首先,传统的显微注射方法,由于具有持续的Cas9切割活性,其产生的基因编辑胚胎或者动物绝大部分都存在着基因型嵌合,需要经历长时间的繁育纯化过程。其次,目前还没有一种有效的方法可以在胚胎中利用CRISPR-Cas9技术对亲本特异性的位点进行编辑。这些缺陷归根结底是因为不能有效的对Cas9活性进行时空特异性控制。
近日,同济大学生命科学与技术学院高绍荣团队在 Nature Communications 杂志在线发表了题为:Precise allele-specific genome editing by spatiotemporal control of CRISPR-Cas9 via pronuclear transplantation 的研究论文。
研究团队建立了一种名为Past-CRISPR(parental allele-specific gene-targeting)的方法,能够高效的对亲本特异性等位位点进行编辑并能大幅的降低基因编辑模式动物的嵌合率。

基于这两点假设,研究团队在MII期卵母细胞中共注射Cas9 mRNA及靶向目的基因的sgRNA之后进行体外受精(IVF)。等到受精卵发育到PN3-4阶段(7~9 h.p.f),将注射组受精卵的雌原核或者雄原核分别取出,并转移到分别去除雌原核或者雄原核的正常受精卵中重构出二倍体受精卵。理论上,重构受精卵的一套染色体组已经被编辑而另一套染色体组为野生型(Pat-ko/Mat-wt; Mat-ko/Pat-wt)。
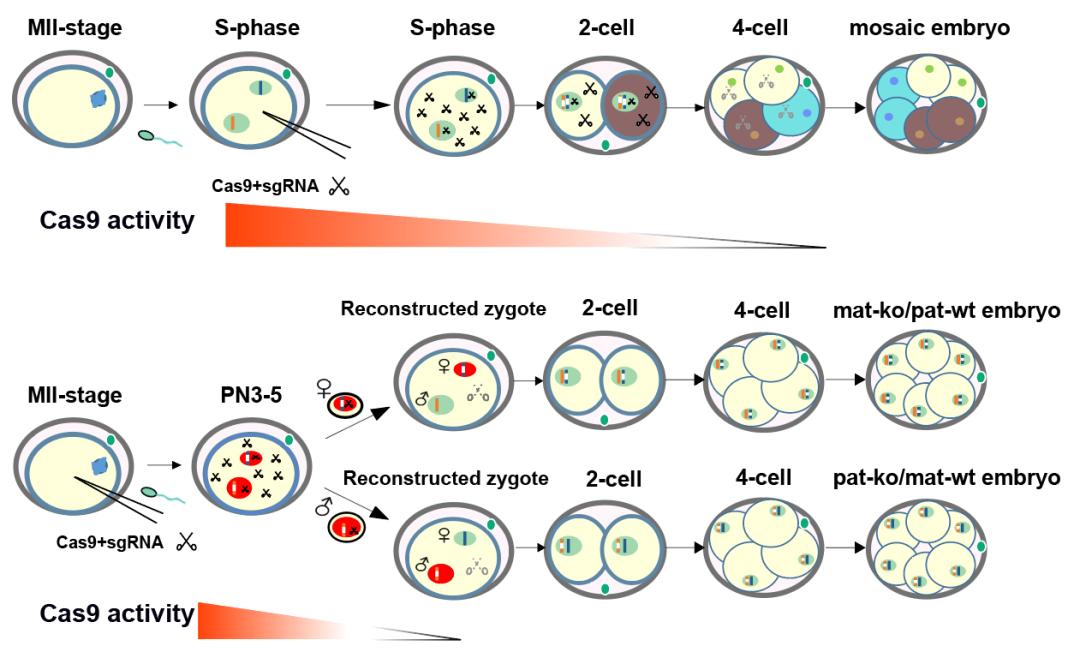
接下来,研究团队利用Past-CRISPR方法进行了多种基因编辑的应用。该方法能够通过一步法对印记基因进行功能及表型的鉴定;该方法能够快速且有效的产生携带有突变致死基因的单等位突变的动物模型,并且证明该致死突变可稳定遗传给后代;同时,该方法可通过一步法得到没有基因型嵌合的完全基因敲除的动物模型。最后,该方法还能用于对显性遗传疾病的治疗,研究人员利用Fgfr3显性突变导致的侏儒症小鼠疾病模型(Gly369Cys),利用Past-CRISPR方法特异性地破坏显性突变等位位点从而纠正子代骨发育异常的病理症状,阻断了该疾病在子代中的传播。
总之,该项研究建立了一种亲本等位特异性基因编辑的方法(Past-CRISPR),利用原核互换显微操作技术介导的胞质稀释作用可以时空特异性的控制Cas9的编辑活性。该方法能够精确的对特定基因位点进行亲本特异性编辑并能大幅降低基因编辑动物的嵌合率,可广泛的应用于亲本效应基因的功能鉴定,疾病治疗及动物模型的构建。
据悉,同济大学生命科学与技术学院高绍荣教授和刘文强研究员为本文的共同通讯作者。同济大学生命科学与技术学院博士研究生李延鹤为本文第一作者。同济大学口腔医学院直博生翁雨藤也参与该研究,该研究也得到同济附属口腔医院王佐林教授的支持帮助。
论文链接:
https://www.nature.com/articles/s41467-020-18391-y
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




