- +1
【学术前沿】董晨、Casey Weaver等全面回顾Th17细胞的发现史
以下文章来源于BioArt ,作者Summer

BioArt
高屋建瓴,提供专家点评,引导学术争论,展现学术批评;诚心实意,关注科研生态,推广科研经验,倡导师生交流。

关注我们,获取更多相关资讯
经典的免疫学教材将辅助性T细胞(helper T cell)分为Th1,Th2,Th17,滤泡辅助性T细胞(Tfh),调节性T细胞(Treg)五类。2005年,清华大学免疫学研究所董晨教授与Casey T Weaver教授于在Nature Immunology背靠背发文报道了Th17细胞的发现,这一发现打破了免疫学家二十多年来对辅助性T细胞只有Th1和Th2两类的认知。值得一提的是,董晨教授同时还是Tfh的奠基者。
为了庆贺杂志创办二十周年,Nature Immunology杂志邀请在过去做出重要贡献的科学家分享其重要发现背后的故事。董晨教授和Casey T Weaver教授分别回顾了他们发现Th17细胞的过程, 现将全文编译如下,与大家共享。
第一部分:

图片来源:Nature Immunology
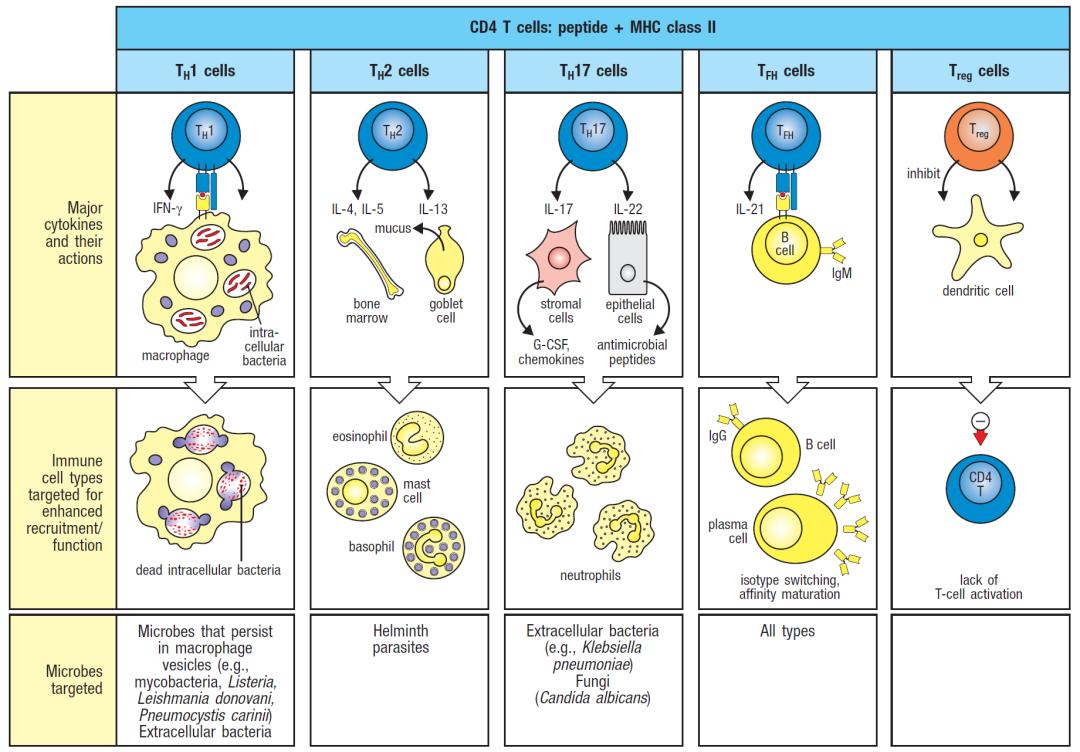
在新世纪的曙光中,免疫学家知道CD4 +辅助T细胞可以分为1型和2型辅助T细胞(分别为Th1和Th2细胞)已经有20年了。Th1和Th2细胞不仅分别对细胞内和细胞外病原体的免疫反应有重要意义,在免疫病理学方面的免疫应答也非常重要——Th1细胞之于自身免疫性疾病,Th2细胞之于过敏。当我于2000年11月加入华盛顿大学医学院担任助理教授时,我的兴趣是了解共刺激通路如何调节免疫耐受和效应T细胞功能。在敲除Icos基因后,我们发现ICOS在T细胞中的选择性作用于Th2分化和IgE的产生【1】。在美国关节炎基金会授予的关节炎研究者奖的支持下,我计划分析ICOS在胶原诱导的关节炎中的作用。
图片来源:Janeway's Immunobiology 9th Edition
2001年,我偶然读到一些关于细胞因子IL-17的文章,它也被称为IL-17A,是一个新的细胞因子家族的成员。类风湿关节炎患者的滑膜中可大量检测到IL-17。具有效应或记忆表型的CD4+ T细胞被认为是IL-17的主要来源。2002年,Heon Park作为博士后研究员来到实验室后,我们正式开始研究IL-17。他的课题是研究IL-17在炎症中的作用,方法是在转基因小鼠在肺中特异性地过表达IL-17。Heon在这些小鼠中观察到自发性气道炎症和黏液的产生,表明IL-17可能是炎症的驱动因素【2】。此外,Heon与西雅图系统生物学研究所的Tian Qiang合作,应用microarray技术鉴定成纤维细胞中IL-17调控的基因,他们发现IL-17诱导趋化因子和基质金属蛋白酶等促炎介质的表达【2】。与此同时,实验室另一位博士后Zhaoxia Li发现在多发性硬化症小鼠模型中,用抗体阻断IL-17可显著减少白细胞的浸润【2】。
Heon计划的另一个目标是制造Il17a GFP报告基因敲入小鼠。实现这个目标的原因是基于我在西雅图华盛顿大学的第一位博士后研究员Roza Nurieva的工作。Roza研究了Icos-/-小鼠,发现它们对胶原蛋白诱发的关节炎具有绝对的抵抗力【3】。但是,当她对这些小鼠中脾脏T细胞产生的细胞因子进行分析时,发现在没有ICOS的情况下促炎性介质IFN-γ和TNF的产生没有缺陷,尽管这个模型被认为是Th1炎症模型。然而,Icos-/-小鼠在产生IL-17上存在缺陷。我们在2003年发表了这些研究结果【3】。

a, Heon Park b, 董晨
图片来源:Nature Immunology
根据Roza的观察,我们认为IL-17可能以ICOS依赖的方式与IFN-γ受到不同的调节,并且IL-17在驱动自发炎症中可能比IFN-γ更重要。2003年,美国国家关节炎与肌肉骨骼与皮肤病研究所资助我们使用系统生物学来研究T细胞中IL-17产生的调控机制以及炎症中IL-17下游的基因。Roza发现,IL-17的表达不仅依赖于ICOS,而且还需要CD28。尽管我们最初认为IL-17是由IFN-γ+Th1细胞产生的,但是当Heon和Zhaoxia进一步发现,Ifng、Tbx21、Il4、Stat6等基因缺陷小鼠中(Th1和Th2细胞发育存在障碍),IL-17的分泌并不受到影响【2】。这一证据表明,IL-17分泌细胞是一类完全不同于已知的Th1和Th2的细胞。2005年,Dan Cua的研究小组表明IL-23可以扩增表达IL-17的T细胞,而IL-12可以选择性扩增表达IFN-γ的细胞(Th1)【4】。此外,microarray数据表明,IL-23诱导的T细胞具有独特的基因表达模式【4】。在我们搬到休斯顿的MD安德森之后,于2004年加入实验室的博士后研究员Xuexian Yang证实,IL-23可以增强T细胞中IL-17的表达【2】。


到那时,我们得出的结论是,产生IL-17的T细胞亚型通过独立于Th1和Th2细胞的途径发育,具有独特的基因表达谱,更重要的是,可以通过生产IL-17驱动组织炎症。在2005年,Nature Immunology背靠背发表了我们和Casey Weaver实验室的论文【5】。通过描述介导Th17发育和功能的独特细胞因子和转录因子,这类新型Th17细胞在免疫学界引起广泛赞同【6】。2015年,针对IL-17的药物被正式批准用于治疗人类炎症性疾病【7】。
IL-17在皮肤中的作用
图片来源:Immunity
但是,某些自身免疫性疾病(尤其令我们失望的是类风湿性关节炎)无法用IL-17抗体治疗。ICOS的配体在B细胞上表达,其对于滤泡辅助性T细胞(Tfh)的发育也很重要,对于体液免疫【8】以及抗体介导的自身免疫至关重要。我热切期待在自身免疫性疾病中靶向Tfh细胞的结果。
第二部分:

图片来源:Nature Immunology
Mosmann和Coffman的Th1-Th2假说诞生于DNAX研究所【9】,出于对T细胞生物学的兴趣,当时我是华盛顿大学Emil Unanue课题组的实习生。这个假说提出有两个主要的CD4+ T细胞亚群,根据它们产生的细胞因子的独特模式,每个亚群在适应性免疫中专门扮演不同的角色。这个假说对领域以及我个人的影响都是不可估量的,它为我们对免疫调节的理解以及最终发现Th17细胞的重大进展奠定了基础【5】。我的好朋友兼病理学住院医师Ken Murphy的研究成果对我产生了同样的影响。Ken创建了第一个T细胞受体转基因小鼠系DO11.10,他发现Th1和Th2细胞可以从共同的克隆前体细胞发育而来【10】,从而确定Th1和Th2细胞的命运与抗原特异性没有固定联系。在与Anne O 'Garra(另一名DNAX研究员)的团队合作和Emil的投入下,Ken的小组还发现胞内细菌病原体单核细胞增多性李斯特氏菌激活的抗原呈递细胞(APC)诱导naive CD4+ T细胞变成Th1细胞,由李斯特菌激活的APC产生的白介素(IL)-12 是Th1细胞分化的关键【11】。这些和其他研究证实了naive CD4+ T细胞是多能的,向Th1还是Th2分化取决于从APCs接收到的信号,APCs由病原体相关分子模式(PAMPs)激活,这是Charlie Janeway最初设想的【12】。
在随后的十年中,随着影响Th1-Th2细胞分化的因素得到更好的定义,人们对Th1和Th2细胞在宿主防御和免疫介导疾病中的作用也得到了更好的理解。Th1细胞可能增强巨噬细胞对细胞内病原体的清除,Th2细胞可能增强对多细胞寄生虫的驱逐。当两者失调时,都可能导致不同类型的疾病:Th1细胞与自身免疫相关,Th2细胞与过敏性疾病相关。然而,由于微生物威胁的多样性比细胞内病原体和蠕虫更广泛,对这些亚群的专门化的更深入的认识使它们似乎越来越受到限制。这让我怀疑CD4+ T细胞之间是否存在进一步的异质性,或许还有其他未被发现的亚群承担着宿主防御其他病原体的任务。如果是这样,似乎尚未确定的T细胞亚群也可能参与免疫介导的疾病。
图片来源:Nature Immunology
当我搬到阿拉巴马大学伯明翰分校病理学系,并开始与那里的新同事交流时,这些想法在我的头脑中开始萌发。其中最著名的是粘膜免疫学家Chuck Elson和Jerry McGhee,他们产生深远地影响了我的思想和职业轨迹。同时,Bob Coffman小组的其他开创性研究也颇具影响力。当时在DNAX的博士后Fiona Powrie报告说,将naive CD4+ T细胞转移到缺乏T细胞的小鼠体内会导致大肠自发性炎症(结肠炎)。这依赖于Th1细胞因子IFN-γ,而不依赖于Th2细胞因子,暗示Th1细胞是这个模型中的致病因子【13】。通过其他人的工作,很快就知道了病原性T细胞对源自肠道菌群的抗原具有反应性,对此的研究才刚刚开始引起免疫学界的兴趣。但是以我的想法,这导致了一个明显的难题:如果该模型中的T细胞识别出肠道微生物群的抗原,而这些抗原绝大多数是细胞外细菌,如果Th1细胞只对细胞内微生物产生反应,那它们又是如何起作用的呢?
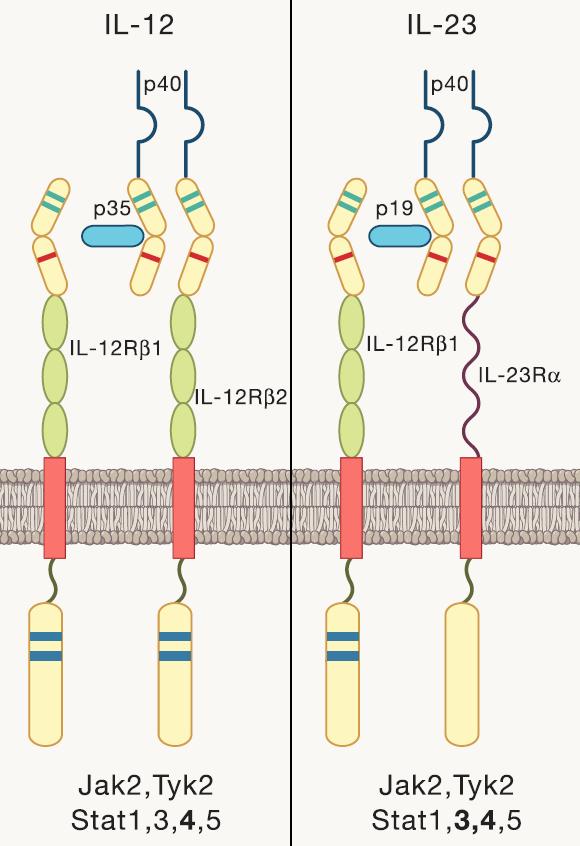
这个难题的解决方案由DNAX的另外两名杰出研究人员来制定:Rob Kastelein和Dan Cua。Rob开始挖掘最近从美国国立卫生研究院(NIH)基因组计划生成的数据库,以鉴定与IL-12同源的基因,从而发现了IL-12细胞因子家族的其他成员,包括IL-23【14】。IL-23和IL-12在其异二聚体结构中有一个相同的亚基,即IL-12p40,但其另一亚基却有所不同。在与Rob的合作中,Dan利用这些亚基之一或另一亚基缺失的小鼠发现IL-23,而不是Th1相关的诱导分子IL-12,对两种典型的“TH1”介导的疾病模型是必不可少的:实验性自身免疫性脑炎(EAE)和胶原诱导的关节炎【15,16】。结合Genentech科学家的一项发现,他们发现IL-23和新鉴定的细胞因子IL-17之间的联系【17】,很明显,IL-23可以激活一部分记忆CD4+ T细胞产生IL-17。这项发现以及Dan的工作将IL-23确立为先前与Th1相关的疾病的发病机理至关重要的工作,激起了人们对了解这种新的产生IL-17的T细胞亚群起源的兴趣。
图片来源:Immunity
2002年初Laurie Harrington的到来让我们找到了解决办法。Laurie在IL-12–IFN-γ/IL-23–IL-17难题中处于领先地位,注意到了我们和其他人在Powrie T细胞转移模型中的观察结果:每当我们分析从结肠炎小鼠中得到的T细胞的细胞因子谱时,我们始终观察到IL-17和IFN-γ的表达差异;也就是说,产生IFN-γ或IL-17的T细胞存在明显的差异,很少同时产生两者。但是,由于IFN-γ和IL-17的产生者似乎总是相互伴随,而且由于Th1细胞表达的IL-12受体与IL-23受体有一个共同的亚基,似乎有理由推测IL-17产生者可能来自Th1途径【18】。这将被证明是错误的:实际上,反了。
图片来源:Janeway's Immunobiology 9th Edition
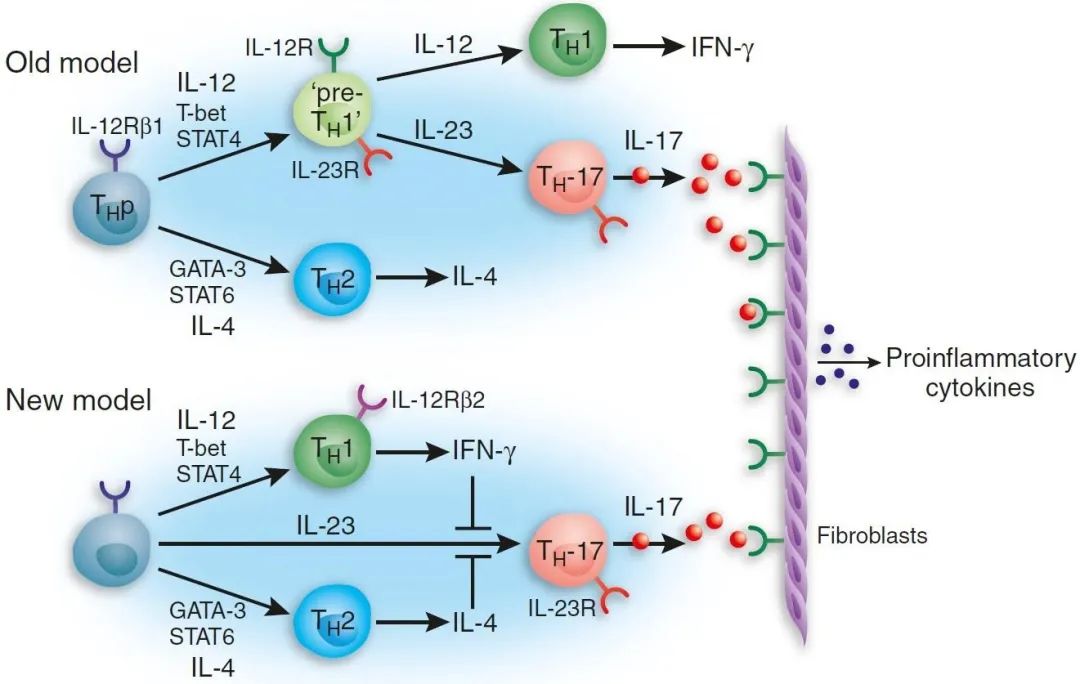
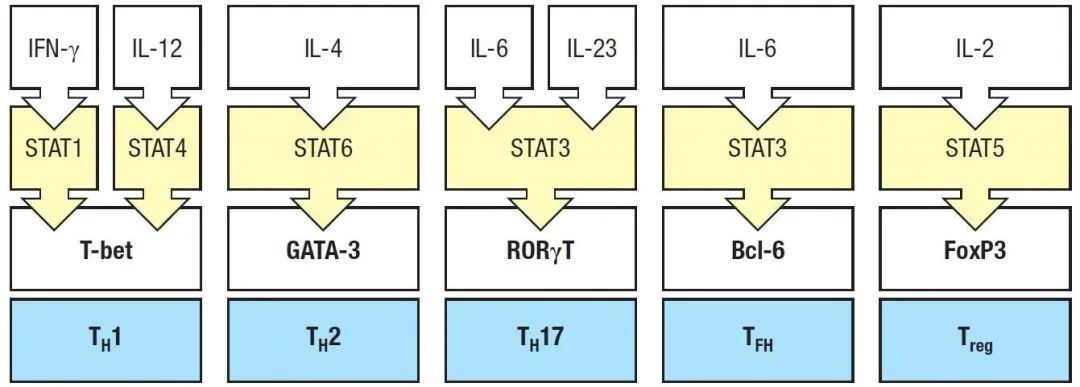
一系列令人沮丧的实验之后情况发生了反转,Laurie在体外产生了Th1细胞,然后将其暴露于IL-23,如果IL-17产生者是从Th1前体衍生的,那么IL-23可能作用于Th1细胞,抑制IFN-γ而有利于IL-17的产生,但事实并非如此。像许多科学进步一样,Th17途径的发现来自一个难题和一点偶然性。当我们重新考虑这个前提时,关键的线索出现了。也许Th1细胞不是IL-17产生者的前体;也许Th1细胞抑制而不是促进了IL-17细胞的产生。在调查我们的培养系统时,Laurie发现它被大量的Th1细胞因子IFN-γ “污染”。当她通过抗体阻断或使用naive T细胞和/或缺乏IFN-γ的饲养细胞消除IFN-γ时,结果是显著的:在没有IFN-γ的情况下,IL-17产生者发育了【5】。因此,IFN-γ抑制了我们称之为“TH17”细胞的发育,表明它们不太可能由Th1前体发育而来(图1)。事实上,我们发现II型和I型干扰素强有力地抑制Th17细胞的发育,暗示激活STAT1阻碍了Th17细胞的发育。对Th1细胞发育起关键作用的每一个转录因子(STAT1,STAT4和T-bet)缺乏的T细胞,都能同样或更好地发育成IL-17产生者。此外,我们发现发育中的Th17细胞上调了IL-23受体(IL-23R)的诱导部分,而不是IL-12(IL-12Rβ)。由此可见,Th17细胞必须独立于Th1细胞发育,从而使Th17细胞与Th1和Th2细胞一起成为一个新的效应亚型【5】。当我们修改过的论文被另一篇报道了类似发现的论文搁置时【2】,我们感到很惊讶,但令我们欣慰的是,我们的结果被重复了。
突破。Laurie Harrington在2004年9月的一份报告中宣布了她的发现,我们的培养系统中IFN-γ的“污染”解释了我们之前在体外无法区分产生IL-17的CD4+ T细胞的原因。这一发现迅速促进了研究证实这些细胞(称为Th17)并不像假设的那样来自Th1细胞前体,而是独立于并受到促进Th1和Th2细胞发育的因素的抑制。图片来源:Nature Immunology
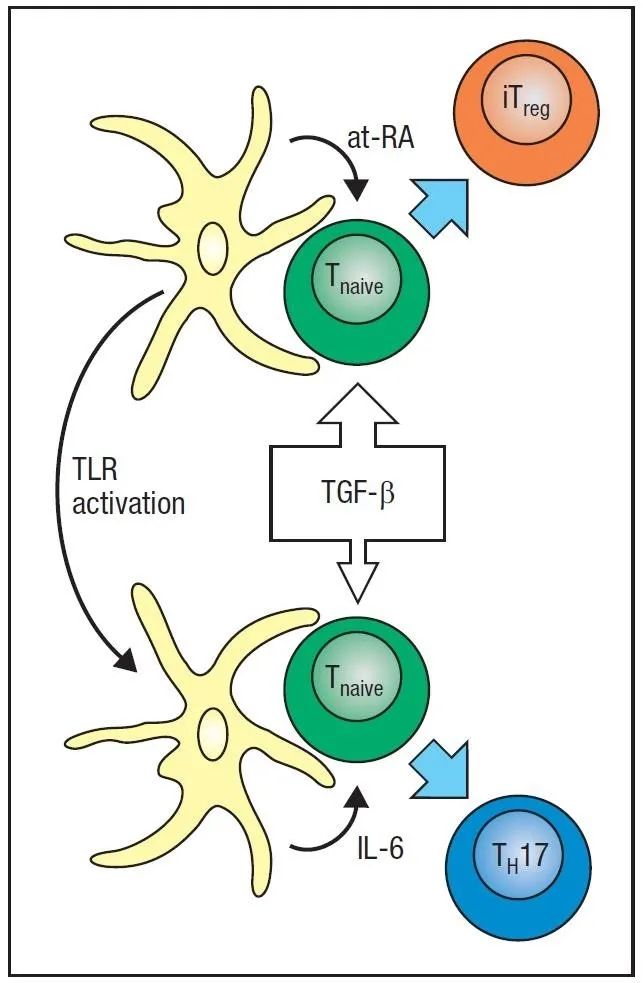
当然,这仅仅只是开始。我们发现,当Th1和Th2途径被抑制时,Th17细胞就会出现,这暗示着其他因素控制它们的发育。这使得我们小组的一名研究生Paul Mangan推测,鉴于TGF-β能抑制Th1和Th2细胞的发育,因此它可能发挥了作用。尽管这有点违反直觉(TGF-β为外周Treg细胞发育中重要的因素),但事实证明这是正确的。在随后的三篇文章中【19-21】,Th17细胞发育通路的主要特征得到了解决,Th17和Treg细胞对TGF-β有着共同需求,但对IL-6信号则有差异,从而揭示了Th17通路与外周Treg细胞发育连接的机制【22】。基于Cua小组与Dan Littman小组合作的发现【23】,很快发现了Th17细胞“主”转录因子RORγt。但仍有未解决的问题:如果Th17细胞的发育独立于Th1细胞,引发我们兴趣的Powrie结肠炎模型中最初发现的基础需要解释,在这种疾病模型和其他疾病模型中,以及在人类中,Th17细胞始终伴随着产生IFN-γ的“Th1”细胞。此外,需要确定这些细胞群是否以及如何导致疾病。
图片来源:Janeway's Immunobiology 9th Edition
对这一点的追求导致了另一个惊喜。另一位研究生Yun Kyung Lee的研究表明,与Th1或Th2细胞相比,Th17细胞的可塑性更强,易于分化为Th1类细胞【24】。因此,我们最初认为Th1细胞是Th17细胞的前体的想法被颠倒了。相反,正是Th17细胞产生了Th1细胞。此外,我们发现,在结肠炎的Th17细胞转移模型中,Th17-Th1转分化对疾病诱导至关重要,博士后Stacey Harbour发现,缺乏IFN-γ或T-bet的Th17细胞无法驱动Th1型炎症,且不能诱发疾病【25】。连同许多其他免疫介导疾病模型的研究,包括Powry进行的研究以及Brigitta Stockinger课题组的一项研究,该研究使用IL-17A命运报告小鼠,发现Th1样细胞是从以前表达过IL-17的细胞发育过来的【26】,这个环是闭合的:在Cua小组的转分化工作之前,与Th1细胞有关的疾病发病机理现在可以通过致病性Th17的出现来解释。在包括IL-23在内的转分化因子的影响下,Th17细胞产生了Th1特征。IL-23是否单独即可促成Th17细胞向Th1样细胞的转变,或者是否也需要丧失稳定Th17细胞的维持因子,仍有待充分阐明,但现在可以从小鼠模型和人类全基因组关联研究(GWAS)认为,IL-23以及Th17细胞对许多免疫介导疾病有着基础性的贡献。
那么,Th17细胞在宿主保护中的作用以及原始Th1–Th2假设中似乎令人费解的可能的“缺失环节”是什么?当然,Th17细胞必须已经进化以提供宿主防御,以抵抗未被Th1和Th2细胞靶向的微生物。事实证明,线索在发现Th17途径之前就很明显了。Kamradt及其同事报道了莱姆病的病原体,胞外菌伯氏疏螺旋体诱导了产生IL-17的CD4+ T细胞(27)。Jay Koll的小组确定了IL-17(以及后来的IL-23)信号转导与宿主对肺炎克雷伯菌感染的保护反应之间的联系【28】。我们报道了IL-23在抵抗另一种细胞外细菌肠病原性啮齿动物柠檬酸杆菌中起着不可或缺的作用【19】。Th17细胞已经与包括细胞外细菌和真菌在内的一组重要病原体联系在一起,因此可以更全面地了解适应性免疫系统应对几乎所有类型微生物的策略。现在,考虑到Th17细胞和由共生菌群驱动的免疫介导性疾病之间的关系,这就说得通了。共生菌群是细胞外微生物和条件致病菌的最大来源,免疫系统一生都必须应对这些微生物和条件致病菌。最后,根据我的长期合作伙伴Robin Hatton的假设,Th17和外周血Treg细胞可能代表了脊椎动物进化中出现的最古老的T细胞亚群,这也许体现了鼓励肠道菌群这一非凡的代谢引擎多样化,来赋予生存优势的早期策略【29】。最后发现但首先出现的是,Th17细胞在适应性免疫系统细胞中的位置现在是安全的。
后记
关于命名的后记:我们如何从Th1和Th2得到Th17?在考虑为这些细胞指定一个名称时,“Th3”是符合逻辑的,但是这个术语已经在文献中作为由口服耐受诱导的CD4+ T细胞(后来被确定为Treg细胞)的名称存在。跳到“Th4”没有任何意义,因为它并不符合新的范式,所以我们选择以细胞因子的名字来命名这些细胞。因此,具有一点历史讽刺意味的是,根据它们在进化中的早期表现,可能最好被归类为Th1的细胞,却反而变成了Th17细胞。类似地,Th1可能最好被指定为Th2,并且Th2、Th3——第一排在最后,而第二和第三排在了第一和第二。
原文链接:
https://www.nature.com/articles/s41590-020-0649-x
https://www.nature.com/articles/s41590-020-0715-4
向上滑动阅览参考文献
1. C. Dong et al., ICOS co-stimulatory receptor is essential for T-cell activation and function. Nature 409, 97-101 (2001).
2. H. Park et al., A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17. Nat Immunol 6, 1133-1141 (2005).
3. C. Dong, R. I. Nurieva, Regulation of immune and autoimmune responses by ICOS. J Autoimmun 21, 255-260 (2003).
4. C. L. Langrish et al., IL-23 drives a pathogenic T cell population that induces autoimmune inflammation. J Exp Med 201, 233-240 (2005).
5. L. E. Harrington et al., Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat Immunol 6, 1123-1132 (2005).
6. C. Dong, TH17 cells in development: an updated view of their molecular identity and genetic programming. Nat Rev Immunol 8, 337-348 (2008).
7. Y. Lai, C. Dong, Therapeutic antibodies that target inflammatory cytokines in autoimmune diseases. Int Immunol 28, 181-188 (2016).
8. R. I. Nurieva et al., Generation of T follicular helper cells is mediated by interleukin-21 but independent of T helper 1, 2, or 17 cell lineages. Immunity 29, 138-149 (2008).
9. T. R. Mosmann, H. Cherwinski, M. W. Bond, M. A. Giedlin, R. L. Coffman, Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J Immunol 136, 2348-2357 (1986).
10. C. S. Hsieh, A. B. Heimberger, J. S. Gold, A. O'Garra, K. M. Murphy, Differential regulation of T helper phenotype development by interleukins 4 and 10 in an alpha beta T-cell-receptor transgenic system. Proc Natl Acad Sci U S A 89, 6065-6069 (1992).
11.C. S. Hsieh et al., Development of TH1 CD4+ T cells through IL-12 produced by Listeria-induced macrophages. Science 260, 547-549 (1993).
12. C. A. Janeway, Jr., Approaching the asymptote? Evolution and revolution in immunology. Cold Spring Harb Symp Quant Biol 54 Pt 1, 1-13 (1989).
13. F. Powrie et al., Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45RBhi CD4+ T cells. Immunity 1, 553-562 (1994).
14. B. Oppmann et al., Novel p19 protein engages IL-12p40 to form a cytokine, IL-23, with biological activities similar as well as distinct from IL-12. Immunity 13, 715-725 (2000).
15. D. J. Cua et al., Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain. Nature 421, 744-748 (2003).
16. C. A. Murphy et al., Divergent pro- and antiinflammatory roles for IL-23 and IL-12 in joint autoimmune inflammation. J Exp Med 198, 1951-1957 (2003).
17. S. Aggarwal, N. Ghilardi, M. H. Xie, F. J. de Sauvage, A. L. Gurney, Interleukin-23 promotes a distinct CD4 T cell activation state characterized by the production of interleukin-17. J Biol Chem 278, 1910-1914 (2003).
18. E. Bettelli, V. K. Kuchroo, IL-12- and IL-23-induced T helper cell subsets: birds of the same feather flock together. J Exp Med 201, 169-171 (2005).
19. P. R. Mangan et al., Transforming growth factor-beta induces development of the T(H)17 lineage. Nature 441, 231-234 (2006).
20. E. Bettelli et al., Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature 441, 235-238 (2006).
21.M. Veldhoen, R. J. Hocking, C. J. Atkins, R. M. Locksley, B. Stockinger, TGFbeta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells. Immunity 24, 179-189 (2006).
22. C. T. Weaver, L. E. Harrington, P. R. Mangan, M. Gavrieli, K. M. Murphy, Th17: an effector CD4 T cell lineage with regulatory T cell ties. Immunity 24, 677-688 (2006).
23. Ivanov, II et al., The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell 126, 1121-1133 (2006).
24. Y. K. Lee et al., Late developmental plasticity in the T helper 17 lineage. Immunity 30, 92-107 (2009).
25. S. N. Harbour, C. L. Maynard, C. L. Zindl, T. R. Schoeb, C. T. Weaver, Th17 cells give rise to Th1 cells that are required for the pathogenesis of colitis. Proc Natl Acad Sci U S A 112, 7061-7066 (2015).
26. K. Hirota et al., Fate mapping of IL-17-producing T cells in inflammatory responses. Nat Immunol 12, 255-263 (2011).
27.C. Infante-Duarte, H. F. Horton, M. C. Byrne, T. Kamradt, Microbial lipopeptides induce the production of IL-17 in Th cells. J Immunol 165, 6107-6115 (2000).
28. P. Ye et al., Requirement of interleukin 17 receptor signaling for lung CXC chemokine and granulocyte colony-stimulating factor expression, neutrophil recruitment, and host defense. J Exp Med 194, 519-527 (2001).
29. C. T. Weaver, R. D. Hatton, Interplay between the TH17 and TReg cell lineages: a (co-)evolutionary perspective. Nat Rev Immunol 9, 883-889 (2009).
来源:BioArt

1980-2020
原标题:《【学术前沿】董晨、Casey Weaver等全面回顾Th17细胞的发现史》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




