- +1
55%乳腺癌患者存在HER2低表达,JCO发表权威综述
原创 祝旭龙 医学界肿瘤频道

近日,《临床肿瘤学杂志》(JCO)发表了题为“HER2低表达乳腺癌(BC):病理和临床概况”的综述,总结了HER2低表达/HER2弱阳性BC[HER2 免疫组化(IHC)评分为1+或2+、原位杂交(ISH)试验阴性]患者的定义、定位、生物学特性以及所涉及的最新临床研究,旨在将这部分患者筛选出来,独立分析,探究针对HER2通路的治疗对其潜在的价值。现撷取要点与大家分享。

BC是全世界女性中发病率最高的癌症。它是一种异质性疾病,由不同的生物学实体组成,具有不同的预后和致癌因素。基因表达谱研究已经确定了六个主要的BC内在亚群。然而,治疗决策通常基于传统的组织病理学因素,在临床实践中认识到主要的4种预后不同的亚型:Luminal A型、Luminal B型(HER2阴性)、HER2阳性和三阴性BC(TNBC)。特别是,在HER2阳性BC(约占所有BC的15%),ERBB2扩增导致HER2过表达,如果不治疗,这一亚型的癌症具有更强的侵袭性和更差的预后。然而,针对HER2的多种药物的开发已经在早期和晚期患者中提供了显著的临床益处,改变了其自然历史的轨迹。
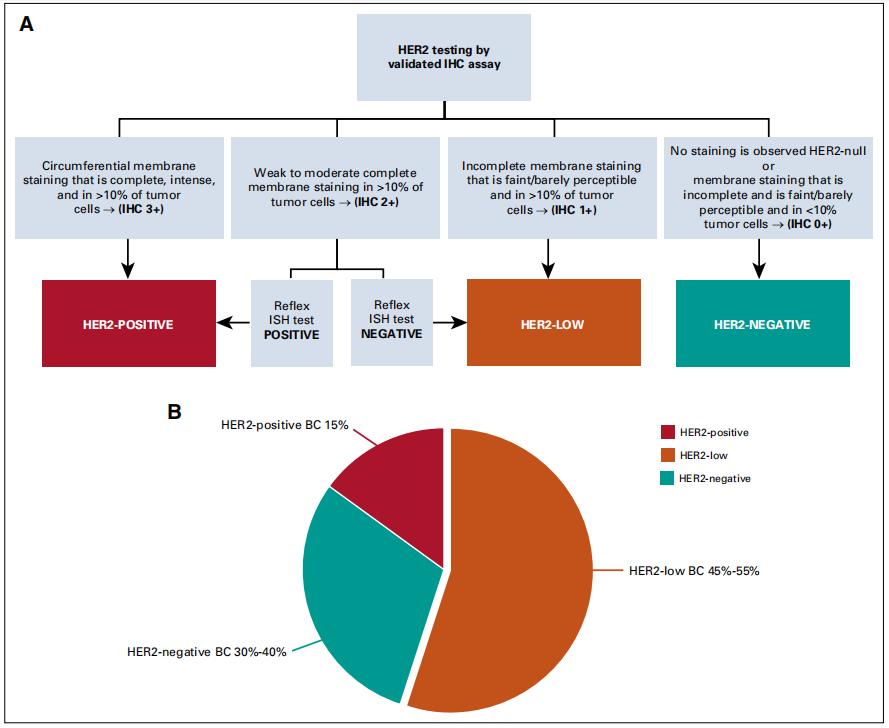
根据2018年美国临床肿瘤学会(ASCO)和美国病理学家学会(CAP)撰写的“HER2检测指南”更新:
当至少一个肿瘤样本IHC分析评为“HER2 3+”或ISH分析证实HER2过度表达或基因扩增时,BC被认为是HER2阳性。
在IHC HER2评分2+的情况下,需要额外进行ISH检测来确定HER2状态,同时在特定ISH结果(第2、3和4组)的情况下回看IHC切片以进行综合评估。
在IHC评分为0和1+,或IHC 2+同时ISH试验阴性的情况下,BC被认为是HER2阴性,不推荐进行HER2靶向治疗,但双探针ISH检测第3组结果(HER2/CEP17比率<2.0,平均每个细胞HER2拷贝数为4.0-5.9)的情况除外,这时候IHC 2+的肿瘤会被认为HER2阳性。
近年来,对于IHC 1+或2+伴ISH-的病例提出了一个潜在的新命名,即HER2低表达/HER2弱阳性BC(HER2-low BC)。在临床实践中,这些肿瘤被报道为HER2阴性,要么被分到TNBC表型,要么分到Luminal样[若激素受体(HR)表达]表型,并且干扰HER2通路的药物对这类患者没有显示出临床益处。
然而,近期通过在抗HER2新药研究中的显示,有人认为,HER2低水平表达及未检测到ERBB2扩增的BC亚组也可能从靶向HER2中获益。与HER2过表达的肿瘤相比,HER2-low BC的获益可能是通过非典型的药理学机制实现的,包括靶向细胞毒性药物进入癌细胞或吸引免疫活性细胞。针对HER2-low BC的新型抗HER2药物的临床开发有可能改善这部分患者的治疗手段,从而可能将这些疗法扩展到目前认为不适合抗HER2治疗的BC患者。
本文综述了HER2-low BC中靶向治疗的研究进展,并提出了一个定义HER2-low BC的算法,因为我们开始重新审视目前HER2表达全或无的模式,假设临床实用的证据得到证实,HER2的表达除了阴性或阳性之外,也应该包括中等水平的表达。如果是这样的话,这将需要更严格的定义,以确保更准确地描述HER2表达水平,从而影响临床决策。
二、HER2-low BC的临床意义
根据目前的评分系统,大多数公布的数据和正在进行的临床试验将HER2-low BC定义为HER2 IHC评分为1+或2+、ISH试验阴性的患者。因此,超过一半的BC可能符合HER2-low(图1)。HER2-Low的临床定义本质上依赖于检测技术,目前只能应用标准的IHC/ISH方法,因为使用其他检测方法将肿瘤定义为HER2-Low的明确参数尚未正式确立。
(1)ISH
ISH检测HER2基因扩增采用各种显色或荧光分析方法,IHC半定量的检测膜蛋白表达,是目前临床上常用的确定肿瘤HER2状态的检测平台。大量的冰冻组织研究证据表明,HER2基因扩增与蛋白表达有直接关系,在没有基因扩增的情况下,基本上没有观察到蛋白的过度表达。然而,新的临床前证据表明,一些抗HER2的抗体偶联药物(ADC) 的活性可能与HER2基因扩增无关,因为在基因扩增和未扩增的BC中均观察到抗肿瘤作用。如果是这样的话,单靠ISH可能不是预测新型抗HER2治疗有效性的理想方法。
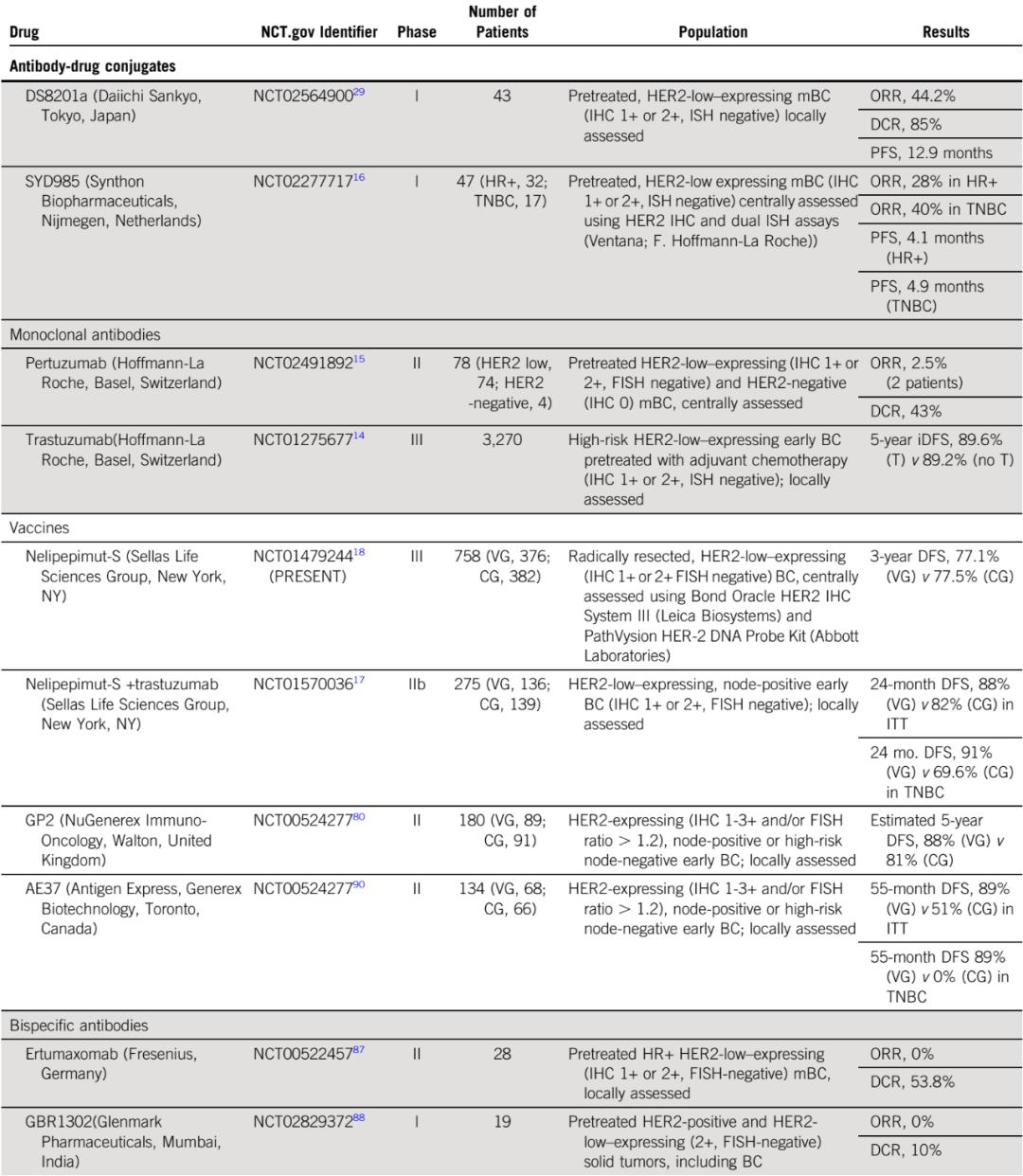
表1:HER2-low BC正在进行的临床试验
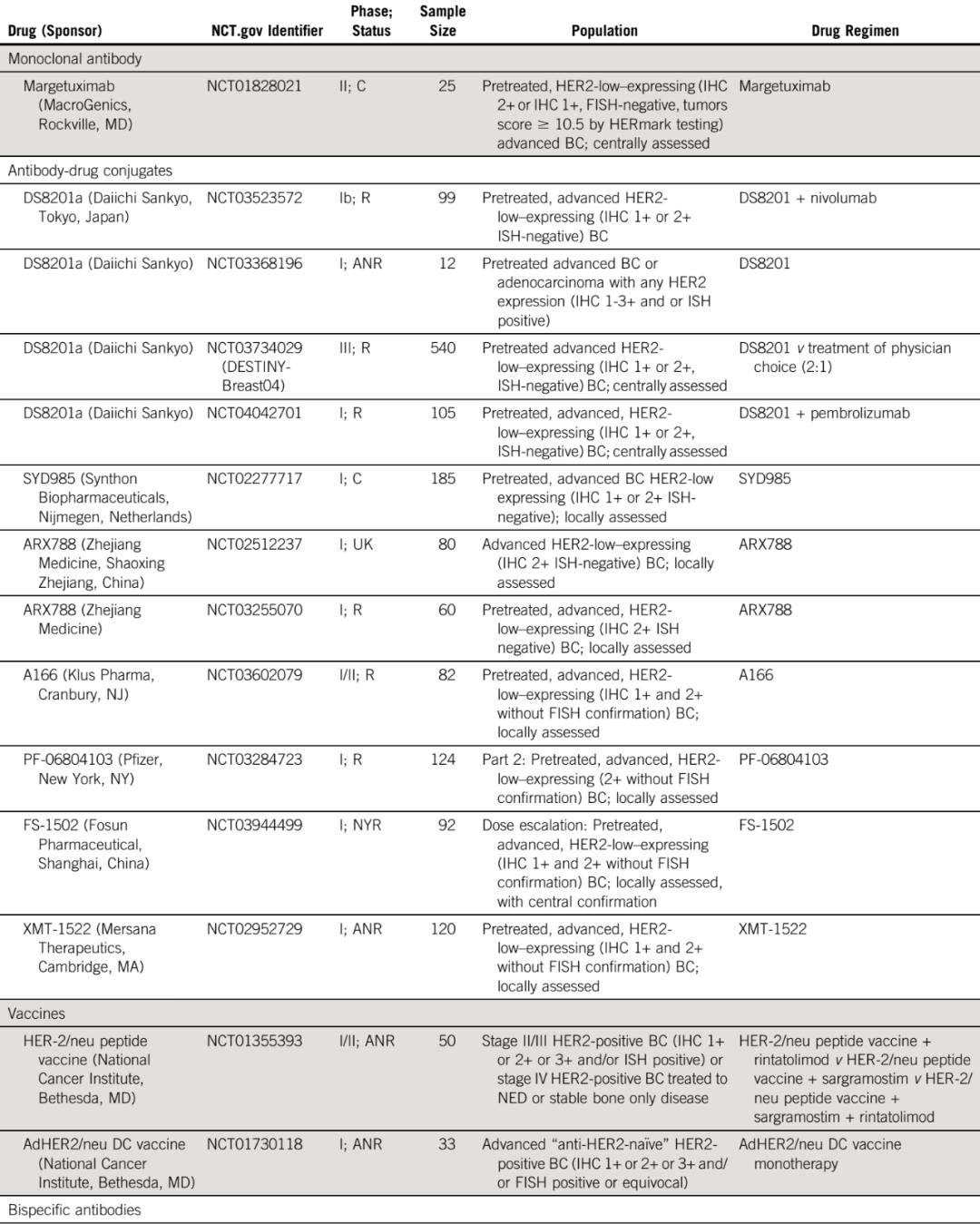
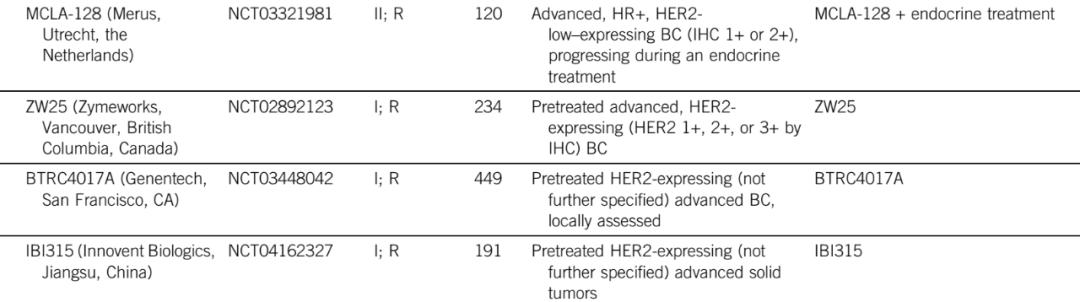
在曲妥珠单抗的重要试验中,IHC被用来评估HER2的状态,并且仍然是临床实践中最常见的初始试验。在试图招募HER2未扩增肿瘤患者参加新型抗HER2药物的临床试验中,IHC也是用于识别HER2-low肿瘤患者的主要技术(表1)。然而,IHC检测本身涉及很多问题,最终可能导致低估HER2-low肿瘤的发生率。
可能影响IHC和ISH检测结果的因素
预分析因素和分析因素可能有助于解释HER2检测在当地实验室和大的实验中心进行临床试验时观察到的一些不一致。一项评估地方实验室和中心实验室进行HER2检测报告的差异性研究显示,最初获得IHC 0分的肿瘤患者中,高达85%的患者实际上是1+或2+,这表明在参考实验室对HER2-low BC进行质量评估和报告是有价值的。因此,病理学家应该遵守2018年ASCO和美国病理学家学会的HER2检测指南,以确保IHC评分的准确性和可重复性。
但即便如此,现有的IHC平台在方法上的局限性可能会影响结果。福尔马林固定可能会人为地降低检测出的蛋白质表达量,而像IHC这样的半定量分析可能不够灵敏,不足以准确检测低水平的HER2表达。因此,IHC评分为0不一定代表细胞膜上完全不存在HER2蛋白,而是由于该技术的人为限制导致蛋白检测不出。
为了解决这些不确定性,几种新的定量分析技术正在研发中,以提高HER2评估的灵敏度。例如,自动化定量分析技术可以通过测量抗体结合荧光团的强度来定量评估HER2的表达,HER mark技术通过邻近释放抗体结合的荧光标记来衡量HER2的表达,定量IHC技术将抗体/抗原复合物转化为可计数的红点以定量HER2的表达,时间分辨荧光能量转移技术通过检测邻近两个荧光团发出的荧光来评估HER2的表达。如果得到验证,这些检测可以提高我们识别HER2-low BC患者的能力。
(3)实时定量聚合酶链反应(RT-qPCR)
RT-qPCR可以对BC样本中HER2 mRNA的表达水平进行更加量化的评估,并已被认为可以充当IHC/ISH的潜在补充或替代,特别是在标准IHC和FISH检测不能明确认定阳性/阴性的肿瘤中。
RT-qPCR的主要优点是可以提供更加标准化、客观和自动化的评估,以及在小样本(如空心针活检样本) 中进行检测的能力不断增强。虽然目前的研究,RT-qPCR与推荐技术的结果相比起来似乎有点矛盾。但是,在HER2-low BC的背景下,RT-qPCR检测对IHC获得的半定量数据是一种潜在的补充。这项工作的最终临床效用将需要在前瞻性和回顾性的临床试验中进行评估。
三、HER2-low BC的临床概况
HER2扩增定义了一种不同的BC亚型,它的转化、流行病学、预后和预测数据已被广泛研究,但是,关于HER2-low BC是否能定义为临床相关的一个乳腺癌亚型,并没有太多的证据。
(1)HER2-low BC的生物学特征:一个新的亚型?
定量分析已经强调了即使在非扩增性BC细胞中,HER2也存在连续表达,在腔内肿瘤和干细胞中发现了更高程度的表达。几个因素可以导致缺乏ERBB2基因扩增的BC细胞中HER2表达的超生理学水平。HER2和雌激素受体通路之间的串扰,以及内分泌治疗诱导的异质性改变,可能促进HER2蛋白的过度表达,成为肿瘤适应和治疗耐药的潜在机制。化疗和放疗也通过激活NF-kB途径上调HER2-low BC细胞中HER2的表达。有趣的是,据报道,当受到肿瘤微环境的刺激时,NF-kB类似于一个功能播放器,来上调非扩增细胞中HER2表达。此外,在HER2-low BC细胞中,HER2上调的模式暗示了其中还存在表观遗传学的变化。
尽管临床前模型表明HER2是多种应激刺激的反应机制,但它在HER2-low BC中的致癌作用尚不清楚。因此,迄今为止的证据不足以支持将HER2-low BC定义为具有治疗反应性与预后相关的单独的乳腺癌亚型。
(2)HER2-low的临床意义
多项回顾性分析已经调查了HER2低表达的预后意义,但结果相互矛盾。总体而言,没有确凿的证据支持HER2-low作为一个独立的预后因素。
作为试验入组标准中的预测因子和主要的生物标志物,在III期 NSABP-B47试验中,HER2-low肿瘤患者从辅助曲妥珠单抗治疗中没有获益。该试验测试了早期乳腺癌患者在标准辅助化疗中加入曲妥珠单抗的效果。
综上所述,这些结果证实了在缺乏HER2基因扩增或蛋白过表达的情况下,用曲妥珠单抗阻断HER2通路的临床价值有限。
尽管如此,新的抗HER2药物的出现表明具有独特作用机制的新型化合物对HER2-low肿瘤具有潜在的预测价值(图2)。前期比较乐观的数据表明,其中一些药物在HER2非扩增的肿瘤中是有活性的,这可能会挑战传统的HER2靶向治疗模式(表2)。
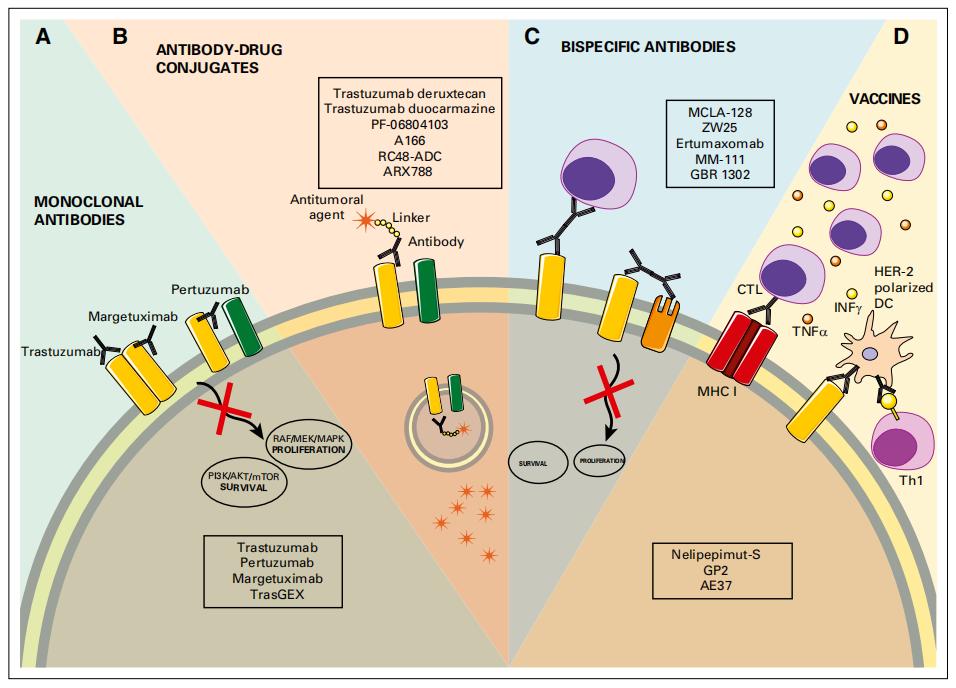
CTL:细胞毒性T细胞;DC:树突状细胞;HER2:人表皮生长因子受体2;Th1:辅助性T淋巴细胞
表2:抗HER2药物在HER2-low BC中有效性的相关数据
HER2在BC中表达或过度表达的另一个被低估的问题是肿瘤内异质性的临床意义。事实上,根据目前的建议,只要有10%的肿瘤细胞呈环状膜染色,则IHC认为肿瘤为HER2阳性;而当肿瘤的扩增细胞总数占总肿瘤细胞总数的10%时,ISH检测就认为肿瘤为HER2阳性。
ADC的出现突显了HER2瘤内异质性对反应的可能影响。现有的新辅助治疗临床研究数据显示,与接受化疗加双靶抗HER2治疗的患者相比,接受T-DM1和帕妥珠单抗治疗的患者在术前实现病理完全缓解的可能性较小,局部进展的风险更高。这些数据表明,在没有全身化疗的情况下,T-DM1的旁路杀伤效应可能不足以根除具有HER2异质性的肿瘤。由此推论,当ADC药物临床普及时,检查报告将必须详细注明过表达或扩增肿瘤细胞的实际百分比,以便为抗HER2治疗的选择提供信息。
(4)HER2基因突变肿瘤的靶向治疗
除了HER2的过度表达,HER2的染色体畸变已经被证明是可检测的。特别是,大约2%的BC存在HER2基因突变,这些突变似乎大量发生在HER2-low肿瘤中。
来那替尼在HER2基因突变、无基因扩增、经过治疗的转移性乳腺癌(MBC)患者中进行了测试,发现单药治疗和与氟维司群联合治疗均显示出获益。鉴于这些令人鼓舞的结果,在此背景下已经启动了其他抗HER2酪氨酸激酶抑制剂的研究,包括poziotinib(NCT02544997)和吡咯替尼(NCT03412383)。此外,ADC在HER2突变的其他瘤种中显示出潜在的活性,也为它们在乳腺癌中的研究带来依据。
总体而言,HER2基因的突变似乎是BC的一个可操作靶点,抗HER2新药的研究应该覆盖到这一亚群的患者。
四、HER2-low BC中抗HER2药物的发展
(1)单克隆抗体(mAb)
抗HER2 mAb包括结合HER2各个结构域的抗体。虽然曲妥珠单抗在HER2-low BC中没有作用,但新的抗HER2单抗已经在HER2-low细胞系的临床前模型中显示出了抗癌活性,推动了这种策略的进一步临床发展。帕妥珠单抗在HER2-low MBC患者中活性有限。在一项II期临床试验中,对HER2-low经过治疗的MBC患者进行了帕妥珠单抗的单药治疗,78名患者中只有2名对治疗有反应。一项Ib期试验在HER3表达、HER2-low MBC的患者中应用了紫杉醇、HER3单抗lumretuzumab和帕妥珠单抗联合方案,但由于不可接受的毒性导致该研究中止。
Margetuximab在I期临床试验中测试了IHC(评分2+/3+) HER2过表达的多发性实体瘤患者,包含40%的乳腺癌患者。这项试验招募了23名HER2-low BC的患者,但在这一亚组中没有看到明显的获益。在HER2-low BC中测试margetuximab的第二阶段试验(NCT01828021) 刚刚完成招募,结果正在等待。值得注意的是,SOPHIA III期临床试验的结果表明,根据纳入HER2+ BC患者的CD16A多态性,该化合物具有不同的活性,这体现了宿主自身因素在HER2靶向治疗中的潜在相关性。
(2)ADC
ADC是与强效细胞毒剂共价结合的单抗,旨在将靶向治疗的选择性和化疗的细胞毒性结合在一起。ADC由三个主要元件组成:单抗(载体)、细胞毒剂(有效载荷)和合成连接剂。每种抗体携带的有效载荷分子数被定义为药物抗体比(DAR),这是一个平衡有效性和安全性的关键特征。虽然较低的DAR意味着效力降低,但较高的DAR值会影响结构、稳定性和抗原结合能力。
T-DM1由曲妥珠单抗和DM1组成,通过不可切割的接头连接,每个抗体的DAR为3.5个分子。一些回顾性证据表明,在HER2-low BC患者中,该化合物的活性有限。HER2+ BC关于T-DM1的两个II期临床试验(4258G和4374G试验) 中进行了探索性分析,病理检测标准修订后分出了一组HER2-low肿瘤的队列。相较之下,HER2+ BC的客观缓解率(ORR)显著更高(在4258g试验中为33.8% vs 4.8%;在4374g试验中为41.3% vs 20.0%),无进展生存期(PFS)也更长(4258g试验中为8.2个月 vs 2.6个月;4374g试验中为7.3个 vs 2.8个月)。在其他T-DM1试验中也进行了亚组分析,证实HER2-low BC的获益较小。
相较于这些令人失望的结果,新的ADC在HER2-low BC的应用中显示出令人鼓舞的表现。
Trastuzumab deruxtecan(DS-8201a)是一种针对HER2的单克隆抗体,通过酶切链与拓扑异构酶I抑制剂DXd偶联,每个抗体的DAR为8个分子。基于II期 Destination-Breast 01试验结果,该化合物于2020年初获得美国食品药品监督管理局(FDA)批准,用于经过治疗的HER2阳性MBC患者。
该药物I期试验中(NCT02564900) 也对HER2-low BC患者进行了测试。截至2019年2月,54名患者达到了研究终点。ORR为37%,疾病控制率为87%,中位PFS为11.1个月,中位缓解时间为10.4个月。所有亚组均观察到了疗效,包括HR阴性和HER2 IHC评分1+的乳腺癌。
整个研究人群的安全性数据显示,最常观察到的不良事件(AE)是胃肠道和血液学毒性,可能与药物的化疗成分有关。不过,有3例肺炎死亡个案。对此,Destination-Breast 01试验报告中也描述了这种AE,并在对7项测试DS-8201a的研究进行的汇总分析中进一步描述了这些AE,发现肺炎的发病率为9.9%(66/665),更高的药物剂量以及日本血统患者被确定为潜在的高危因素。
在HER2-low BC中测试DS-8201a的III期临床试验正在进行中,同时还有两项Ib期试验与纳武利尤单抗或帕博利珠单抗联合使用。
曲妥珠单抗多卡马嗪(SYD985)是一种针对HER2的ADC,通过可切割接头将曲妥珠单抗偶联到有效载荷双卡霉素(vc-Seco-Duba)上,DAR为2.8。该化合物在包括HR+、三阴性和HER2-low MBC的I期试验中进行了测试(NCT02277717)。
截至2018年7月,49名患者可进行疗效分析评估。在HR+和TNBC队列中,观察到的ORR分别为28%和40%,两个亚组的中位PFS相似(分别为4.1个月和4.9个月)。
在剂量递增阶段发生了1例肺炎死亡,在总人群中出现了另外4例不同级别的肺炎病例。在剂量扩展阶段,1.2 mg/kg的SYD985耐受适度:35%的患者报告有3级和4级不良反应,主要是中性粒细胞减少、疲劳和结膜炎。任意级别的眼部毒性是常见的:71%的患者出现结膜炎、干眼、流泪和/或角膜炎。
在这项研究中观察到较好的结果之后,启动了III期临床试验(TULIP试验;NCT03262935),不过试验仅入组HER2+的乳腺癌。
(3)疫苗
癌症疫苗旨在通过增强对肿瘤相关抗原的免疫反应来预防或治疗肿瘤。在乳腺癌的背景下,疫苗免疫治疗的研究主要是为了改善早期患者的预后。考虑到大多数BC的HER2表达水平与正常组织相比显著升高,我们在HER2+和HER2-low BC中开发并测试了抗HER2疫苗。
NeliPepimut-S疫苗由HER2衍生肽E75和免疫佐剂粒细胞巨噬细胞集落刺激因子(GM-CSF)组成。该疫苗将HLA-A2/A3分子与抗原提呈细胞结合,然后使细胞毒性T淋巴细胞对表达HER2的细胞致敏。
这项大型的III期临床试验随机分配了758名HER2-Low BC患者,接受GM-CSF联合或不联合NeliPepimut-S作为辅助治疗。结果显示,在无病生存(DFS)率方面两组没有显著差异。
然而,临床前数据显示该疫苗和曲妥珠单抗之间出现了协同作用,促使我们开始了一项随机的IIb期试验,对HER2-low早期乳腺癌的高危患者使用这种联合治疗。
试验中,275名患者被随机分配到曲妥珠单抗+GM-CSF联合或不联合NeliPepimut-S的辅助治疗组,中位随访25.7个月后,DFS有增高的趋势(89.8% vs 83.8%;HR,0.62;P=.18)。探索性分析显示,HER2-low TNBC亚组(n=97)有潜在获益,疫苗组24个月DFS率为92.6%,对照组为70.2%(HR 0.26,P=0.013)。耐受性来说,这两种方案似乎都很好,大多数不良反应为轻微的皮肤反应和疲乏。其他抗HER2疫苗(如GP2、AE37)已经在相同的条件下进行了测试;结果列在表2中。
(4)双特异性抗体
双特异性抗体(BsAb)是针对两个不同表位的单克隆抗体,能够抑制多条致癌途径,迫使肿瘤和免疫细胞连接,和/或将有效载荷运送到肿瘤微环境中。几种抗HER2的BsAb正在开发中,尽管只有一小部分在HER2-Low BC中进行了测试。
ZW25是一种针对HER2结构域2和4的bsAb,体内研究显示其在HER2-low BC模型中具有抗肿瘤活性。一项I期临床试验(NCT02892123)正在评估ZW25在HER2表达的癌症中的应用,包括HER2-Low BC(IHC2+,ISH阴性)的队列。这项试验的初步分析显示,HER2+ BC患者的ORR为46%,HER2-low BC的疗效数据尚待公布。值得注意的是,通过将Auristatin有效载荷连接到ZW25,获得了新的化合物ZW49,可以结合bsAbs和ADC的双重作用机制。
该抗体在HER2-low BC中显示出令人鼓舞的临床前活性,目前正在进行I期试验,尽管试验仅限于HER2+ BC(CT03821233)。其他抗HER2 bsAb(例如,ertomaxomab,GBR130288) 已经在类似的条件下进行了测试;结果列在表2中。
五、平衡抗HER2新药的活性和毒性
尽管HER2-low BC的药物开发前景清晰可见,但在III期对照试验中,ADC是唯一正在广泛开发的化合物。如果抗HER2靶向治疗非扩增性乳腺癌的临床益处得到证实,可以预测我们的HER2靶向治疗模式将发生转变,原因如下:
(1)独立于癌基因依赖:临床前证据表明,新的ADC的活性可能与抑制HER2通路无关,而与通过“特洛伊木马”药理学机制传递细胞毒剂有关。因此,无论生物细胞对HER2途径的依赖程度如何,它们都能发挥活性。
(2)更高的DAR:与T-DM1相似,大多数新型ADC使用曲妥珠单抗作为细胞毒药物的载体;然而,工艺的进化使更多的细胞毒分子能够连接到每个抗HER2抗体上,从而增强了新型ADC的细胞毒力,这也许可以解释T-DM1和新一代ADC在HER2-low BC中的不同活性。
(3)可裂解接头:新型ADC通过溶酶体酶切接头结合,在肿瘤微环境和肿瘤细胞内胞囊中高表达。可切割接头有助于杀死旁路HER2+细胞,也可以杀死邻近的非抗原表达细胞,潜在地克服了HER2表达在肿瘤内的异质性。T-DM1是用不可切割接头开发的,因此可能解释了这种情况下活性较低的原因。
(4)有效载荷的作用机制:与使用微管组装抑制剂作为有效载荷的T-DM1不同,新型的ADC与直接DNA合成阻断药如烷化剂和拓扑异构酶抑制剂偶联,在乳腺癌克隆中发挥更强的细胞毒活性。
重要的是,从新型ADC在HER2-low BC中起效的原理中也可能解释它所表现出的毒性。事实上,在DS-8201a和SYD985的I期和II期试验中观察到的不良反应谱与该药的化疗成分不良反应谱相似,由于连接蛋白可分裂以及高的DAR,化疗成分可以在血液中释放。两个试验中常见的不良反应是骨髓抑制、脱发、口腔炎和消化道毒性。然而,在这些试验中也观察到了一些特殊的不良反应,包括眼部毒性和潜在的重症肺炎。虽然这些毒性的潜在机制仍不清楚,但已经提出了各种可能的风险因素,应该提高及时识别严重事件的意识,并酌情停药。
综上所述,在没有基因扩增的情况下,高达55%的乳腺癌仍然表达低水平的HER2;目前,它们在临床上被归类为Luminal型或TNBC。虽然各种抗HER2药物被批准用于治疗HER2阳性的BC,但没有一种药物对HER2-low BC有效。
一些ADC的初步研究显示,某些针对HER2的策略在HER2-low BC人群中可能是有效的。尽管如此,这些新药的出现带来了一些挑战,尤其是在使用IHC等半定量检测手法分析时,HER2-low本身的定义就存在很大问题。事实上,HER2 IHC检测0分和1+之间的生物学差异是未知的,在某些情况下,评分可能并不准确。然而,乳腺癌IHC评分为0的患者一开始就被排除在大多数针对HER2-low BC的试验之外;因此,新的抗HER2药物在这一人群中的活性在很大程度上是未知的。
此外,目前的HER2检测方法(即IHC和ISH) 不足以识别HER2低表达或通路激活水平低的肿瘤,但这些肿瘤可能会受益于其中一些新的治疗方法。因此,新的检测手段如定量免疫分析和RT-qPCR可能会使这些潜在的HER2-low BC被检测出来,新开展的临床试验应该尽量收集足够数量的肿瘤样本,以便随后利用新开发的检测手段重新评估HER2状态。最后,需要从生物学角度更好的理解一些新药所观察到的毒性。
既然临床试验证实了在早期研究中使用新型抗HER2药物在HER2-low BC中观察到获益,那么可能需要改变对HER2状态的临床解读,包括重新评估现有的HER2检测方法,并明确对HER2状态描述。目前非此即彼的区分HER2+和HER2-虽然好用,但可能不够细致。一些新的研究结果也可能有助于将针对HER2通路的靶向治疗扩大到乳腺癌以外的其他瘤种,一些特定表达较低水平HER2的肿瘤。对于HER2低表达但存在基因激活突变的肿瘤,有待于进一步研究其对新药的反应。
参考文献:
Tarantino P, Hamilton E, Tolaney SM, et al. HER2-Low Breast Cancer: Pathological and Clinical Landscape. J Clin Oncol. 2020;38(17):1951-1962. doi:10.1200/JCO.19.02488
本文首发:医学界肿瘤频道
本文作者:祝旭龙 陕西省人民医院
原标题:《55%乳腺癌患者存在HER2低表达!JCO发表权威综述》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




