- +1
经历细胞因子风暴的COVID-19患者或不产生记忆B细胞
原创 Cell Press CellPress细胞科学 收录于话题#Cell Press新冠资源中心55个
2020年1月31日,Cell Press新型冠状病毒资源中心正式开放。您可以在该资源中心页面上查找到COVID-19相关论文的投稿政策,以及Cell Press旗下期刊已发表的有关疫情和病毒的论文。网站正在不断更新中,所有内容都可以免费阅读,。
最新在中心上线的发表在Cell Press细胞出版社旗下期刊Cell上,名为"Loss of Bcl-6-expressing T follicular helper cells and germinal centers in COVID-19"的研究论文。来自哈佛大学医学院的近期研究表明:一些高水平的细胞因子可能也会阻止感染者形成长期免疫,因为通过观察,他们都没有产生记忆B细胞,而这些正是形成持久免疫反应所必须的。
Cell Press细胞出版社微信公众号对该论文进行了解读,旨在与广大科研人员深入分享该文以及一些未来的展望,点击“阅读原文”或识别下图二维码阅读英文原文。
*以下中文内容仅供参考,请以英文原文为准。
摘要
如其他人类冠状病毒流行一样,COVID-19引发的体液免疫应答通常持久性有限。为了探究潜在的病因,我们检查了急性SARS-CoV-2感染死亡患者胸部淋巴结和脾脏,并观察到没有生发中心,Bcl-6+生发中心B细胞显著减少,但AID+ B细胞保留了下来。生发中心的缺失与Bcl-6+ TFH细胞分化早期的特异性阻断、T-bet+ TH1细胞的增加,以及滤泡细胞外TNF-α的异常积累有关。并行的外周血研究显示,重症COVID-19的特征包括过渡性和滤泡性B细胞的缺失,以及SARS-CoV-2特异性的“疾病相关”B细胞群的积累。该研究发现了在COVID-19发病早期的Bcl-6+ TFH细胞生成缺陷和体液免疫诱导的失调,从而为冠状病毒感染中抗体应答反应的持久性有限提供了机制性解释,同时表明通过自然感染实现群体免疫可能十分困难。
适应性免疫起源于次级淋巴器官,受到先天免疫系统初始激活所产生的环境的影响。对COVID-19诱导体液免疫的纵向研究以及在恢复期受试者中进行的研究表明,体液免疫往往是短暂的,并且大多数SARS-CoV-2抗体的体细胞超突变有限(Brouwer et al., 2020; Long et al., 2020; Robbiani et al., 2020)。因此,要了解在重症COVID-19中适应性免疫系统的调控方式,就需要关注感染急性期的次级淋巴器官,但迄今为止大多数研究主要集中于外周血样本。
在COVID-19患者中,病情相对较重的患者抗体反应表现出强度更大和持久性更强的特征(Ju et al., 2020; Amanat et al., 2020),但往往范围有限(Robbiani et al., 2020)且似乎缺乏持久性(Long et al., 2020)。这可能类似于SARS和MERS,在患病群体中仅有少部分个体具有持久的体液反应,在大部分感染者中体液反应通常不持久(Mo et al., 2006; Zumla et al., 2015)。
如果我们能更充分地理解体液免疫系统的组成变化,尤其是在次级淋巴器官中的变化,那么我们或许就能解释为什么冠状病毒的自然感染常常不能提供持久的免疫力。此前从未有研究报道过SARS或MERS患者引流淋巴结和脾脏中B淋巴细胞和T淋巴细胞的粒度分析,因此淋巴细胞减少症和这些疾病中普遍缺乏抗体反应持久性的基础成了悬而未决的问题。
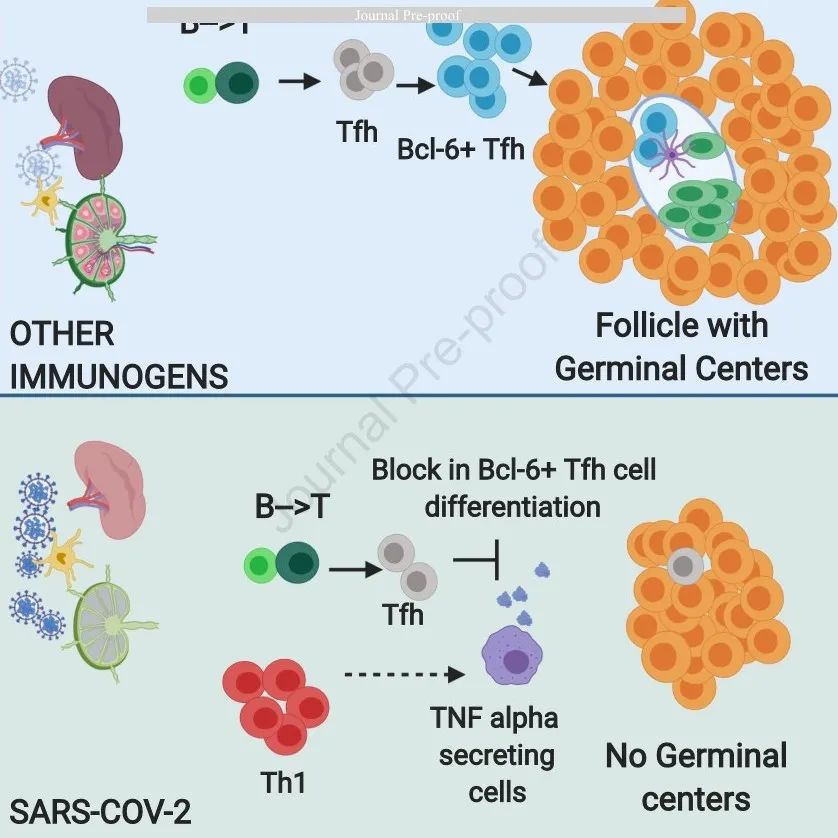
由于COVID-19疾病对肺部的影响最大,我们从疾病临床表现不同的患者发病之时开始,使用多色免疫荧光方法、多光谱成像和细胞间相互作用分析对胸腔淋巴结进行分析,以检查淋巴样结构和淋巴细胞群。考虑到部分研究观察到了这种疾病的发作往往伴随着病毒血症(Zheng et al., 2020; Lescure et al., 2020),我们还研究了急性和晚期疾病的脾脏,并在一个单独的队列中对外周血样本进行检查,以补充这些研究,而且使用该队列也可以研究疾病恢复期的特征。我们发现,在COVID-19疾病早期明显缺乏淋巴结、脾脏的生发中心结构和表达Bcl-6的B细胞,而且Bcl-6+ T滤泡辅助细胞的生成和分化存在缺陷,SARS-CoV-2特异性体液免疫出现了功能异常。我们的研究为机体免疫力持久性的有限和自然感染该病毒后低水平的体细胞突变提供了机制性解释。
讨论
次级淋巴器官的生发中心是持久的B细胞记忆和最高亲和力的病原体特异性抗体的主要来源。了解生发中心的结构有利于选择长效的高亲和力B细胞(Victora and Nussenzweig, 2012)。对于某些传染性疾病,如果这种反应的持续时间超过几十年,那么当很大一部分人口被感染时,就能发挥群体免疫效应。然而,在大部分个体中,针对SARS-CoV-2的抗体反应能维持的时间较短,似乎也与其他人类冠状病毒感染的情况相似(Long et al., 2020)。使用一系列分析方法,我们发现了COVID-19早期体液免疫诱导失调的证据,包括在感染的最初阶段生发中心的明显缺失、Bcl6+ TFH细胞生成缺陷,以及淋巴TNF-α产生异常。
在COVID-19重症患者中,释放量最大的一种细胞因子是肿瘤坏死因子(TNF)。由于COVID-19是一种新型传染病,在开始研究时,还没有用于研究该病毒感染的动物模型。但根据之前的研究中,我们获得了一些信息,这些研究涉及诱发细胞因子风暴综合征的其他感染的小鼠模型——一种疟疾模型和一种失去生发中心的细菌感染模型。因此,我们在小鼠模型系统中进行了组织机理研究。
在小鼠中进行的研究表明,在原生动物、细菌和病毒感染的背景下,细胞因子和趋化因子分泌水平显著提高可以导致生发中心的缺失。在患有重度疟疾的小鼠模型中,生发中心反应存在缺陷,而且这与T滤泡辅助细胞的分化缺陷有关(Ryg-Cornejo et al., 2016)。在感染的小鼠中,TNF似乎阻止了生发中心的形成,而阻断TNF-α 能够逆转T滤泡辅助细胞的分化缺陷。在之前的细胞因子风暴模型中,当给小鼠注射抗体以阻断TNF或删除TNF基因时,生发中心就能够形成。
当研究死于这种疾病的病人的淋巴结时,我们发现这些器官中存在高水平的TNF。于是我们得出结论,TNF可能也阻止了COVID-19患者形成生发中心。
“一些研究已经表明,在SARS感染时也会出现这种缺乏生发中心的情况。”Pillai表示,“我们甚至认为这种现象会发生在一些埃博拉病毒感染者身上,所以并不奇怪。”
我们还研究了处于COVID-19不同阶段的感染者的血液和淋巴组织,发现尽管没有形成生发中心,B细胞仍然被激活并出现在血液中,这将使患者产生了一些中和抗体。“这是一种免疫反应。”Padera说,“它只是不来自生发中心。”
在COVID-19中,感染者的次级淋巴器官中不存在Bcl-6+ T滤泡辅助细胞,因此也就未形成生发中心,这解释了在针对许多重度病毒感染的尸检中发现的现象。但是COVID-19同时诱导产生了许多其他的细胞因子,这些细胞因子可能与我们在这里描述的某些表型结果有关。例如,IL-6具有多向性,但它也可以抑制淋巴生成并诱导骨髓生成(Maeda et al., 2009),因此IL-6也可能导致我们在此观察到的B淋巴细胞减少。
这些发现还为近期报道的非持久性体液免疫反应、体液免疫受损,以及恢复期COVID-19患者抗体的体细胞超突变水平较低提供了机制基础(Long et al., 2020; Robbiani et al., 2020;Brouwer et al., 2020)。在发病时次级淋巴器官中细胞因子环境的改变可能反映了整个疾病谱的连续性。尽管在COVID-19中确实发生了依赖于T细胞的B细胞活化、类别转换和某些低水平的体细胞超突变,但生发中心的反应并未达到理想水平,或者完全没有形成。
“没有生发中心,抗原就没有长期记忆。”Pillai补充说。他指出,对其他能引起感冒的冠状病毒的研究表明,一个人在一年内可能感染同一种冠状病毒三到四次。
但是,生发中心的形成也很可能会在适当的时间内以抗体类别转换的方式反映出来,这种反应持久性较弱,类似于在SARS和MERS中观察到的反应。这些发现与如SARS-CoV-2自然感染后的群体免疫和免疫护照(向COVID-19病愈者提供的一种文件)等概念有关,其着重强调了实现可预防COVID-19的疫苗接种方法的必要性和相关性。
结论
综上所述,在重症COVID-19患者中,即使在机体病毒载量极高且肺中存在大量病毒时,也没有明显的生发中心,而且生发中心B细胞显著减少,但表达AID的B细胞保留了下来。因此,尽管T细胞介导的B细胞激活十分强大,但未形成生发中心。非生发中心型B细胞反应的强大激活不会产生长效的记忆免疫应答或高亲和力B细胞。Bcl-6+ T滤泡辅助细胞分化的巨大失败可能是生发中心缺失的潜在机制的最佳解释,这可能是由于TH1细胞驱动的滤泡外细胞因子环境发生了急剧变化,以及TNF-α在淋巴器官中的局部异常生成所致。我们相信这些发现与一系列诱导产生细胞因子风暴的人类病毒和非病毒性疾病有关。如果希望更深入地理解这些现象,就需要对淋巴结和脾脏的结构和组成进行以功能为重点的分析。我们预测,在未来针对MERS、H1N1、埃博拉病毒、马尔堡病毒和其他病毒性疾病的研究中,与本研究所述相似的一种广泛的通用机制基础将得到阐明。而且我们相信,尽管本研究提出了这些发现,我们仍然可以研制出一种不会导致高水平的细胞因子释放的成功疫苗。

原文刊载于CellPress期刊Cell上
▌论文标题:
Loss of Bcl-6-Expressing T Follicular Helper Cells and Germinal Centers in COVID-19
▌论文网址:
https://www.cell.com/cell/fulltext/S0092-8674(20)31067-9
▌DOI:
https://doi.org/10.1016/j.cell.2020.08.025
中文审校:Cell科学编辑 杨扬
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




