- +1
抗新冠病毒的热稳定mRNA疫苗 | CellPress论文速递
原创 Cell Press CellPress细胞科学 来自专辑Cell Press新冠资源中心
Life science
2020年1月31日,Cell Press新型冠状病毒资源中心正式开放。您可以在该资源中心页面上查找到COVID-19相关论文的投稿政策,以及Cell Press旗下期刊已发表的有关疫情和病毒的论文。网站正在不断更新中,所有内容都可以免费阅读,。
最新在中心上线的发表在Cell Press细胞出版社旗下期刊Cell上,名为"A thermostable mRNA vaccine against COVID-19"的研究论文,由秦成峰研究员、英博博士以及王佑春研究员共同领导的一支团队,开发出了一款新型的mRNA新冠疫苗。在小鼠和非人灵长类动物模型中,这种疫苗能够激发免疫反应,诱导产生中和抗体。值得一提的是,这款新型疫苗采用了先进的制剂技术,在室温下能够存放至少一周而依旧保持稳定。对于疫苗产品而言,有望大大减少运输时的冷链要求。
Cell Press细胞出版社微信公众号对该论文进行了深度解读,旨在与广大科研人员分享该研究成果以及一些未来的展望,点击“阅读原文”或识别下图二维码阅读英文原文。
*以下中文内容仅供参考,请以英文原文为准。
长按图片识别二维码阅读原文
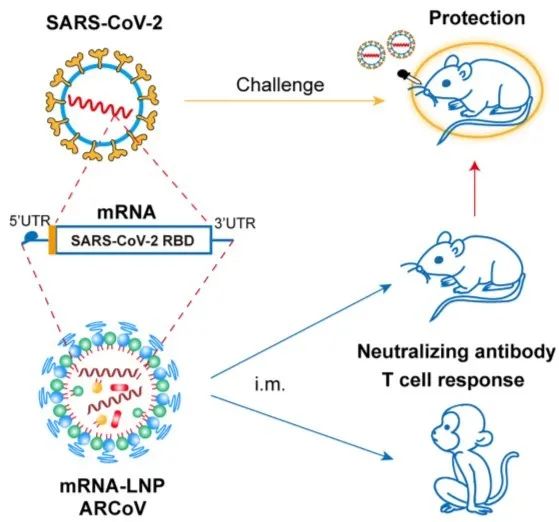
由于新冠病毒大流行仍在持续蔓延,迫切需要针对SARS-CoV-2的疫苗。在所有方法中,基于信使RNA(mRNA)的疫苗是一种可快速制备的通用平台,可以快速地应对这一挑战。在此,我们开发了一种脂质纳米颗粒包裹的mRNA(mRNA-LNP)作为候选疫苗(名为ARCoV),可编码SARS-CoV-2的受体结合域(RBD)。肌内注射ARCoV mRNA-LNP可在小鼠和非人类灵长类动物中诱导产生抗SARS-CoV-2的强大中和抗体反应,以及Th1细胞相关的细胞免疫应答。对小鼠进行ARCoV的两次注射可完全抵御SARS-CoV-2小鼠适应毒株的攻击。另外,ARCoV以液体制剂生产,可以在室温下保存至少一周。这种新型抗新冠病毒mRNA疫苗ARCoV目前正在I期临床试验中进行评估。
简介
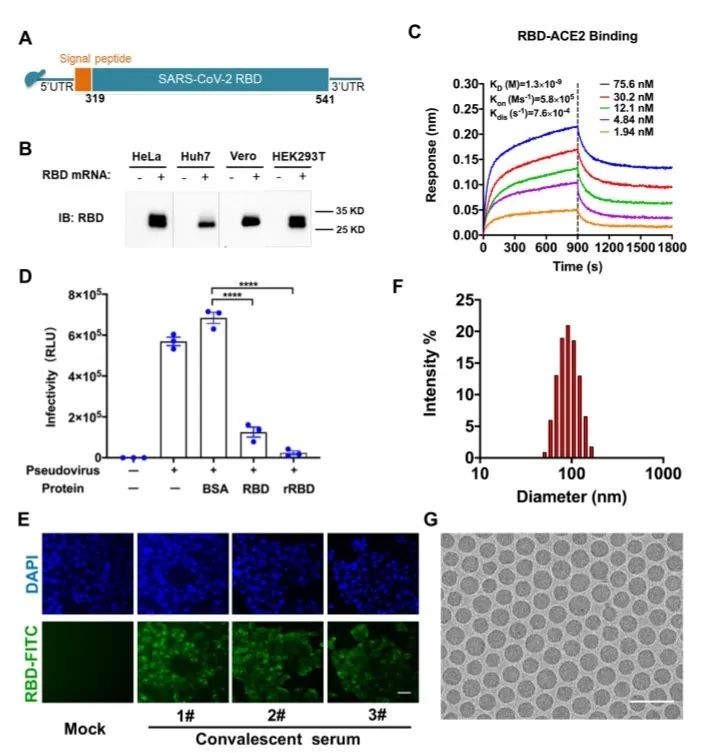
近期研究发现,基于信使RNA(mRNA)的疗法是治疗传染性疾病和癌症的有效平台(Jackson et al., 2020; Mascola and Fauci, 2020)。在过去的几年中,随着mRNA修饰和递送工具的技术性突破(Ickenstein and Garidel, 2019; Maruggi et al., 2019; Pardi et al., 2020),针对mRNA疫苗的基础医学和临床医学研究发展非常迅速。临床前研究表明,mRNA疫苗可针对多种病原体诱导有效且广泛的免疫反应,其安全性亦在可接受的范围之内(Maruggi et al., 2019)。迄今为止,已在许多国家进行了针对多种病毒性疾病的mRNA疫苗临床试验(Alameh et al., 2020)。mRNA疫苗可以迅速设计并在短时间内大规模生产,对预防SARS-CoV-2而言极具吸引力。生产mRNA不需要繁复漫长的细胞培养和纯化过程,也简化了传统病毒疫苗生产的严格生物安全措施。一旦病毒抗原序列得到确认,即可在数周内快速设计和生产临床规模的mRNA疫苗。在世界范围内,有几种抗新冠病毒的mRNA候选疫苗目前在研,这进一步证明了mRNA疫苗平台的巨大潜力。然而,这些处于临床阶段的mRNA疫苗尚未在动物模型中得到评估。抗新冠病毒的mRNA疫苗的作用机制尚不清楚,其有效性仍有待证实(Jiang, 2020)。另外,脂质纳米颗粒(LNP)是最具吸引力且最常用的mRNA递送工具之一(Ickenstein and Garide,2019)。因此,我们开发了一种经过修饰的mRNA疫苗平台,通过LNP进行封装用于体内递送。如图1A所示,我们选择了SARS-CoV-2的受体结合域(RBD)(aa 319-541)作为mRNA编码序列的目标抗原(图S1)。在本研究中,我们证明了抗新冠病毒的新型mRNA候选疫苗(称为ARCoV)在动物模型中的免疫原性和保护作用,这支持了疫苗在人类中的进一步临床开发。
讨论
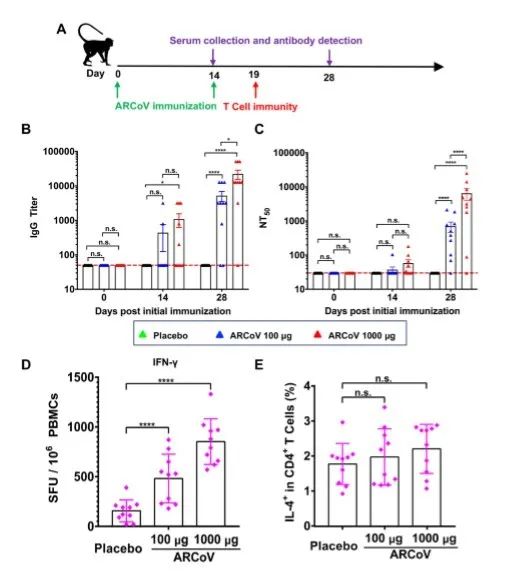
在本研究中,我们报道了新型抗新冠病毒mRNA候选疫苗在各种动物模型中的免疫原性和功效。对小鼠和非人灵长类动物进行ARCoV单剂或两剂免疫可引起强烈的抗体反应和T细胞反应。注射低剂量(100μg)ARCoV的非人类灵长类动物血清中的NT50与20名COVID-19患者恢复期血清中的NT50相当,而注射高剂量(1000μg)ARCoV则能诱导产生与恢复期血清相比更高滴度的中和抗体(Ni et al., 2020)。据报道,注射两剂或三剂SARS-CoV-2灭活病毒疫苗可以诱导产生~1/50水平的中和抗体,从而为猕猴提供抗SARS-CoV-2的全面保护(Gao et al., 2020)。最近的一项研究显示,使用DNA候选疫苗对猕猴进行两次注射免疫后,可刺激产生的中和抗体滴度在~1/70和~1/170之间(Yu et al, 2020)。在上述研究中,所有实验动物在受到病毒攻击后均产生了记忆抗体应答反应,表明该疫苗可能未进行灭菌,这也符合相对较低的中和抗体滴度结果。在我们的研究中,ARCoV单剂量免疫诱导产生了记忆抗体应答反应,而接受ARCoV两次注射免疫的动物在受到攻击后并未显示出中和抗体滴度的增强,这表明小鼠中已经产生了无菌免疫(图6A)。
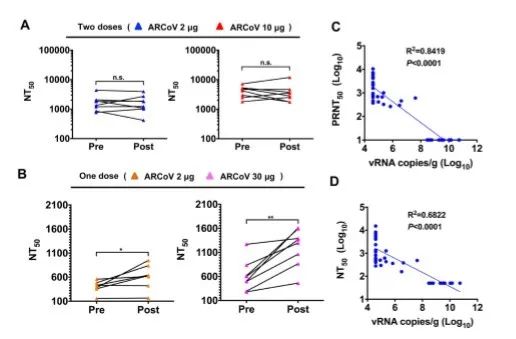
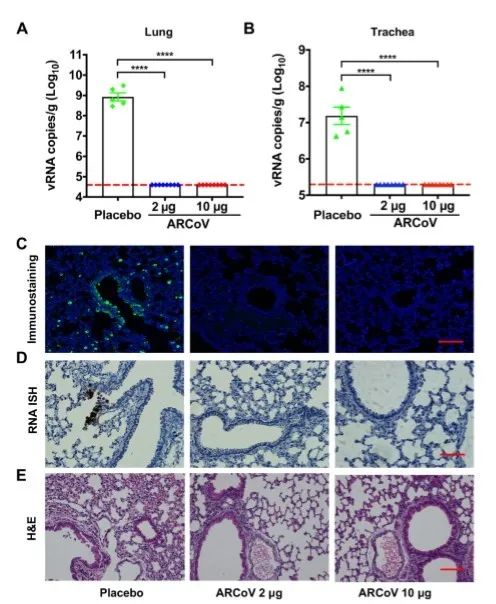
使用适应小鼠的MASCp6新冠病毒株进行的进一步攻毒试验(Gu et al., 2020)表明,ARCoV的两次注射免疫完全阻断了肺部和气管中的病毒复制,而且防止了小鼠出现肺部病理(图5)。尽管该疫苗仍然需要在临床条件下进一步验证,但我们的研究结果表明,小鼠中和抗体滴度水平与抵御SARS-CoV-2攻击的保护作用密切相关。考虑到非人类灵长类动物资源有限,以及SARS-CoV-2攻毒实验对生物安全设施的严格要求,小鼠模型中的这种保护关联的发现为疫苗效力测试的提供了简单而有用的基准,这将极大地促进和加速新冠病毒疫苗的研发。受限于生物安全设施,目前我们无法获得疫苗对非人类灵长类动物的保护效力数据。然而,通过比较接种新冠病毒灭活疫苗或DNA 候选疫苗在猕猴中诱导的中和抗体水平(Gao et al., 2020; Yu et al., 2020),大多数接受ARCoV两次剂量注射的猕猴都能产生保护性免疫,而且ARCoV在雄性和雌性猕猴中都具有高度的免疫原性。
出于安全考虑,理想的COVID-19疫苗应避免诱导非中和抗体和Th2细胞相关的免疫反应(Graham, 2020)。不同于Moderna的mRNA-1273疫苗(Corbett et al., 2020),我们的ARCoV疫苗选择RBD作为抗原靶点。与整个刺突蛋白相比,RBD抗原诱导产生的非中和抗体更少,从而降低了SARS-CoV-2感染的潜在ADE风险。
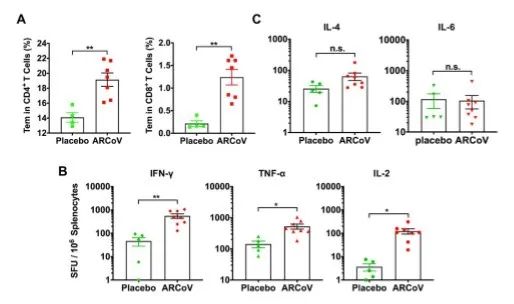
正如预期,我们的mRNA疫苗在小鼠和猕猴中诱导了靶向SARS-CoV-2 RBD的Th1相关性T细胞免疫应答(图4和图7)。部分研究测试了基于DNA和腺病毒载体的COVID-19候选疫苗,也取得了相似的结果(van Doremalen et al., 2020; Yu et al., 2020; Zhu et al., 2020a)。在本研究的小鼠攻毒试验中,我们并未在所有接种疫苗的动物中观察到病毒复制或临床疾病的增强,甚至是仅接受单剂ARCoV疫苗的动物也是如此。
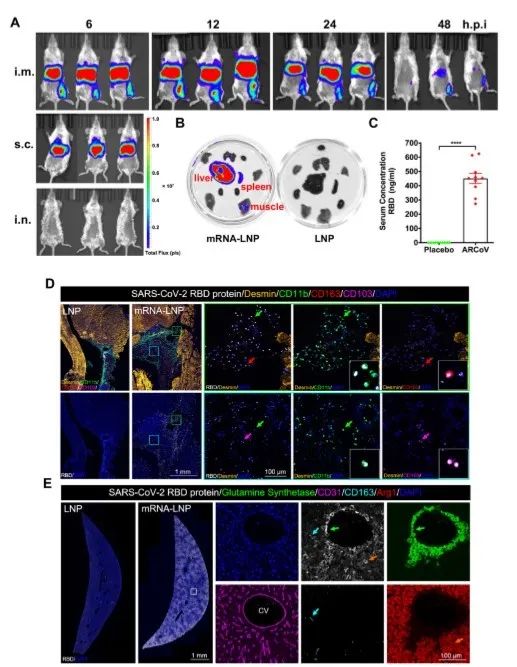
我们还表征了本研究所用的mRNA-LNP制剂的体外和体内表达模式。肌内注射该疫苗后,很容易在注射部位的肌肉组织中检测到高水平的蛋白表达,且最主要的表达部位是肝脏(图2A-B),这与其他LNP制剂的结果相似(Bahl et al., 2017; Pardi et al., 2015)。最重要的是,多重免疫共染色试验表明,在接种了ARCoV的小鼠的肌肉、肝脏和淋巴结中,其多种抗原呈递细胞(包括单核细胞、巨噬细胞和树突状细胞)中出现了SARS-CoV-2 RBD的强表达(图2D-E)。
迄今为止,对mRNA-LNP疫苗的安全性和稳定性的报道十分有限(Jackson et al., 2020; Maruggi et al., 2019; Stitz et al., 2017)。我们针对食蟹猴的试验结果表明,100μg的ARCoV足以诱导高水平的中和抗体,而且注射1000μg的ARCoV也不会引起明显的不良反应,这突出了本试验中mRNA-LNP制剂的安全性。然而,从动物向人类推导疫苗的使用剂量仍然是一个巨大的挑战,研究者需要谨慎考虑并衡量疫苗的安全性和效力。来自小鼠和非人类灵长类动物的临床前数据为人类试验中ARCoV的初始剂量提供了关键的参考。
最后,COVID-19疫苗的可及性和可扩展性是在全球范围内加快疫苗递送和大规模免疫的首要挑战,因此,即用型和热稳定型疫苗是我们最希望看到的。我们最终的ARCoV mRNA-LNP疫苗以液体制剂形式生产,无需在注射前解冻或重新配制,并且单剂疫苗已预先填入注射器中,可用于快速地自我给药。稳定性测试结果表明,本制剂可在4°C和25°C的条件下保持体内递送效率至少一周,目前我们也正在评估ARCoV疫苗的长期稳定性。另外,ARCoV可以通过人类最常用的疫苗接种途径(肌内注射)进行管理。因为ARCoV的这些特性,其有望成为具有广泛可用性和全球可及性的COVID-19候选疫苗。
总之,我们描述了一种热稳定型的抗新冠病毒mRNA候选疫苗的制备,并提供了该疫苗在多种动物模型中的免疫原性和效力的一线证据。但是,研究者也表示,ARCoV诱导的中和抗体的持续时间有待确定,而且其他人类冠状病毒感染经验表明,由于抗体反应的减弱,康复患者可能会再次感染。因此需要开展更多的研究,来评估动物模型中的长期免疫应答以及ARCoV对人类的有效性。

原文刊载于CellPress旗下期刊Cell 上
▌论文标题:
A thermostable mRNA vaccine against COVID-19
▌论文网址:
https://www.cell.com/cell/fulltext/S0092-8674(20)30932-6
▌DOI:
https://doi.org/10.1016/j.cell.2020.07.024
中文审校:Cell科学编辑 杨扬
Cell Press冠状病毒资源中心
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




