- +1
照一束光就能控制基因重组,华东师大团队研发光遗传学新工具
自然光下的小鼠与远红光下的小鼠 本文图均为 受访者 供图
继7月10日在Science Advances 上发表远红光调控的分割型split-Cas9基因编辑系统后,7月24日,华东师范大学生命科学学院、华东师范大学医学合成生物学研究中心叶海峰研究员团队在学术期刊Nature Communications上发表最新研究成果——利用光遗传学与合成生物学理念设计开发了一套远红光调控的分割型Cre-loxP重组酶系统(简称FISC系统)。
Cre-loxP重组酶系统是一种位点特异的基因重组技术,可以迅速而有效地实现各种生理环境下的基因定点插入、删除、替换和倒位等操作,在拟南芥、水稻、果蝇、斑马鱼、小鼠等多种高等真核生物体内均被广泛应用。
该研究成果是继远红光控制细胞命运、远红光控制基因编辑之后,又一重要应用,拓宽了光遗传学的应用领域。
传统的Cre-loxP重组酶系统存在早期胚胎致死和长期表达的毒性问题。
为了解决毒性、组织穿透性差等问题,华东师范大学的研究人员以低强度的远红光外部照射作为控制手段(730nm,LED光源),实现了非侵入性、安全有效远程无痕控制。
在课题组多年的研究经验和积累之上,研究团队将Cre重组酶分成CreN59和CreC60两部分,它们在DocS与Coh2蛋白自发相互作用下,重新形成有功能的完整Cre重组酶,进而识别报告基因中loxP位点,切除阻止基因表达的STOP序列,从而启动目的基因表达。而CreC60与DocS融合蛋白,被远红光诱导表达。
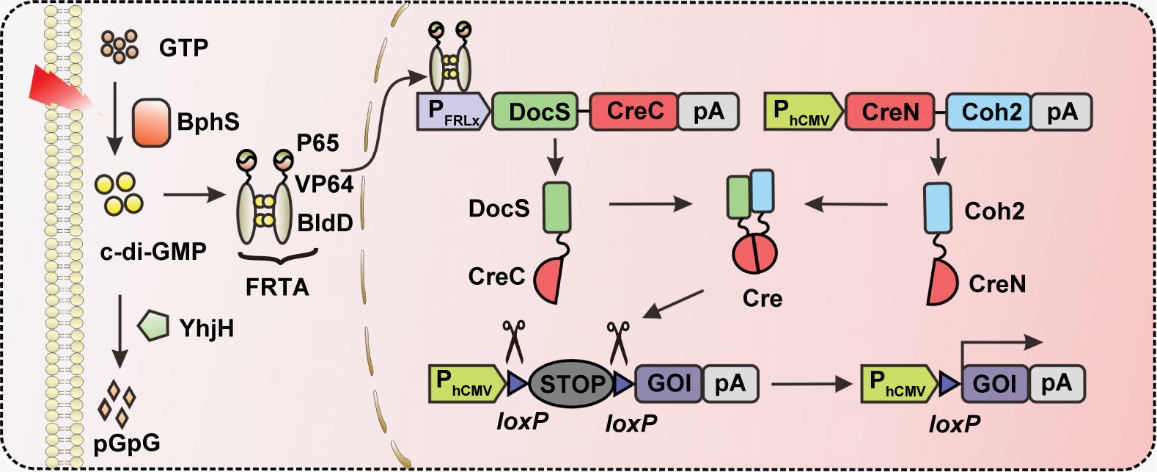
FISC系统工作原理
按照预期设计系统元件后,研究团队人员在人胚胎肾细胞HEK-293中进行测试,发现结果并不理想,在黑暗条件下的背景过高。如何进一步降低本底的泄露至关重要。研究团队人员通过优化不同启动子,不同质粒量,蛋白间连接肽以及不同Cre重组酶作用序列,终于获得了最优版本的FISC系统。
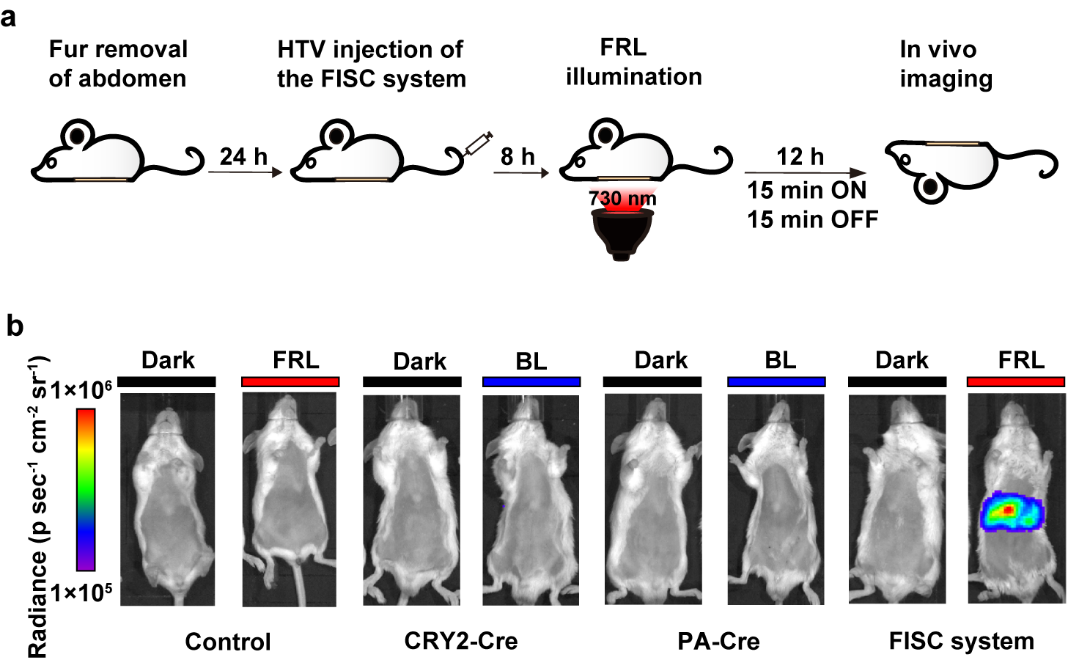
为了将该系统进一步用于临床治疗,研究团队利用AAV病毒将FISC系统递送到转基因报告小鼠体内。通过观察小鼠活体成像和肝脏成像发现,与黑暗组小鼠相比,光照组小鼠的荧光蛋白表达量更高。这充分说明,利用AAV载体,成功实现了FISC系统在小鼠体内的高效DNA重组。
研究人员表示,FISC系统成功在体内外实现了精准可控的基因改造,具有非侵入性、低毒性以及空间特异性。
该论文的通讯作者为华东师范大学生命科学学院叶海峰研究员。2017级博士研究生吴嘉丽、王美艳副研究员和已毕业2018届硕士研究生杨雪平为该研究论文的共同第一作者。
研究团队介绍,本研究是叶海峰课题组在光遗传学应用上的进一步的研究成果。2017年,该课题组开发远红光调控的转基因表达控制系统,并实现了智能手机远程控制细胞释放胰岛素治疗糖尿病的目标。2018年,该课题组在美国科学院院刊PNAS上报道了远红光调控的CRISPR-dCas9内源基因转录激活装置(FACE),可实现表观遗传操控以及诱导干细胞分化为功能性神经细胞。2020年,该课题组在Science Advances 上报道了一个远红光调控的分割型split-Cas9基因编辑系统(FAST),通过对小鼠肿瘤中的致癌基因进行编辑,成果实现了光控抑制肿瘤生长。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




