- +1
运动学习可通过促进少突胶质细胞再生或存活促进神经再髓鞘化
原创 王甲利 山中麻署

既往认为成熟的少突胶质细胞不参与神经的再髓鞘化,但是最近对脱髓鞘损伤的大型动物模型的研究表明,成熟少突胶质细胞可以产生新的髓鞘。此外,神经元活动可以调节朗飞氏结间长度和髓鞘厚度,这意味着成熟少突胶质细胞可以通过神经活动依赖的方式调节髓鞘形成过程。因此,在脱髓鞘损伤后,机体可能存在内源性机制,通过新生和幸存的少突胶质细胞调节髓鞘的修复。
在人类和啮齿动物中,运动学习可通过诱导成熟中枢神经系统中少突胶质细胞前体细胞(OPCs)的增殖和分化(类似于脱髓鞘损伤时的OPC反应)改变白质结构。然而,运动学习对脱髓鞘过程是协同还是拮抗作用并不清楚。个性化行为干预正越来越多地应用于临床脱髓鞘疾病的治疗。人们希望通过优化行为干预的方式和时间使髓鞘重塑的内源性机制同步,以驱动更多的髓鞘再生。
01
前爪触碰训练(forelimb reach training)动态调节少突胶质细胞谱系和髓鞘形成。
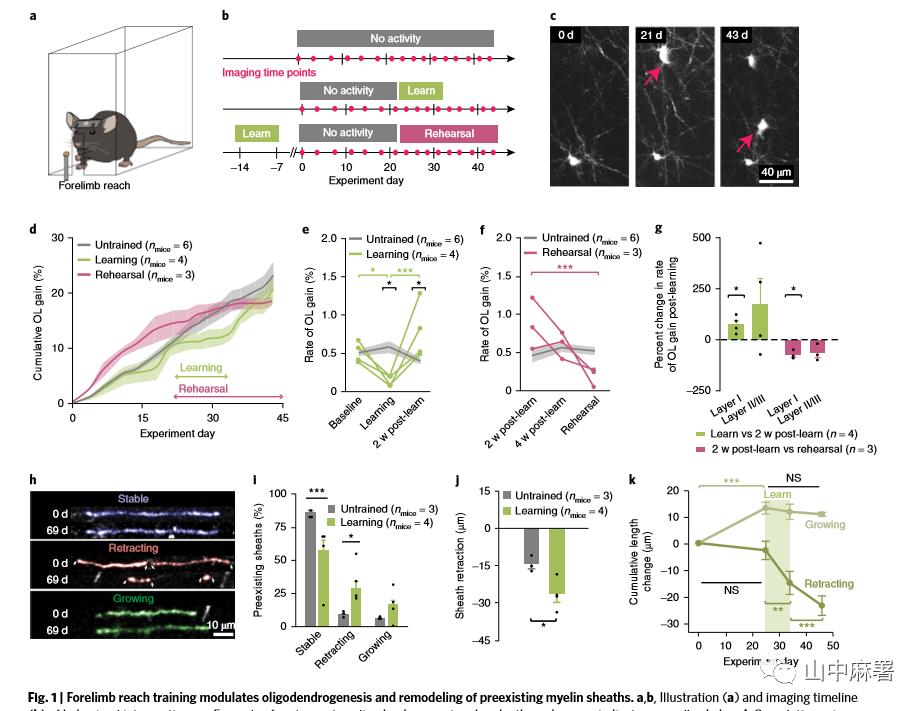
在学习和演练对侧前爪触碰小球(single-pellet contralateral forelimb reach task)的过程中,研究者使用纵向双光子活体成像技术对控制前爪活动的运动皮层区域进行观察(图1a,b)。使用2 - 3月龄(此时少突胶质细胞正在形成中)的转基因小鼠(MOBP-EGFP小鼠,皮质中的所有正在形成髓鞘的少突胶质细胞和髓鞘中均表达EGFP;图1 c)作为研究对象。为了区分学习的过程和学习的效果,研究者分别在初始训练和训练完成1个月后进行活体成像。
研究结果显示,运动学习先短暂性地降低、随后升高前肢运动皮层少突胶质细胞形成的比率 (图1d,e)。少突胶质细胞减少仅限于训练期间,训练结束后,少突胶质细胞形成比率立即上升,增加了近2倍(分别为0.77 ± 0.19%和0.40 ± 0.04;图1 e),并持续升高3周。然而,预演没有改变少突胶质细胞形成的比率, 学习后增加的少突胶质细胞最终逐渐减少(图1 f)。总的来说,经过训练(学习和预演)的小鼠比未经训练的小鼠少突胶质细胞形成的比率更高。只有前爪运动皮层 layer I 的变化稳定(图1g); 该区域是运动学习加强神经元之间水平方向上联系的部位。
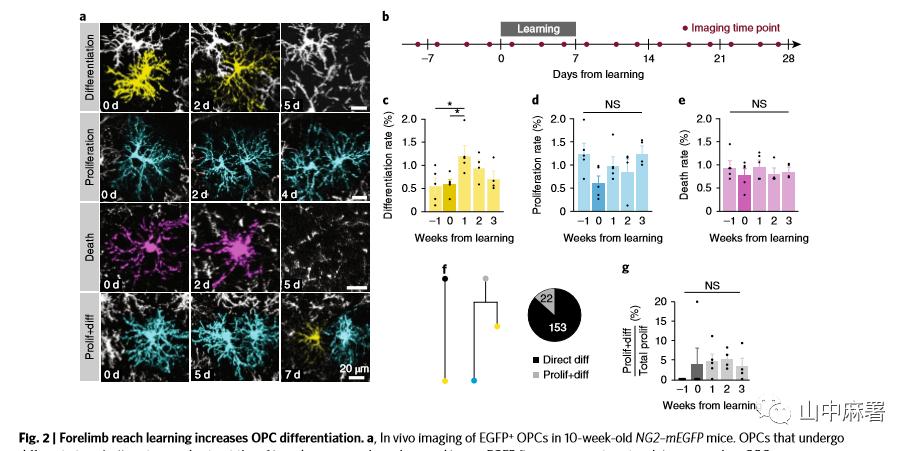
为了进一步探究运动学习是如何促进少突胶质细胞的生成, 研究者在OPCs膜表达EGFP的转基因小鼠中(NGG2-mEGFP mice),使用纵向的在体双光子成像技术,连续5周追踪前爪运动皮层OPC的迁移、增殖、分化和死亡(图2 a, b)。在学习后一周,OPC分化比率增加两倍(学习期间0.59±0.10%,学习后1.23±0.19%;图2 c);在学习期间,OPC分化比率不受影响,然而与基线相比,所有5只小鼠均表现出增殖比率下降(~50%)。无论是增殖率还是死亡在5周内均无明显差异(图2d,e)。在为期5周的观察中,只有10.91±3.77%的OPCs在分化前曾发生过增殖。故认为不对称分化的比例不受运动学习的影响(图2a,f,g)。为了评估运动学习后OPC分化的增加来自于局部脑实质OPCs还是临近脑区或生发区的前体细胞,研究者对迁移入成像区域的OPCs进行了追踪。移入和移出相关区域的OPCs数量不仅少而且不受学习影响,并且增殖和分化的比例也非常低。这些数据表明,在学习任务完成后,运动皮层本地的OPCs直接进行分化。
脱髓鞘导致少突胶质细胞丢失、改变髓鞘形成模式,造成运动皮层的功能缺失。
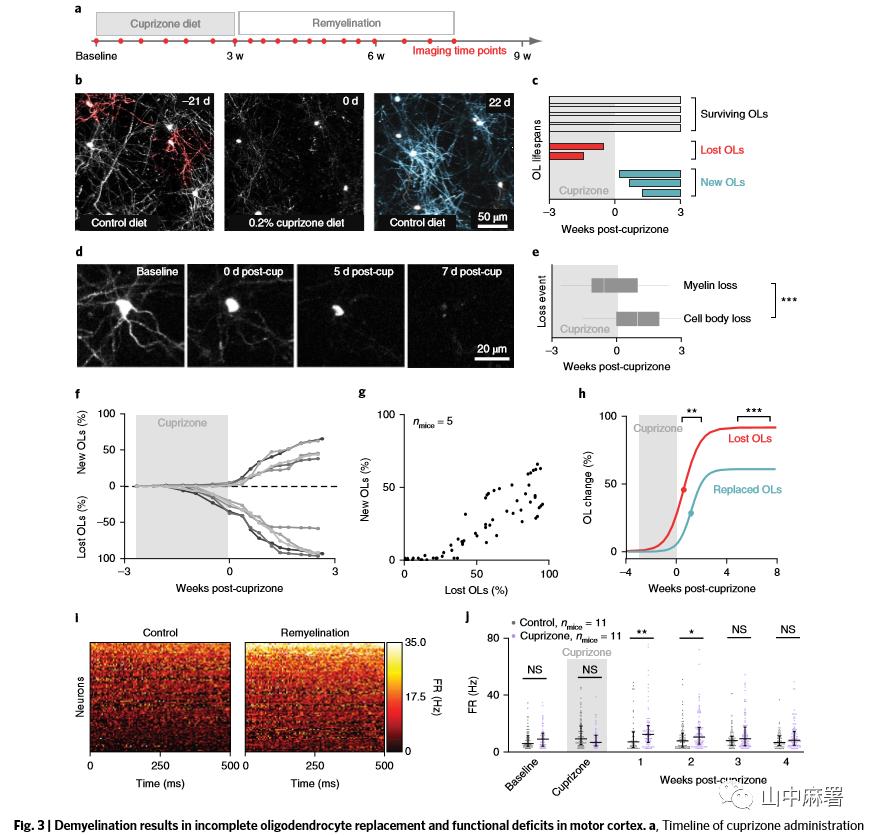
10周龄的MOBP-EGFP小鼠喂食0.2%cuprizone饲料3周以诱导少突胶质细胞死亡(约90%在前肢运动皮层;图3a),结果观察到髓鞘和成熟的少突胶质细胞的丢失。与此不同的是,皮质OPCs数量未发生变化(图4)。
皮层各个层次中少突胶质细胞的丢失程度一致,只留下少量完整的少突胶质细胞(12.94±3.10%,图3 b, c)和髓鞘。Cuprizone减少了少突胶质细胞形成, 85% 的新生细胞在3周内死亡。少突胶质细胞的死亡遵循双相模型:首先是髓鞘丢失,其次是胞体死亡(图3 d, e)。平台期发生于停cuprizone后大约15天 (图3f)。去除cuprizone后会引发强烈的少突胶质细胞形成反应,与少突胶质细胞损失程度成正比,并且大约在3周时达到平台期(图3f,g)。无论髓鞘再生还是健康状态下,新生少突胶质细胞的皮层分布具有相似性。再髓鞘化的过程中,少突胶质细胞的最大发生率可以达到未经过训练的健康小鼠的6倍,经过训练的健康小鼠的4倍。
停用cuprizone后对小鼠进行了长达60天的观察以进一步描述少突胶质细胞发生反应的特征。用再髓鞘过程中新生少突胶质细胞数量占少突胶质细胞损失的比例(“少突胶质细胞替代率”,百分比)进行量化。cuprizone停止后少突胶质细胞替代率遵循s型模式,使用三参数(3P) logistic方程来定量描述。曲线的拐点(当少突胶质细胞发生从加速转变为减速)和曲线的渐近线(少突胶质细胞替代率的平台)是研究者感兴趣的点。少突胶质细胞的替代现象要滞后大约4天,并且达到平台期后其数目显著低于少突胶质细胞的损失(图3h)。在7周内再髓鞘化并不能使少突胶质细胞恢复到基线的数量。
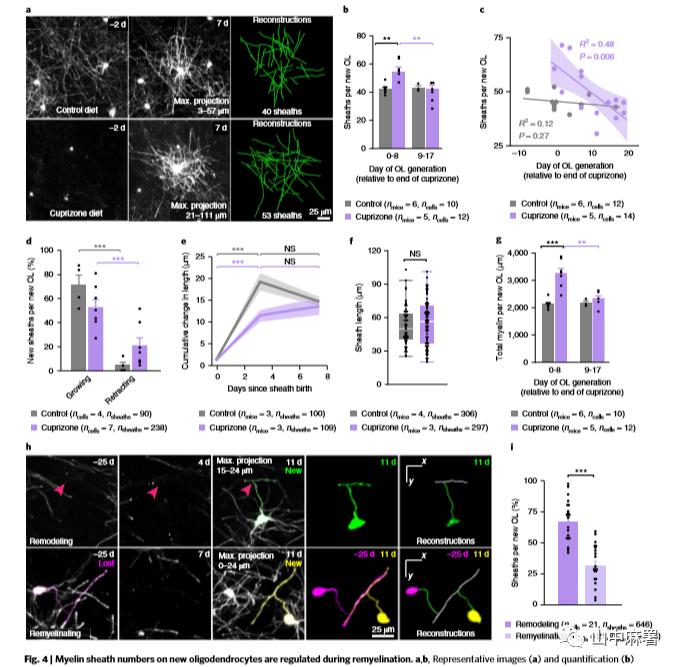
再髓鞘化不能完全恢复少突胶质细胞的基线数量,但神经元功能得以恢复。再髓鞘过程中新生少突胶质细胞产生髓鞘的数量、长度和位置值得进一步探究。再髓鞘化的第一周,新生少突胶质细胞形成的髓鞘多于第二周或对照组(图4 a - c)。在健康小鼠再髓鞘化的过程中,新生少突胶质细胞生成的髓鞘3天内稳定到相似长度(图4d-f)。因此,在脱髓鞘后的一周内,新生少突胶质细胞髓鞘数量的增加导致平均每个少突胶质细胞的髓鞘总量增加(图4 g)。此外,新生成的少突胶质细胞髓鞘经常出现在之前没有髓鞘的区域,从而在脱髓鞘损伤后形成一种新的髓鞘再生模式(图4h,i)。这些发现表明单个少突胶质细胞的髓鞘再生能力在早期的再髓鞘化过程中增强,而新生的少突胶质细胞改变了皮层的髓鞘生成模式。
运动学习以时间依赖性的方式调节脱髓鞘后的少突胶质细胞形成
小鼠分成三组:“静止”、“早期学习”(cuprizone停药后3天开始)和“延迟学习”(cuprizone停药后10天开始;图5 a, b)。行为干预并不影响脱髓鞘的严重程度(图5c)和再髓鞘化过程中少突胶质细胞发生的最大速率(图5d)。
早期学习组的小鼠未能成功进行运动学习 (图5e)。运动功能受损与运动皮层前肢支配区域的神经元兴奋过度有关,刚好对应整个早期学习阶段(图5f,g)。学习训练可以抑制50%的少突胶质细胞替代率 (图5b,h),导致少突胶质细胞替代率的拐点延迟(从9天延迟到15天; 图5i)。与健康对照组相比,学习训练对少突胶质细胞再生的抑制程度较轻(分别为75%和50%)。但是训练后的阶段,少突胶质细胞形成率并没有增加(图5h)。总之, 脱髓鞘后,运动受损,运动皮层神经元过度兴奋,学习训练不成功这一现象说明少突胶质细胞对于再髓鞘化无益。
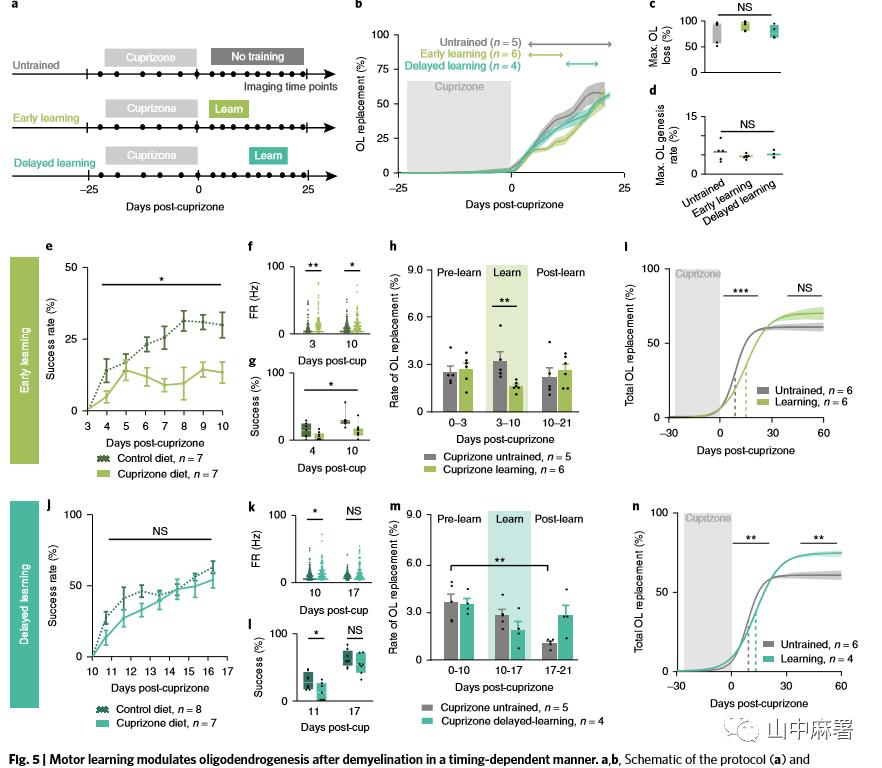
脱髓鞘化7周后,延迟学习组的小鼠相对于未学习组,少突胶质细胞替代率提高20%,运动皮层I-III的少突胶质细胞密度多出40%(分别为79.24±4.56% vs 58.43±5.26% 和86.67±5.36 vs 60.67±4.06 每0.06 mm3少突胶质细胞;图6 a - c)。延迟学习并没有改变单个新生少突胶质细胞形成髓鞘的数量(图6d),但是类似于健康小鼠(图1i-k),收缩的比例增加了 (图6e)。在未训练和延迟学习的小鼠中,来自新生少突胶质细胞的髓鞘与裸露轴突的再生髓鞘无明显差异(图6f)。由于长时间持续的少突胶质细胞发生,延迟学习组髓鞘替换的数量几乎是未训练小鼠的两倍(62.22±8.12% VS 34.72±8.84%;图5 n和6 a - c)。因此,研究者推测在脱髓鞘化后7周, 延迟学习的小鼠几乎替换了基线髓鞘数量的90%, 而未经训练的小鼠仅替换了54%(图6 h)。据此推算,裸露轴突的再髓鞘化在延迟学习组是未训练组的两倍(分别为30.19±1.33% vs 16.38±2.37%;图6i)。
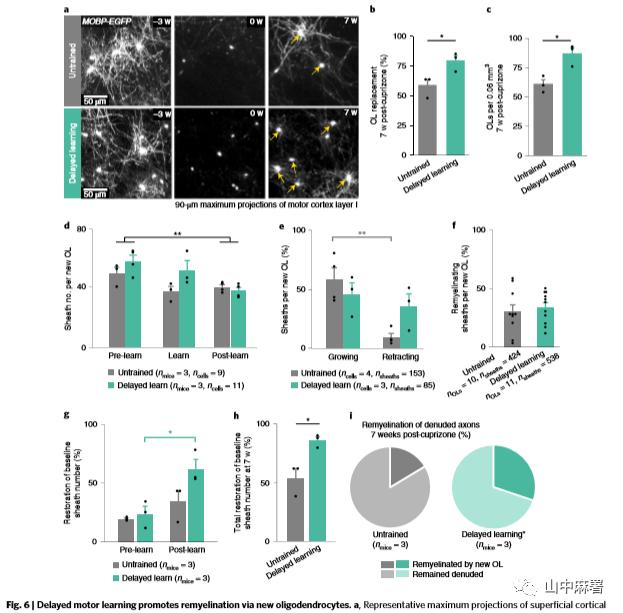
运动学习促进了已存在的成熟少突胶质细胞参与再髓鞘化
为了确定成熟少突胶质细胞的参与程度, 作者使用纵向体内成像和半自动追踪技术重建髓鞘和少突胶质细胞连接的过程。在cuprizone诱导脱髓鞘和髓鞘再生模型中追踪单个少突胶质细胞形成的髓鞘。未接受训练和延迟学习组之间少突胶质细胞的存活无差异(12.29±7.32% vs 20.84±6.60%)。经过3周的cuprizone干预后,未经训练组所有存活的少突胶质细胞均有髓鞘丢失,在极少数情况下(1 / 19)少突胶质细胞形成新的髓鞘,存活的少突胶质细胞的髓鞘收缩增加。延迟学习并不影响原有髓鞘的重塑程度,但促使原有少突胶质细胞新生成髓鞘 (图7d,e),原有的少突胶质细胞在成像开始1.7个月后依旧能产生髓鞘,这表明髓鞘生成的能力是少突胶质细胞的一种扩展特性(图7f)。
原有少突胶质细胞髓鞘的生成与训练有时间相关性。在学习过程中,产生新髓鞘的原有少突胶质细胞数量增加了40%以上,并在随后的几周内持续存在(图7g),由存活的少突胶质细胞产生的新生髓鞘累积数量在延迟学习组比未训练组中更多(图7h)。一旦学习开始后,存活的少突胶质细胞的髓鞘损失停止,这与未经训练组的髓鞘损失不同,后者在cuprizone停药后持续了2周(图7i)。损失的髓鞘数量与单个少突胶质细胞产生的髓鞘数量无关(图7j)。
皮质I层中原有的少突胶质细胞髓鞘生成量高于II/III层(图7k,l)。存活的少突胶质细胞在裸露和无髓鞘的轴突上都形成了新的髓鞘(图7m)。相对于新生成的少突胶质细胞,存活的少突胶质细胞使裸露轴突再髓鞘比例显著增加(图7n)。学习诱导的髓鞘损失停止和存活的少突胶质细胞产生新的髓鞘结合,保留了更多的初始髓鞘形成模式(图7o)。
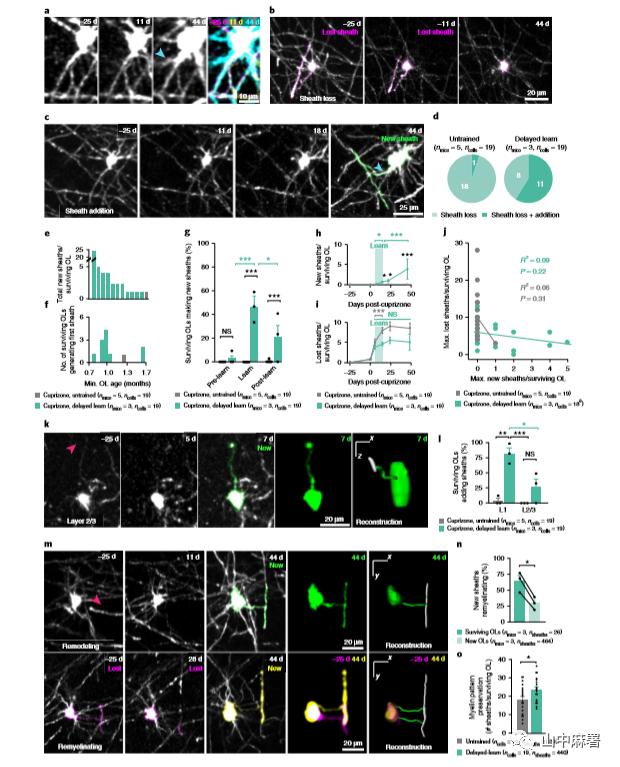
以上结果表明,脱髓鞘后,运动学习特异性地增强了原有的少突胶质细胞产生新髓鞘和维持原有髓鞘的能力。
原始文献:
Bacmeister CM, Barr HJ, McClain CR, et al. Motor learning promotes remyelination via new and surviving oligodendrocytes. Nat Neurosci. 2020;23(7):819-831. doi:10.1038/s41593-020-0637-3
作 者:
王甲利
排 版:
蒋 明
校 审:
方 芳
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




