- +1
清华程功教授综述:共生微生物在虫媒病毒侵染中的作用
原创 Cell Press CellPress细胞科学 来自专辑细胞出版社Trends综述

Life science
虫媒病毒(Arbovirus)是指以蚊、蜱和跳蚤等吸食血液的节肢动物为媒介传播的病毒,包括西尼罗病毒、登革热病毒、乙型脑炎病毒等。研究发现节肢动物与其体内的共生微生物之间维持着错综复杂的关系,这些共生微生物同时也以直接或间接的方式调节着虫媒对于虫媒病毒的易感性1。
近日,来自清华大学医学院的程功教授团队针对虫媒体内共生微生物与虫媒病毒的关系,在Cell Press旗下的Trends in Parasitology期刊发表综述,系统地回顾了吸血节肢动物体内的共生微生物与虫媒病毒相互作用的最新进展,并总结了共生微生物作用于节肢动物载体和虫媒病毒的分子机制。

节肢动物载体、微生物群落和虫媒病毒之间复杂的相互作用
吸食血液的节肢动物(如蚊子、蜱、蠓等)常常作为中间宿主传播病毒与疾病。在吸食血液过程中,它们可能会偶然叮咬携带了虫媒病毒的宿主,将具有传染性的病毒连同宿主的血液一起吸食进入节肢动物肠道。随后,病毒侵染其肠上皮细胞,然后通过感染血细胞扩散至全身组织,进而感染唾液腺并最终分泌进入唾液,当下一次叮咬发生时,虫媒病毒便会传播给下一宿主。
作为自然界中的重要病原体,虫媒病毒每年可造成数百万人患病或死亡,然而对于大多数的虫媒传染病,目前尚未研制出有效疫苗或特效疗法。前人研究表明,节肢动物载体中的许多共生微生物可能会影响其正常的生理功能,例如繁殖,代谢和免疫2。节肢动物的肠道是病毒侵染的关键部位,而肠道中多种多样的肠道菌群可以调节病毒的侵染能力或肠道上皮的防御能力3,4。由于共生微生物群落有潜力应用于控制虫媒疾病传播,节肢动物载体、肠道共生微生物和虫媒病毒三者间复杂的相互作用最近受到了极大的关注,全面理解它们之间的这些相互作用能够为虫媒疾病的预防和控制提供新的策略。
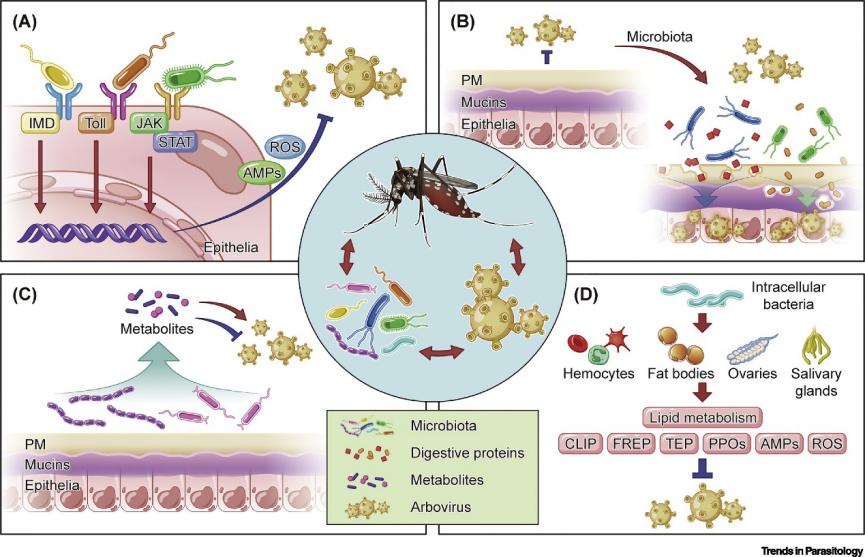
节肢动物载体与共生微生物之间的关系
共生微生物通常是由节肢动物载体从栖息地摄取,随后驻留在载体的肠道和血腔中并通过交配或母体垂直传递。因此环境条件,包括温度、光-暗周期、宿主可利用性和植被等因素5在很大程度上影响了肠道菌群的组成,从而导致了肠道菌群的高度多样性6,7。
一方面,共生微生物能够维持在节肢动物体内的稳态,并巧妙利用宿主因子或自身因子来躲避宿主体内免疫反应的刺激,从而适应宿主体内环境;另一方面,节肢动物可以精确地调节宿主免疫反应以耐受共生微生物并保持菌群正常生长5,。例如,蚊子肠上皮细胞组成性地将多种抗菌肽(AMPs)释放到肠腔中,以防止肠道菌群过度生长5,8,但同时肠道微生物可以与多种凝集素结合,从而免受AMPs侵袭并促进自身定植在肠道中。除AMPs外,活性氧(ROS)也是调节载体-微生物群稳态的另一个关键免疫机制9,例如,埃及伊蚊中肠内的ROS水平降低导致肠道菌群的异常增殖,肠道内稳态被打破;而沃尔巴克氏菌(Wolbachia)某些菌株(如wAlbB)的感染与高水平ROS密切相关。另外,载体肠道中物理屏障的产生也有助于通过将微生物群落与上皮细胞分离来抵消不良反应,维持体内稳态。
节肢动物肠道中的共生微生物和虫媒病毒的相互作用
在肠道环境中,丰富的共生微生物可通过调节肠道免疫反应、改变载体肠道的物理屏障或直接利用其自身代谢物来调节病毒感染肠道上皮细胞。
1.肠道菌群介导的免疫反应对虫媒病毒感染的调节
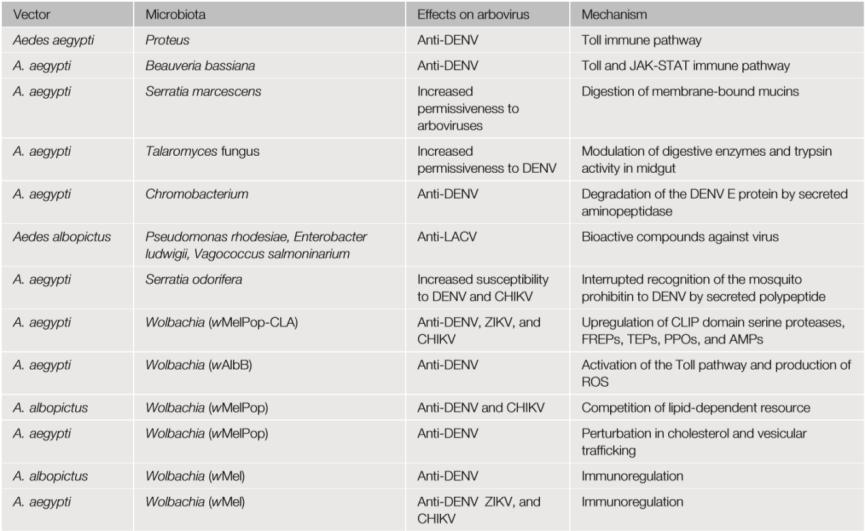
节肢动物载体可以通过调节共生微生物群介导的肠道免疫力(包括AMP的产生和ROS的活化)10来决定载体对虫媒病毒的敏感性。AMP介导的肠道免疫主要由两种NF-κB样途径主导,即免疫缺陷(IMD)通路和Toll信号通路。例如,通过口器摄入的一种肠道细菌Proteus sp.(Prsp_P)能够上调蚊虫肠道上皮细胞中AMP基因的表达,从而抑制登革热病毒(DENV)感染;昆虫病原真菌球孢白僵菌(Beauveria bassiana)通过激活Toll和JAK-STAT通路也能够抑制登革热病毒感染。ROS在抗虫媒病毒和其他病原体感染载体的过程中也起着至关重要的作用,例如:黄病毒非结构蛋白1(NS1)通过抑制蚊虫肠上皮细胞中ROS合成酶的表达来促进黄病毒感染;宿主血清铁通过刺激蚊虫体内ROS活性来抑制DENV感染;另外一种肠杆菌(Enterobacter sp. (Esp_Z)也可通过产生ROS来抑制疟原虫的生长。此外,鉴于节肢动物中的免疫系统高度保守,蚊虫肠道菌群介导的抗病毒机制可能也适用于其他节肢动物媒介,如蜱和蠓等。
2.通过肠道菌群介导的肠道物理屏障调节病毒感染
节肢动物肠道内有两道物理屏障:围食膜(PM)和覆盖在肠上皮表面的黏蛋白层。PM膜是一种富含糖蛋白的结构,可将肠上皮细胞与肠腔分隔开来。吸血节肢动物在吸食血液后,刺激肠道上皮细胞分泌几丁质粘多糖至肠腔中形成PM膜,肠道内的共生菌群可稳定PM膜并维持肠道的上皮屏障完整性。PM膜在调节病原体侵染肠道上皮细胞过程中起着复杂的作用。埃及伊蚊中PM膜的厚度增加能够降低一种禽疟原虫(Plasmodium gallinaceum)的感染率,而通过清除肠道菌群致使PM膜损伤进而可增加伯氏疟原虫感染率,这表明PM膜在宿主对寄生虫入侵的抵抗中发挥着重要作用。相反,也有研究表明PM膜可能也是肠道内病原体定殖必不可少的结构支架。另外,共生菌与黏蛋白层的相互作用也影响了虫媒病毒入侵肠道的能力。
3.肠道菌群代谢物对虫媒病毒感染的调节及潜在应用
除了增强肠道免疫和调节肠道物理屏障外,肠道菌群还可以通过分泌代谢产物直接调节虫媒病毒的感染。例如,埃及伊蚊中肠中分离出的色杆菌能通过分泌氨基肽酶直接降解DENV包膜蛋白从而抑制DENV感染;从白纹伊蚊的肠中分离出的罗氏假单胞菌等共生菌可能会产生具有生物活性的化合物,从而抑制拉克罗斯脑炎病毒的感染。因此对于这些具有抗病原能力的肠道微生物,有希望通过基因工程进行改造,以增强其分泌抗病毒因子和免疫活化剂。
非肠道组织中的共生微生物与虫媒病毒的相互作用
尽管肠道是共生微生物的主要栖息场所,但仍有许多共生微生物寄生在节肢动物的其他组织如唾液腺、脂肪体,卵巢和血细胞等,这些共生微生物也可以调节虫媒病毒的感染,从而影响节肢动物载体对虫媒病毒的易感性。例如,胞内共生菌沃尔巴氏体寄生于于体内多个组织中,可以激活多种抗病毒效应因子的表达,并通过多种机制有效抑制登革热病毒(DENV)、寨卡病毒(ZIKV)和基孔肯雅病毒(CHIKV)以及疟原虫感染。

Cell Press细胞出版社特别邀请程功教授进行了专访,请他们为大家进一步详细解读。
CellPress:
您是如何选择蚊媒病毒性传染病作为您的研究方向的?
程功教授:
博士期间我主要从事口蹄疫病毒相关研究,积累了一定的烈性病毒(生物安全三级)研究经验;博士后期间从事西尼罗病毒相关研究,主要关注西尼罗病毒在蚊虫中的携带及传播机制,开始涉足蚊媒病毒性传染病研究领域。随着研究深入,我发现蚊媒病毒传染病是一个重要且充满挑战的研究方向。近年来,多种新发或再发烈性蚊媒病毒传染病在世界不同地区暴发流行,每年导致数亿人感染。但是到目前为止,绝大多数蚊媒传染病并没有有效的疫苗或治疗药物,使得蚊媒传染病流行愈演愈烈。该公共卫生难题形成的原因,一方面是由于蚊媒病毒传染病存在特殊的致病机制,另一方面也是因为之前蚊媒病毒传染病基础研究相对滞后,尤其是“蚊虫媒介-病毒”分子关系一直是领域内研究的盲点,深入研究“媒介-病毒”关系将对蚊媒病毒传染病的防治提供新的思路和防治策略。回国建立实验室后,我选择将蚊媒病毒性传染病继续作为研究方向,并聚焦到三个主要方面:蚊媒病毒感染传播机制研究、蚊媒抗病毒免疫研究、蚊媒病毒新型防治技术研发。
CellPress:
对于虫媒传染病来说,您认为未来我们面临的最大挑战是什么?
程功教授:
虫媒传染病有数百种之多并由节肢动物携带传播,多数是典型的人兽共患及自然疫源性疾病,因此难于防治,即使通过疫苗或药物在人群中将病毒清除,病毒仍然会在自然界中长期循环存在,随时威胁人类健康。基于多年研究经验,我认为主要挑战包括:1、缺乏对虫媒传染病的科学理解。虫媒传染病种类庞杂,由蚊、蜱、白蛉等多种节肢动物媒介携带并传播给宿主。之前该领域的研究主要关注于病原体分类、病原体性质及传播因素,更多是从宏观角度观察描述虫媒传染病。由于缺乏对该类疾病的机制研究,导致虫媒传染病防治仍采取传统手段,在疫苗、药物、新技术方面长期没有进展。因此,从“源头”研究和理解虫媒传染病的致病机制、传播机制及宿主免疫保护机制显得尤为重要。2、新兴虫媒传染病不断出现。近20年来,登革热、西尼罗脑炎、基孔肯亚热及寨卡热等一系列虫媒传染病相继在世界不同地区流行,其中登革热及寨卡热在全球传播,引起严重公共卫生危机。但是对该类传染病仍缺乏相关疫苗、药物及有效干预手段,如何控制虫媒传染病仍然是一个我们必须面对的重要公共卫生问题。3、急需研发虫媒传染病的广谱防治策略。虫媒传染病有数百种之多,某些曾经“默默无闻”的病毒也可能突然暴发流行(如寨卡病毒引起的全球公共卫生事件),导致虫媒传染病层出不穷。但是针对每种虫媒传染病均研发药物和疫苗又不现实,因此需要思考和寻找对虫媒传染病的广谱防治策略,未来能有效控制该类疾病的传播流行。
CellPress:
您觉得公众对于虫媒传染病的哪些方面应该了解更多?
程功教授:
我认为首先要促进公众了解虫媒传染病的危险性。蚊子可以传播疟疾、淋巴丝虫病、登革热、寨卡热、乙型脑炎和西尼罗河病等严重疾病;蝇类可以传播盘尾丝虫病、利什曼病和非洲人类锥虫病;蜱虫可以传播莱姆病、出血热及多种脑炎。今天全世界80%以上的人口面临虫媒传染病的感染风险,一半人口面临两种或两种以上罹患虫媒传染病的风险。这些疾病多数没有疫苗或药物、严重感染可导致较高死亡率。所以公众应该更多地了解虫媒传染病的危险性,从而提高警惕,做好防护,降低虫媒传染病传播的风险;其次公众要了解防治虫媒传染病的重要性。虫媒传染病曾是人类社会的主要威胁之一,曾经的六大国际检疫传染病中有四种都是虫媒传播疾病。近年来,虫媒传染病多次暴发流行,随着国际交流的日益频繁,虫媒传染病的威胁也在不断增加,比如登革热在我国的流行呈明显上升,因此虫媒传染病防治未来将成为我国公共卫生的一项重要需求。
CellPress:
您对刚刚进入科研界的年轻科学家们有何建议?
程功教授:
我是2011年回国建立实验室开展独立研究,目前已近十年时间。回顾自己的研究经历,有几点建议与大家共勉:1、坚持自己的研究方向,要有“坐冷板凳”的精神。在一个领域内深入挖掘不随便追逐热点,终究会取得科研上的突破和领域内科学家的认可。2、将您的实验室成员视为队友。作为实验室负责人,须准确把握科研方向,为团队确定研究重点;同时要认真听取博士后及研究生等团队成员的意见和建议,并经常与他们讨论有关课题和科研思路,争取做到“授之与渔”。平时多多关心团队成员的工作和生活的日常问题。3、善于创建协作环境。合作是当前科学实践的基石,合作能够使科学家们解决一个实验室无法完成的、昂贵或跨学科的项目。将科学作为一项集体努力也为学习和专业发展带来了许多机会,特别是对于早期职业研究人员而言。因此,作为实验室负责人,需要积极促进实验室内及实验室间的协作,“集思广益”解决科学问题。
本文参考文献(上线划动查看)
1. Yin, C., Sun, P., Yu, X., Wang, P. & Cheng, G. Roles of Symbiotic Microorganisms in Arboviral Infection of Arthropod Vectors. Trends in Parasitology36, 607-615, doi:10.1016/j.pt.2020.04.009 (2020).
2. Gao, H., Cui, C., Wang, L., Jacobs-Lorena, M. & Wang, S. Mosquito Microbiota and Implications for Disease Control. Trends in Parasitology36, 98-111, doi:10.1016/j.pt.2019.12.001 (2020).
3. Cirimotich, Chris M., Ramirez, Jose L. & Dimopoulos, G. Native Microbiota Shape Insect Vector Competence for Human Pathogens. Cell Host & Microbe10, 307-310, doi:10.1016/j.chom.2011.09.006 (2011).
4. Ramirez, J. L. et al. Reciprocal Tripartite Interactions between the Aedes aegypti Midgut Microbiota, Innate Immune System and Dengue Virus Influences Vector Competence. PLOS Neglected Tropical Diseases6, e1561, doi:10.1371/journal.pntd.0001561 (2012).
5. Narasimhan, S. & Fikrig, E. Tick microbiome: the force within. Trends in Parasitology31, 315-323, doi:10.1016/j.pt.2015.03.010 (2015).
6Guégan, M. et al. The mosquito holobiont: fresh insight into mosquito-microbiota interactions. Microbiome6, 49, doi:10.1186/s40168-018-0435-2 (2018).
7. Coon, K. L., Brown, M. R. & Strand, M. R. Mosquitoes host communities of bacteria that are essential for development but vary greatly between local habitats. Molecular Ecology25, 5806-5826, doi:10.1111/mec.13877 (2016).
8. Zhang, R. et al. Regulation of Antimicrobial Peptides in Aedes aegypti Aag2 Cells. Frontiers in Cellular and Infection Microbiology7, doi:10.3389/fcimb.2017.00022 (2017).
9. Lee, W.-J. & Kim, S.-H. Role of DUOX in gut inflammation: lessons from Drosophila model of gut-microbiota interactions. Frontiers in Cellular and Infection Microbiology3, doi:10.3389/fcimb.2013.00116 (2014).
10. Cheng, G., Liu, Y., Wang, P. & Xiao, X. Mosquito Defense Strategies against Viral Infection. Trends Parasitol32, 177-186, doi:10.1016/j.pt.2015.09.009 (2016).
论文作者团队介绍

教授
程功教授在蚊媒病毒感染传播机制与抗病毒免疫研究领域进行长期探索,已取得了一系列的具有创新性和国际影响的研究成果,其一系列工作促进了蚊媒病毒传染病知识概念体系的发展和完善,代表着我国在蚊媒病毒传染病这一生命医学热点领域的重要突破。以上研究在《自然》、《细胞》及其子刊等主流刊物发表,获得多项发明专利授权并申请国际专利。程功教授的研究工作已处于蚊媒病毒研究领域的世界前沿,他的科研工作成果已受到广泛认可。
程功教授曾获得北京市科学技术奖(自然科学类)一等奖 (第一完成人)、国家杰出青年科学基金、教育部青年长江学者、国家自然基金委重点项目、茅以升北京青年科技奖、英国皇家医学会“牛顿高级学者”、谈家桢生命科学奖、树兰医学青年奖、中源协和生命创新奖、药明康德生命化学研究奖、科技部/盖茨基金会“Grand Challenge青年科学家”等奖励荣誉。担任中国昆虫学会昆虫比较免疫与互作专业委员会副主任委员、中国微生物学会微生物生物安全专业委员会委员、中国实验动物学会媒介实验动物专业委员会常务委员、中华预防医学会媒介生物学及控制专业委员会委员、国际应急管理协会亚太卫生应急专业委员会常务委员等学术职务。
Email:gongcheng@mail.tsinghua.edu.cn
相关文章信息
相关文章发表在CellPress细胞出版社
综述期刊Trends in Parasitology上,
点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Roles of Symbiotic Microorganisms in Arboviral Infection of Arthropod Vectors
▌论文网址:
https://www.cell.com/trends/parasitology/fulltext/S1471-4922(20)30106-9
▌DOI:
https://doi.org/10.1016/j.pt.2020.04.009
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




