- +1
“能量工厂”病了怎么办?科学家首次实现线粒体精准基因编辑
线粒体疾病研究将开启一个新的时代。
当地时间7月8日,顶级学术期刊《自然》(Nature)在线发表了一项研究,题为“A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing”。来自美国麻省理工学院-哈佛大学博德研究所化学生物学家刘如谦(David R. Liu)和华盛顿大学医学院微生物学家Joseph Mougous领导的研究团队合作开发了不依赖CRISPR系统的新型碱基编辑器(DdCBE),首次实现对线粒体基因组(mtDNA)的精准编辑。

线粒体被称为细胞的“能量工厂”,线粒体基因突变疾病通常由母系遗传,损害了细胞产生能量的能力。与核基因组相比,线粒体基因组中的基因数量较少,但这些突变尤其会损害神经系统和肌肉,也包括心脏,对遗传这些基因突变的人来说可能是致命的。
然而,由于无法有效引导RNA进入被膜包裹的线粒体内等原因,“基因魔剪” CRISPR-Cas9对修饰线粒体DNA至今束手无策。
一种特殊的细菌毒素为这一研究领域带来了转机。2018年,Mougous团队发现了一种叫做DddA的酶,它是由伯克霍尔德菌(Burkholderia cenocepacia)产生的一种毒素,可以在DNA双链上催化胞嘧啶(C)转化为尿嘧啶(U)。值得一提的是,它可以直接作用于双链DNA,而不需要Cas9酶来解旋。
实际上,细菌毒素代表了一个巨大的生物化学多样性蓄水池,可以重新用于生物医学应用,其中的一些成员已在基因编辑技术中得到应用。例如刘如谦之前开发的单碱基编辑器即利用胞苷脱氨酶,但这种酶只作用于单链DNA,刘如谦必须依靠Cas9酶来破坏DNA,正因如此该技术也无法适用于线粒体基因组。
2018年底,刘如谦团队收到来自Mougous的邮件,随后两个团队达成合作。他们判断,DddA适用于线粒体基因组。但是,要把DddA变成一种可行的基因组编辑工具,刘如谦等人还比如将其打磨。
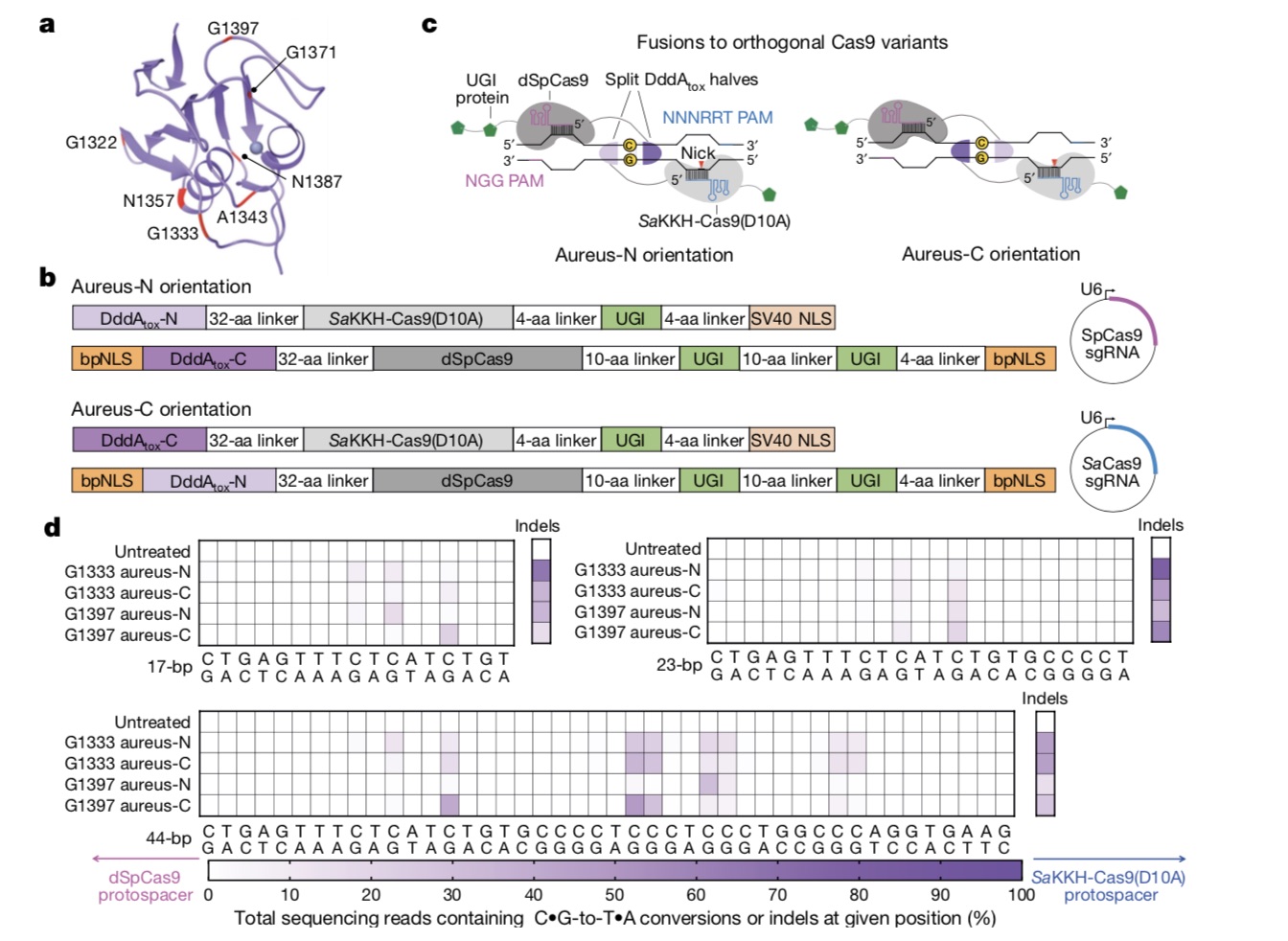
修改双链DNA的能力同时使得这种酶致命,它会让每一个遇到的C位点发生突变。为防止这种情况发生,研究团队将酶分解成两部分,只有当它们在编辑位点结合在一起时,才能恢复活性改变DNA。此外,该基因编辑工具递送到线粒体基质必须要穿过线粒体的双层膜,研究团队使用线粒体靶向信号(MTS)的氨基酸序列标记了基因编辑工具,利用线粒体的蛋白质吸收机制穿过线粒体的双层膜。
同时需要注意的是,DddA作为一种胞苷脱氨酶,它能将胞嘧啶(C)脱氨变为尿嘧啶(U),但U是RNA碱基,在DNA中易被尿嘧啶-DNA糖基化酶切掉,又恢复成C。研究团队最终利用尿嘧啶糖基化酶抑制剂(UGI)排除了这一干扰。这一步将编辑效率提高了近8倍。
总的来说,研究设计了无毒且无活性的split-DddA半分子,DddA分裂半体与转录激活子样效应子阵列蛋白(TALE)和尿嘧啶糖基化酶抑制剂融合,产生了无RNA的DddA衍生的胞嘧啶碱基编辑器(DdCBE),可催化人mtDNA中的C•G到T•A转化,具有高靶标特异性和产品纯度。
该研究使用DdCBEs建模人类细胞中与疾病相关的mtDNA突变,结果显示,不依赖CRISPR的DdCBE可以精确操纵mtDNA,催化人mtDNA中C•G到T•A的转化的编辑效率在4.6%-49%之间。
迈阿密大学的线粒体遗传学家Carlos Moraes评价道,“这是一个非常令人兴奋的进展,有了修改线粒体DNA的能力,我们就可以提出以前无法提出的问题。”哥伦比亚大学线粒体疾病研究专家Michio Hirano甚至称赞这一策略 “问鼎了线粒体研究领域的圣杯”。
不过,刘如谦谨慎提醒说,这项研究距离临床应用还有很长的路要走。他说,尽管他的团队最初的研究显示很少有脱靶现象,但还需要对不同的细胞类型进行更多的研究,这毕竟是基因编辑技术的常见问题。
刘如谦团队预计,这一最新的线粒体编辑工具可以修复49%已知的线粒体有害基因突变,将为线粒体遗传病的研究、治疗和预防带来了前所未有的希望。
尽管医学应用还很遥远,但英国剑桥大学线粒体遗传学家Michal Minczuk表示,通过使用这项技术生成动物模型,研究线粒体突变的影响,研究人员将在短期内受益。“我们可以极大地加快这一进程,这是一个惊人的进步。”





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




