- +1
背根神经节巨噬细胞参与神经病理性疼痛的发生和持续
原创 王沛 山中麻署

脊髓背角神经元与中枢神经系统(CNS)小胶质细胞间的相互作用,是诱发和维持周围神经损伤后神经病理性疼痛的重要因素。最新研究表明,外周神经损伤在激活背角小胶质细胞的同时,同侧背根神经节(DRG)中的巨噬细胞数量也会显著增加,提示DRG中也存在前痛觉神经元和非神经元细胞间的相互作用。然而,目前尚不清楚DRG中巨噬细胞的增加在神经损伤所诱导的疼痛表型中的作用。
巨噬细胞Fas诱导凋亡(MAFIA)转基因小鼠在CSF1R启动子的调控下表达一个自杀基因(Fas),该基因在巨噬细胞和小胶质细胞中特异表达,用FK结合蛋白二聚体AP20187(AP)可以激发巨噬细胞的凋亡。AP在MAFIA小鼠中不能透过血脑屏障,因而这种方法可以选择性地杀伤巨噬细胞。并且由于该品系小鼠在同一启动子的调控下共同表达绿色荧光蛋白(GFP),因此可以检测表达Fas的细胞的分布及其消耗程度。
Shepherd等人用MAFIA小鼠证明,清除神经损伤部位来自循环血中的单核/巨噬细胞后,可以减少神经病理性疼痛的发生。但由于该研究中DRG中的巨噬细胞并没有被清除,所以研究者认为,是外周巨噬细胞而不是DRG中的巨噬细胞在神经损伤引起的神经病理性疼痛中扮演重要角色。然而,既往已有研究证明在保留DRG巨噬细胞的同时,外周血单核/巨噬细胞的选择性耗竭对神经性疼痛的发展影响有限。鉴于此矛盾结果,作者再次使用MAFIA小鼠探究该问题,通过在外周神经损伤前或损伤后给予AP,观察DRG巨噬细胞对机械性超敏反应的发生和持续的作用。
1、神经损伤导致DRG中巨噬细胞扩增
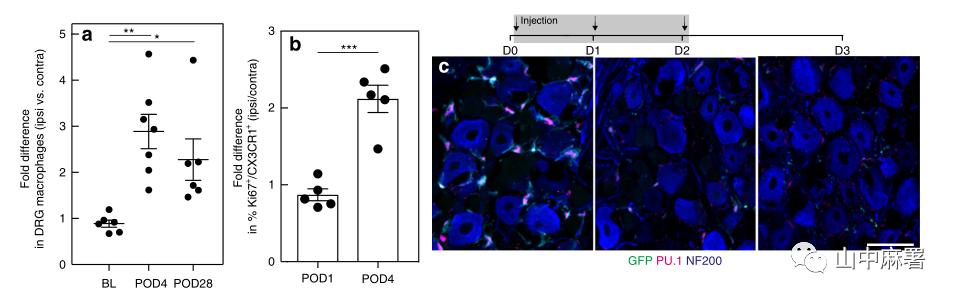
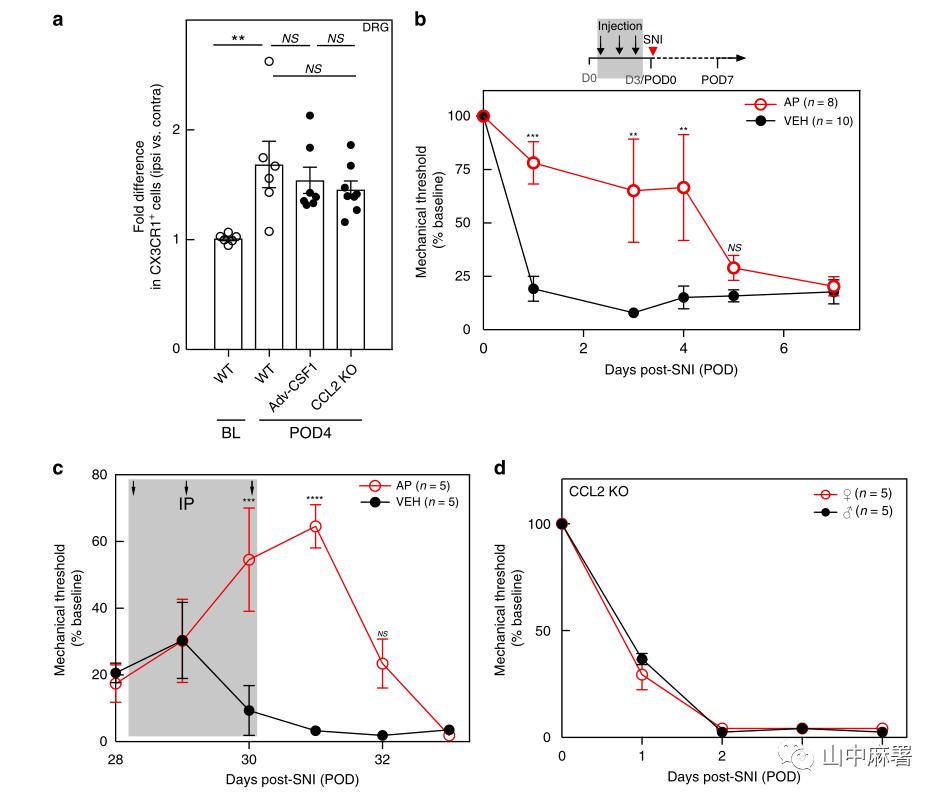
作者标记了CX3CR1(外周单核细胞和小胶质细胞的特异性标记),利用FACS分析保留性神经损伤(SNI)模型小鼠DRG内巨噬细胞。结果显示,在神经损伤后第4天(POD4),L4和L5损伤同侧的DRG中CX3CR1+细胞数量较对侧增加了2.9±0.4倍,且该现象至少持续了4周(POD28)(图1A)。
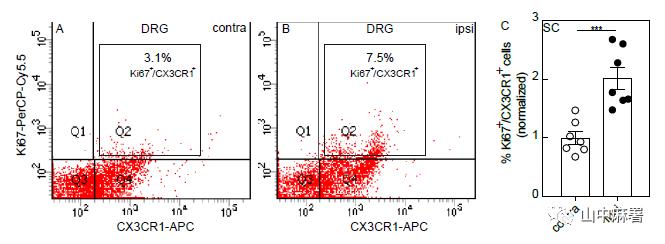
作者进一步追溯扩增的巨噬细胞来源。FACS分析显示,POD1时同侧DRG中Ki67+/CX3CR1+巨噬细胞的百分比与对侧没有差异。然而在POD4,损伤同侧DRG中Ki67+/CX3CR1+巨噬细胞的百分比增加了一倍以上(图1B和图2A,B)。FACS分析显示小胶质细胞(Ki67+CX3CR1+)在POD4腰段上较同侧神经损伤比对侧增殖增加了2倍多(图2C)。故轴突损伤诱导的DRG巨噬细胞扩增机制涉及局部增殖,尽管不能排除浸润的可能性,但作者更倾向于认为这种扩增以常驻巨噬细胞的增殖为主。
2、AP全身给药可使DRG巨噬细胞耗竭
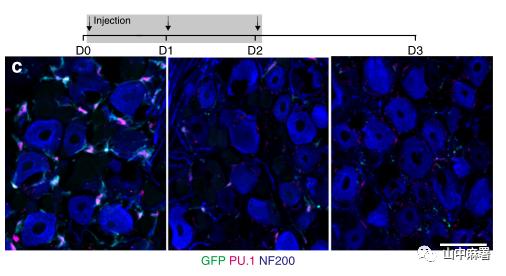
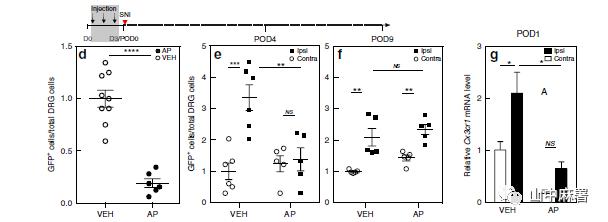
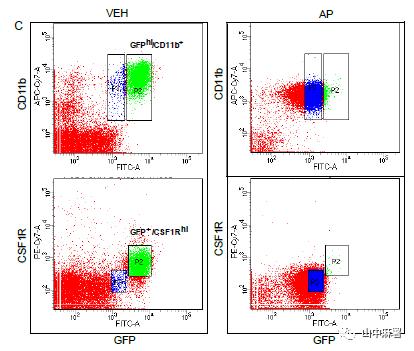
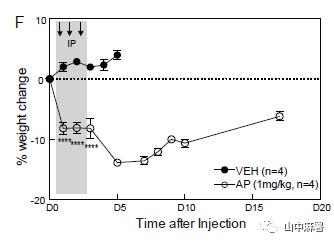
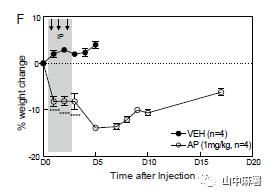
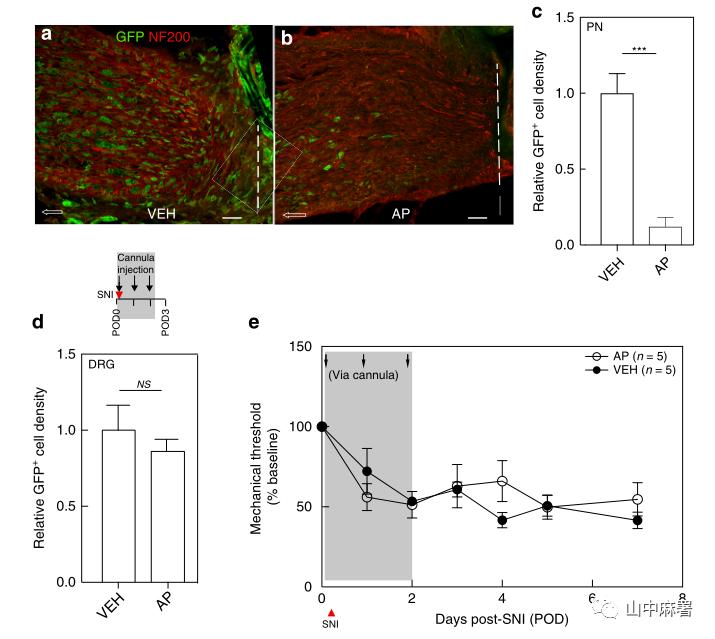
使用MAFIA转基因小鼠,连续3天腹腔注射AP(1.0 mg/kg)。使用GFP和PU.1(骨髓单核细胞及其未成熟细胞中表达的转录因子)共同标记DRG中的巨噬细胞。三次注射后,GFP+/PU.1+细胞和GFP+/Iba1+细胞显著减少(图1C)。在另一组小鼠中,在3天AP方案后的第1天,FACS分析显示,L4和L5 DRG中的常驻(GFP+)巨噬细胞减少约80%(图1D)。同时,FACS分析显示,循环成熟单核细胞减少近90%(图2C)。在D6血液中单核细胞的百分比基本恢复基线值,尽管体重持续下降(图3F)。综上所述,MAFIA小鼠经AP处理后,DRG内的常驻巨噬细胞以及外周单核细胞(尽管是短暂)显著降低,但并不改变疼痛阈值。
建立神经损伤模型。通过qPCR检测DRG中Cx3cr1的表达以了解巨噬细胞的早期反应。实验记录到,与未受伤侧DRG相比,造模侧L4/L5 DRG中的Cx3cr1表达增加了2.1±0.4倍。在SNI之前,AP处理不仅降低了未受伤侧DRG中的基线Cx3cr1表达,而且还阻止了造模侧DRG中Cx3cr1表达的增加(图1G)。到POD4(最后一次AP治疗后第5天),巨噬细胞数量恢复到未受伤、对照组小鼠中记录的水平(图1E)。到POD9时,同侧DRG中巨噬细胞扩增再次出现,与未用AP的对照组没有差异(图1F)。
3、AP方案不改变脊髓内小胶质细胞数量
这部分研究是为了确认AP不能通过BBB。与未受伤的对照组小鼠相比,作者通过FACS发现AP处理的小鼠脊髓中小胶质细胞数量没有差异,小胶质细胞的免疫染色结果也没有差异。该结果明确了AP的外周选择性作用。作者还讨论了神经损伤后BBB受损可能导致AP漏入脊髓的可能性。神经损伤导致的Cx3cr1基因表达上调、小胶质细胞激活、SNI后1天和4天小胶质细胞增生的现象在AP组和对照组的脊髓中均没有不同。总之,AP给药对脊髓小胶质细胞和星形胶质细胞都没有影响。
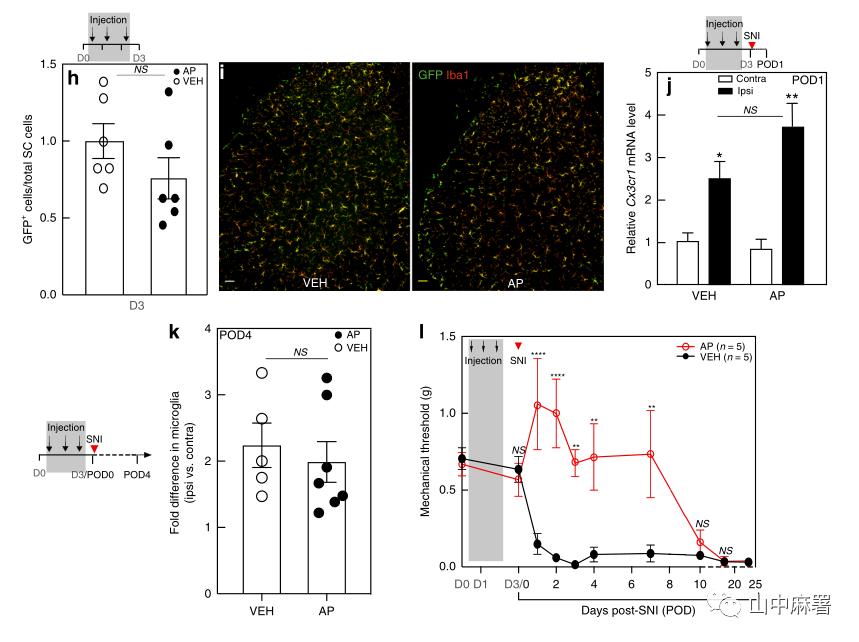
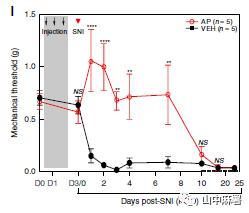
使用SNI模型,对照组小鼠在造模后24小时内发生机械性超敏反应,3天AP治疗方案显著延迟了超敏反应的发生,至少延迟至神经损伤后的第7天(图1)。如果维持巨噬细胞的量,则小鼠表现出机械痛超敏。此外,SNI后持续使用AP并不能进一步加强其抗超敏效应(图2)。研究结果表明,AP治疗的抗痛觉超敏作用与预防DRG巨噬细胞扩增有关,且这种影响与体重减轻无关(图3)。
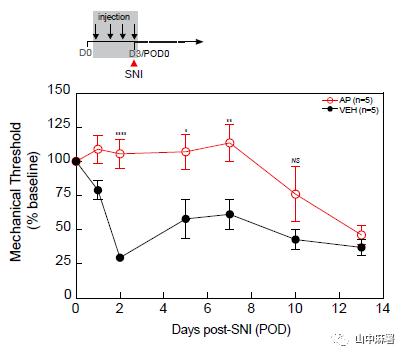
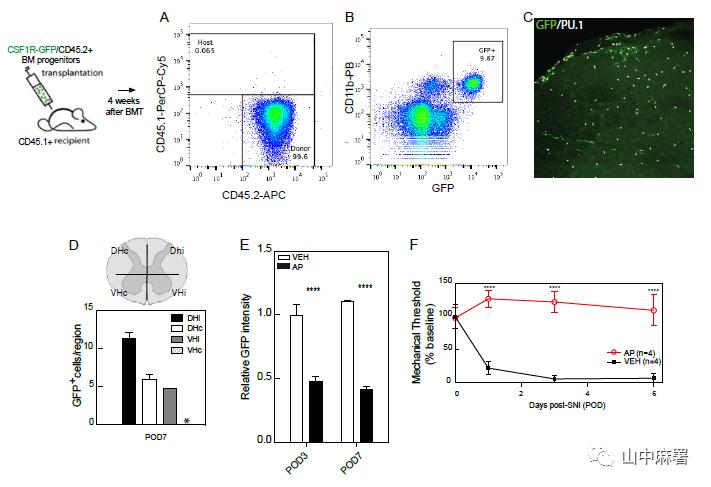
在另一个实验中,作者将从MAFIA小鼠中分离的骨髓祖细胞(GFP+)移植到经辐射的WT小鼠中,脊髓中的小胶质细胞主要来源于宿主。SNI模型证实了AP对脊髓小胶质细胞没有作用,且DRG中AP介导的巨噬细胞耗竭显著延迟了神经损伤引起的机械性超敏反应的发展(图4)。
5、神经性疼痛表型的发生需要DRG中巨噬细胞扩增,
并且与神经损伤部位的巨噬细胞浸润无关
作者设计实验以选择性地耗竭损伤部位的巨噬细胞,使DRG巨噬细胞保持完整。作者在神经损伤部位植入套管,通过套管给予低剂量AP,从而选择性地针对损伤部位周围的巨噬细胞而没有全身作用。在神经损伤之前,作者通过套管给予小剂量AP(0.8μg/20μl,连续3天给药)。在给药后第1天,通过量化GFP+细胞密度,作者发现AP处理的小鼠神经损伤部位的巨噬细胞(GFP+)与对照组相比减少了近90%。这种给药途径并不能阻止受损DRG中巨噬细胞的扩增,对机械性超敏反应的发生也没有影响。我们的发现不同于先前的报道,巨噬细胞在DRG而不是损伤部位的扩增,是引起神经损伤的机械性超敏反应所必需的。
SNI诱导的机械性痛觉异常持续时间长,这种行为表型与同侧背角小胶质细胞的长时间激活有关。周围神经损伤后,小胶质细胞的激活至少持续4周。在这个时间点,我们还记录到同侧DRG和神经损伤部位的巨噬细胞数量持续增加(图1)。
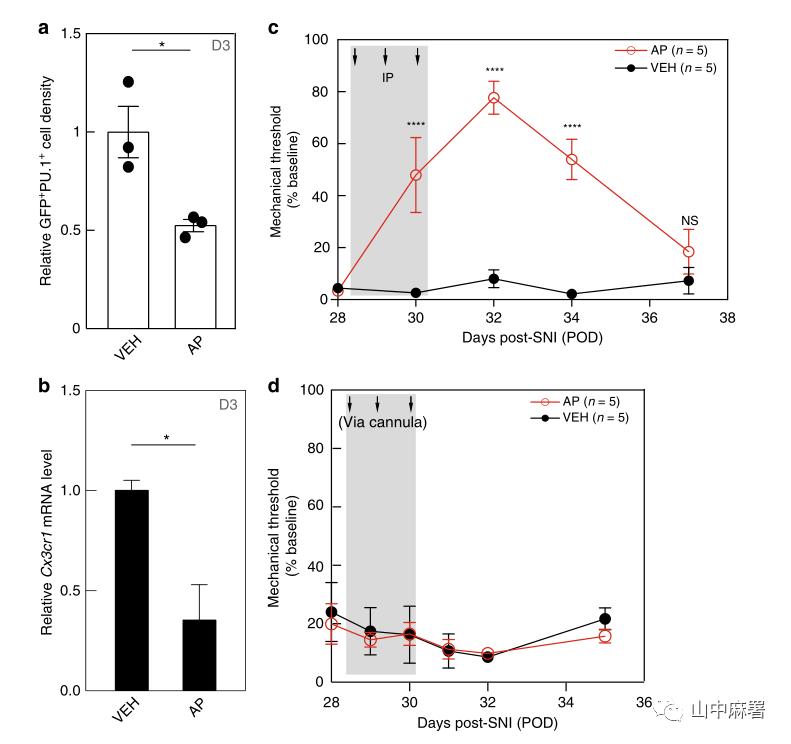
为了研究外周巨噬细胞对维持机械性超敏反应的作用,作者在神经损伤后28天(POD28)重复了三天AP方案。使用量化GFP+/PU.1+巨噬细胞密度(单位面积细胞数),以及Cx3cr1的qPCR的方法进行研究,与对照组相比,DRG巨噬细胞减少了近50%(图2a,b)。在另一组接受类似治疗的小鼠中,研究发现机械性痛觉过敏短暂性的缓解了80%(图2c)。在最后一次注射AP后6天内,痛觉过敏再次出现。为了研究损伤部位的巨噬细胞是否有助于维持持续性机械性超敏反应,作者在SNI4周后植入套管,并连续3天每天给药0.8ug AP。图4d显示神经损伤部位巨噬细胞的选择性耗竭对持续性机械性超敏反应没有影响。故DRG中的巨噬细胞,而不是周围神经损伤部位的巨噬细胞,是维持周围神经损伤引起的超敏反应的关键因素。
7、神经损伤引起DRG巨噬细胞与感觉神经元间的相互作用
在AP处理的小鼠中,巨噬细胞的耗竭并不能阻止CSF1在感觉神经元中的表达。由于DRG巨噬细胞表达CSF1R,损伤诱导的CSF1表达是否有助于DRG巨噬细胞的扩增。
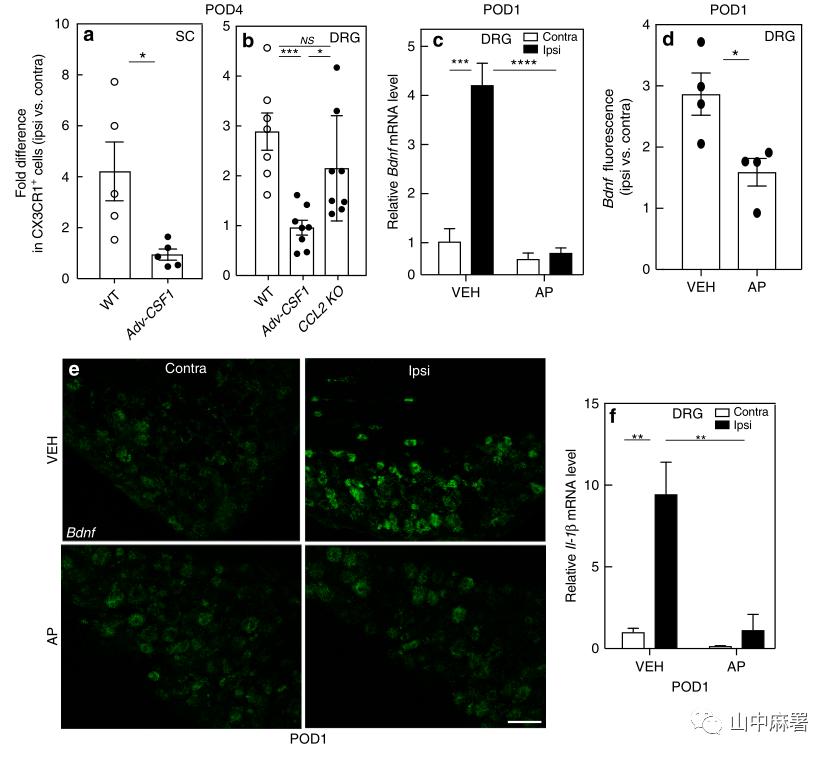
使用Adv-Cre;Csf1fl/f1小鼠中进行了研究(选择性地从感觉神经元中敲除Csf1基因,防止了神经损伤引起的Csf1表达和机械性超敏反应的发生)。与预期一样, POD4时转基因小时腰椎背角的小胶质细胞的激活和增殖基本被消除(图1a)。有趣的是,Csf1的条件性缺失也阻止了DRG中巨噬细胞的损伤性扩增(图1b)。在整体缺乏CCL2(一种有效的CCR2配体)的动物中,这种扩增没有受到影响(图1b)。故神经损伤通过表达csf1的感觉神经元与DRG巨噬细胞的相互作用而使后者扩增,这种效应不依赖于CCL2。
接着作者研究了神经损伤导致的DRG巨噬细胞的扩增或激活是否会反过来影响感觉神经元。结果显示SNI小鼠的L4和L5DRG区BDNF mRNA增加4倍,AP预处理则完全抑制了这种增长(图1c)。由于qPCR不能确定BDNF的增加是来自感觉神经元还是来自周围的非神经元细胞,故进一步使用原位杂交技术(ISH)。图1d,e显示,在POD1,感觉神经元而不是周围的非神经元细胞中BDNF mRNA上调。且ISH与qPCR分析结果一致。故虽然巨噬细胞不表达BDNF,但它们是感觉神经元中神经损伤引起BDNF上调的关键因素,而且是必要的。
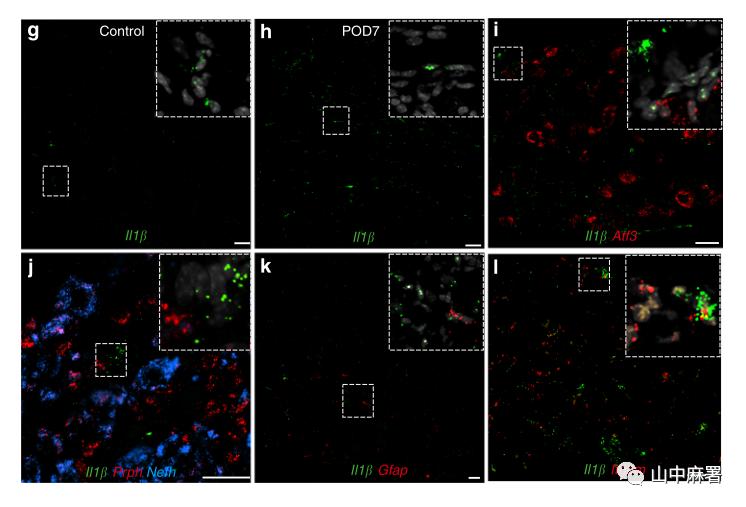
为了确定DRG巨噬细胞的活化如何影响感觉神经元,作者研究了IL-1β、TNFα,它们在DRG的神经细胞和非神经细胞中都有表达,并且与神经病理性疼痛有关。在POD1,造模侧L4/L5 DRG中IL-1β的基因表达几乎上调了10倍(图f)。3天AP方案预处理,不仅消除了DRG中IL-1β的上调,而且还降低了对侧DRG的基线表达。使用ISH确定POD7 时IL-1β上调的细胞(图g,h)。尽管既往的免疫组化研究显示损伤诱导的IL-1β在星形胶质细胞和感觉神经元中表达,但出人意料的是,仅在Itgam+(即CD11b)巨噬细胞(图i-l)中检测到IL-1β。TNFα水平不受神经损伤以及AP预处理的影响。对于抗炎因子IL-10和TGFβ而言,前者表达水平低到检测水平以下,后者并未发生改变。以上结果表明神经损伤后IL-1β的上调主要来源于DRG巨噬细胞,减少巨噬细胞耗的抗超敏作用部分是由于IL-1β减少所致。
8、DRG巨噬细胞的扩增具有性别差异
既往研究显示脊髓小胶质细胞对神经病理性疼痛的作用在雌雄小鼠体内具有差异。故本研究试图解答DRG巨噬细胞对神经损伤引起的机械性超敏反应是否也存在性别差异。在POD4,对雌性WT小鼠DRG的FACS分析显示,造模侧DRG中的巨噬细胞显著增加(1.69±0.21倍)但程度弱于雄性。另一方面,尽管的条件性敲除Csf1阻止了雄性小鼠巨噬细胞的扩增,但在雌性小鼠中,条件性敲除Csf1和整体敲除CCL2都没有阻止巨噬细胞的扩增(图a)。显然,一定有其他感觉神经元衍生因子影响了雌性小鼠巨噬细胞的扩增。
对巨噬细胞在SNI诱导的雌性小鼠机械性超敏反应的作用进行研究。与雄性小鼠一样,三日AP注射方案导致的巨噬细胞耗竭延迟了机械性超敏反应的发生(图b)。与雄性小鼠一样,雌性小鼠的脊髓小胶质细胞没有受到影响。此外,AP预处理后4周,当出现明显的机械性痛觉超敏反应时,继续给予AP也会导致雌性小鼠痛觉超敏反应的短暂逆转,尽管逆转幅度较小(60%)(图c)。此外对于缺乏CCL2的雄性和雌性动物,SNI诱导的机械性超敏反应在雄性和雌性小鼠中具有可比性(图d)。综上所述,我们认为DRG巨噬细胞有助于雄性和雌性小鼠神经损伤诱导的机械性超敏反应的发生和维持,但CSF1对神经损伤诱导的DRG巨噬细胞扩增的贡献存在性别差异。
该研究证明,雄性和雌性小鼠的DRG内巨噬细胞对于进神经病理性疼痛的发生和维持是必要的。研究也发现在神经损伤的背景下,DRG中巨噬细胞和感觉神经元之间存在着相互作用,这也为神经病理性疼痛的管理提供了潜在靶点。
原始文献:
Yu X, Liu H, Hamel KA, et al. Dorsal root ganglion macrophages contribute to both the initiation and persistence of neuropathic pain. Nat Commun. 2020;11(1):264. Published 2020 Jan 14. doi:10.1038/s41467-019-13839-2
作 者:王 沛
排 版:蒋 明
校 审:方 芳
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。

- 谁在把水搅浑
- 服务业扩大开放,多领域明确试点任务
- 中汽协倡议规范驾驶辅助宣传

- vivo新一代旗舰机vivo X200 Ultra发布,6499元起售
- 科大讯飞一季度净亏收窄超三成,2024全年营收重回双位数增长

- 一项世界性的环境保护纪念日,在每年4月22日
- 中国南北朝时期传唱的乐府民歌,后人把它与《孔雀东南飞》合称为“乐府双璧”

- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司