- +1
【学术前沿】衰老干预研究进展——清除衰老细胞
以下文章来源于老顽童说 ,作者老顽童说

公众号致力于传播衰老相关的前沿科研进展和趣味科普,帮助大家更深入地了解衰老背后的科学故事~

获取更多CSCB2020相关资讯
相信很多人都听过韩磊老师唱的《向天再借五百年》,歌曲中的“我真的还想再活五百年”唱出了我们绝大多数人的心声。随着人们对自然认知的增加以及科学知识的普及,我们已经“悲痛地”认识到“上天”是不会(当然也不能)借给我们时间的,难道我们就只能任由岁月的宰割吗?答案是否定的!科学家们已经发现能够通过多种干预手段延缓衰老进程,其中也包括近年来比较受关注的措施——“清除衰老细胞”。今天小编要跟大家分享的是2020年7月发表在Trends in Molecular Medicine上的综述文章,文章题目为“Reducing Senescent Cell Burden in Aging and Disease”。这篇文章详细介绍了清除体内衰老细胞的方法,以及该方法预防、延缓衰老的分子机制。
通讯作者:Robert J. Pignolo
(图片源于网络)
摘要
细胞衰老不仅是衰老的一个主要过程,而且也是一种肿瘤抑制机制。细胞的衰老伴随着以下特征:不可逆的生长阻滞、凋亡抵抗、衰老相关分泌表型的产生、线粒体功能紊乱以及DNA和染色体的改变。在临床前衰老模型中,衰老细胞的积累与多种慢性病、衰老综合征、多发病和加速衰老表型有关。在动物中,利用遗传学和药物学方法降低衰老细胞负担可以预防、延缓和/或缓解各种衰老相关的疾病和后遗症。截至目前,早期临床试验的重点是称为“senolytic”类的清除衰老细胞药物的安全性和靶向性。研究人员推测这些药理学干预方法可能会在老年医学领域产生革命性的影响。
亮点
(1)衰老细胞累积是衰老的一个基本过程,可导致老年性疾病的发生并影响健康寿命和缩短寿命。
(2)目前,已成功在动物模型中利用遗传学方法实现了清除衰老细胞,并且通过药物学方法在人和动物中均成功清除了衰老细胞。
(3)可以通过药物学方法靶向抗凋亡网络或衰老相关分泌表型(SASP)从而减轻衰老细胞负担。
(4)关于“senolytic”类药物的前期临床研究正在解决安全性和靶向性的问题。
正文
靶向细胞衰老作为原发性衰老的干预手段
导致原发性衰老的细胞和分子因素包括:慢性且轻微的非微生物所致的炎症、细胞衰老(详见词汇表注释)、大分子(DNA、蛋白质、糖类、脂质)损伤的积累以及干细胞和祖细胞功能失调。这些变化将导致:组织萎缩和丧失、去神经支配和肥大样的病理生理学表型;灌注减少、对外部信号(即刺激和压力)的应答减弱,以及对损伤的再生修复能力降低;脂肪转化和纤维化产生;内稳态的改变。在个体水平上,原发性衰老临床表现为机体功能下降、自我修复能力下降、脆弱程度加重、生存率降低和疾病发生率升高。
目前的研究在将细胞衰老作为基本的衰老进程方面已经取得了实质性进展,老年医学假说也得到了许多令人鼓舞的成果的支持。在临床前期样本中,清除衰老细胞可改善与年龄相关的表型,包括老年综合症、慢性疾病和适应能力减弱。在衰老动物模型中,通过遗传学或药理学方法清除衰老细胞的干预措施表明,在理论上该方法可以用于改善衰老相关的人类疾病,尤其是那些受衰老细胞严重负担影响的疾病(请参阅“临床医生视角”)。目前已有许多理论可行的措施来干预原发性衰老过程,这些方式可能并不同于针对细胞衰老的干预措施。但是这些过程并不一定相互排斥,而可能是相互依存的(图1)。这表明,针对单个原发性衰老过程的任何干预措施都可能和影响衰老的多个过程相互影响。
词汇表
(1)凋亡:在正常生长、发育和清除潜在有害细胞(如癌前细胞或病毒感染细胞)的过程中发生的程序性细胞死亡。
(2)细胞衰老:细胞经历不可逆生长停滞的过程,通常继发于毒性损伤或有丝分裂信号失调。衰老细胞有几个显著的变化,包括染色质的表观遗传重塑、细胞器丰度和功能的变化以及促炎因子的分泌增加。然而,这些变化大多并不普遍,取决于细胞类型和所受到刺激的类型。
(3)疾病压缩理论:当慢性病的发病推迟到比预期最大寿命更长时,病人受疾病困扰负担时间即会缩短。
(4)损伤相关分子模式:从受损或坏死细胞中释放的一系列分子,通过与模式识别受体结合激活先天免疫系统,它们促进病理性炎症反应并诱导细胞衰老。
(5)老年医学假说:由于衰老是大多数慢性疾病和衰弱状态的基础,延缓原发性衰老过程的干预措施也会同时预防、延缓或缓解多种老年性疾病。
(6)JAK/STAT:在哺乳动物中,这是一系列细胞因子和生长因子的主要调节机制,JAK途径在衰老细胞中更为活跃,其抑制后可抑制SASP。
(7)早衰:类似于老年人的衰老表型,通常指过早的或加速的衰老。
(8)p16INK4a/Rb: p16是一种细胞周期蛋白依赖性激酶(Cyclin-Dependent Kinases, CDKs)的抑制剂,它可以阻止细胞周期蛋白D与CDK4/6结合和形成一种磷酸化视网膜母细胞瘤蛋白(Phosphorylates Retinoblastoma Protein, pRB)的活性蛋白复合物。如果Rb被CDKs磷酸化,它便会与E2F家族转录因子(E2F 1-3)分离,进入细胞核,促进G1-S期细胞周期转变所必需的靶基因转录。为了便于理解,我们已经将这个过程进行了简化,但是应该注意的是该过程可能涉及其他参与者,包括Rb的几个非E2F靶基因等。p16高度甲基化、突变或缺失导致细胞周期进程失调。p16表达增加与细胞衰老有关。
(9)p53/p21: p53依赖性细胞周期阻滞是主要的应对DNA损伤的反应。p21是细胞周期依赖性激酶的抑制剂,是p53激活引起的下游细胞周期阻滞的主要介质。p21蛋白在G1期和S期都起着调节细胞周期进程的作用。p21的激活与细胞衰老有关。
(10)端粒:染色体末端重复核苷酸序列的区域。包含蛋白质复合物形成的保护环结构,防止退化或与相邻染色体融合。随着复制次数的增多,端粒会逐渐变短或功能失调,端粒的长度过短或功能失调与DNA损伤反应有关,进而引发细胞衰老。
(11)转座子:DNA中能翻译成RNA,反向转录成DNA,并重新插入染色体上新位置的元素(“跳跃基因”)。转座子可以破坏染色体结构,导致细胞内炎症和SASP产生。
临床医生视角
(1)衰老是慢性疾病以及身体状况和认知能力下降的最重要的一个风险因素。
(2)衰老细胞负担会导致老年慢性疾病、衰老综合征、诱导加速衰老(如卵巢早衰)以及衰老细胞局部堆积的病理生理过程(如骨关节炎)。
(3)衰老细胞会随时间积累,其组织特异的负担取决于以下因素:(i)衰老诱导因素的类型和数量;(ii)免疫系统清除能力;(iii)衰老细胞通过旁分泌和全身反应对非衰老细胞造成的旁观者效应。
(4)靶向细胞衰老负担或其他主要的衰老干预手段,应该能够防止或延缓甚至减轻多种衰老相关的疾病。此外,因为衰老细胞会花费数周时间再积累,所以间接地(不频繁地)使用“senolytic”药物成为可能,并可以潜在的降低药物副作用。
第一代“senolytic”药物当前已经上市,但是这些化合物的临床应用还有待进行安全性、靶向性和有效性研究,以确定清除衰老细胞所需的最小/最佳剂量和用药频率。与其他侧重招募相对健康老年人(仅患一种疾病或极少的共患病)的临床试验不同,使用“senolytic”药物的临床研究则希望招募患有多发病、衰老综合征或身体功能相对较差的老人。
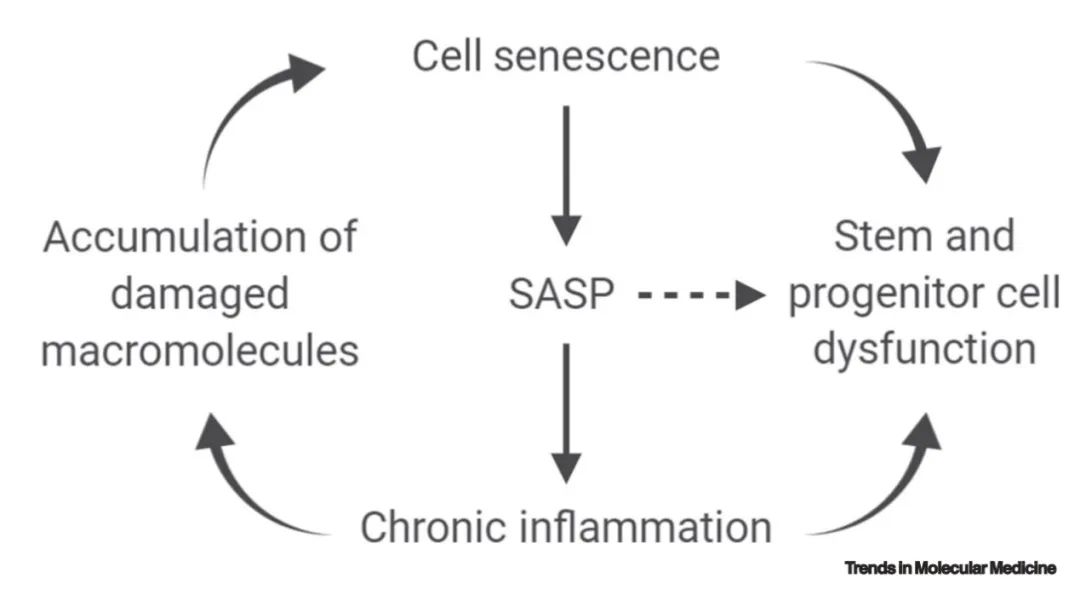
细胞衰老发生于多种细胞类型,包括干细胞和祖细胞,并导致分化功能和组织再生能力受损。慢性炎症通过产生衰老相关的分泌表型(Senescence-Associated Secretory Phenotype, SASP)介导衰老的变化并导致损伤大分子的积累。SASP还可以促进旁分泌和全身的旁观者效应(图中右虚线箭头)引起干细胞和祖细胞功能障碍。此模式图可以用假设驱动的方式进行验证。
细胞衰老
尽管细胞衰老可能不是个体衰老唯一的机制,但是研究者们认为在细胞水平上其仍是主要机制。现在发现许多细胞衰老的诱导因素,包括DNA损伤、活性代谢产物、炎症、癌基因、有丝分裂原、蛋白毒性应激及损伤相关分子模式。DNA损伤反应 (DNA Damage Response, DDR) 是诱导细胞衰老的关键。而端粒缩短、功能障碍、突变、辐射或烷化剂都有可能引起DDR。活性代谢产物则包括活性氧、脂肪酸、高浓度的葡萄糖及神经酰胺。蛋白毒性应激及蛋白稳态丧失则与蛋白质聚集、未折叠蛋白反应和mTOR的激活相关。上述这些诱导因素依据其类型及被诱导细胞的类型,最终通过激活p16INK4a/Rb或p53/p21通路的机制介导细胞衰老表型。细胞衰老表型的特征包括不可逆的生长停滞、SASP(框1)、细胞凋亡抗性、线粒体功能障碍、持续DNA损伤灶以及包括衰老相关异染色质灶形成的表观遗传重塑。此外,转座子可以在衰老细胞中产生,并重新插入衰老细胞DNA中,从而促进细胞衰老表型并使其SASP表达增加。
尽管衰老细胞可能产生短暂的有益作用(框2),但随着年龄的增长,它们会在几乎所有组织中慢慢积累,从而造成有害的后果。目前,促进局部组织功能障碍或在远端产生有害作用所需最少衰老细胞的数量还是未知的。但是,目前我们了解到衰老灵长类动物皮肤中衰老细胞的相对丰度较低(例如10-15%),并且将少量衰老细胞移植到年轻的小鼠中也足以引起组织功能障碍。减少衰老细胞负担的策略包括靶向抗凋亡调控网络、减少炎性SASP及通过遗传方法激活转基因动物中由p16INK4a或p21Cip1启动子驱动的凋亡信号来清除衰老细胞。
框1 衰老相关分泌表型(SASP)
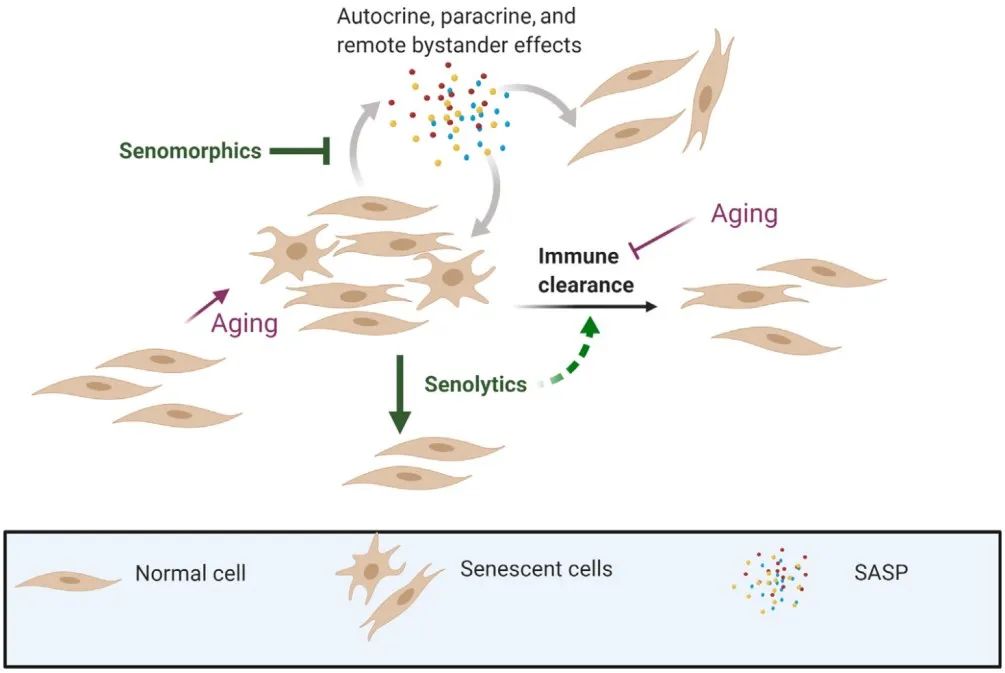
SASP由促炎性细胞因子、趋化因子和胞外基质降解蛋白组成,它们具有有害的旁分泌和系统性作用,包括诱导其他健康细胞衰老中起到从旁侧诱导的作用。SASP因子会根据衰老细胞的类型、衰老诱导因素、微环境信号及对其干预的方法而有所差异。通过使用糖皮质激素、雷帕霉素、二甲双胍、逆转录酶抑制剂(例如拉米夫定)或者JAK1/2抑制剂可以对SASP进行调控。在不同的干预类型中,并非SASP的所有成分都被下调。细胞特异性SASP因子的鉴定可以提供衰老细胞的独特特征,这些特征可以用作靶标和临床干预替代其他生物标志物。由于未能清除衰老细胞,与可以间歇给药以减少衰老细胞的senolytic不同,SASP抑制剂、senomodulators或senostatic等通过调节或抑制SASP的药物,需要更规律的定期给药
框2 细胞衰老潜在的有益作用
细胞衰老是一种抑制肿瘤的机制,但在伤口愈合以及发育中(即胚胎发生)可能还有其他有益的生理作用。与随着年龄的增长而缓慢积累的衰老细胞相反,其他衰老样细胞可能在重塑中起短暂的作用,并通过免疫系统将其除去。在限制继发于肝损伤的纤维化反应以及通过诱导细胞可塑性和促进组织再生,从而促进干细胞功能中,衰老也可能是有益的。胰腺β细胞中p16Ink4a的激活可促进葡萄糖刺激的胰岛素释放,这使在糖尿病小鼠中可以更好地控制葡萄糖。SASP还可能通过自分泌反馈回路促进癌症前期细胞的衰老及生长阻滞。它也可能通过旁分泌机制诱导临近的非癌细胞(但能够分裂)的衰老,这种机制可防止相同的应激源增加恶性转化的风险。衰老的影响可能是特异性和多效性的,因此,间歇性清除衰老细胞可能有助于避免靶向短期内有益的细胞
清除衰老细胞的遗传模型
给药(AP20187)后,“自杀”转基因INK-ATTAC可以诱导消除p16Ink4a阳性的衰老细胞(图2),即使是所占比例相对较小的衰老细胞(约减少30%),进而延长早衰及正常衰老小鼠的健康寿命,并可防止多种年龄相关疾病的发展。利用p16Ink4a启动子驱动的ATTAC“自杀”转基因小鼠(图2)可以评估p16Ink4a驱动的细胞衰老在介导年龄相关表型中的作用。
目前的衰老细胞清除模型仅限于小鼠。然而,大鼠在老年科学研究方面有着巨大的潜力,因为它的衰老生理比小鼠更接近人类(特别是在某些与年龄有关的疾病的发病方面),此外,它更大的尺寸允许连续的采样和成像研究,这在小鼠中是不可行的。大鼠尤其利于认知行为、内分泌(例如葡萄糖耐量)、肌肉和心血管端点的测量,并且有着大量的随年龄发生的生理变化历史数据。随着大鼠基因修饰技术的进步,目前是有可能建立大鼠衰老细胞清除模型的。例如,可以制造一种可以选择性去除p16Ink4a阳性细胞的大鼠模型,使用该模型得到的结果能更准确地模拟细胞衰老(及其消除)对人体生理的影响。
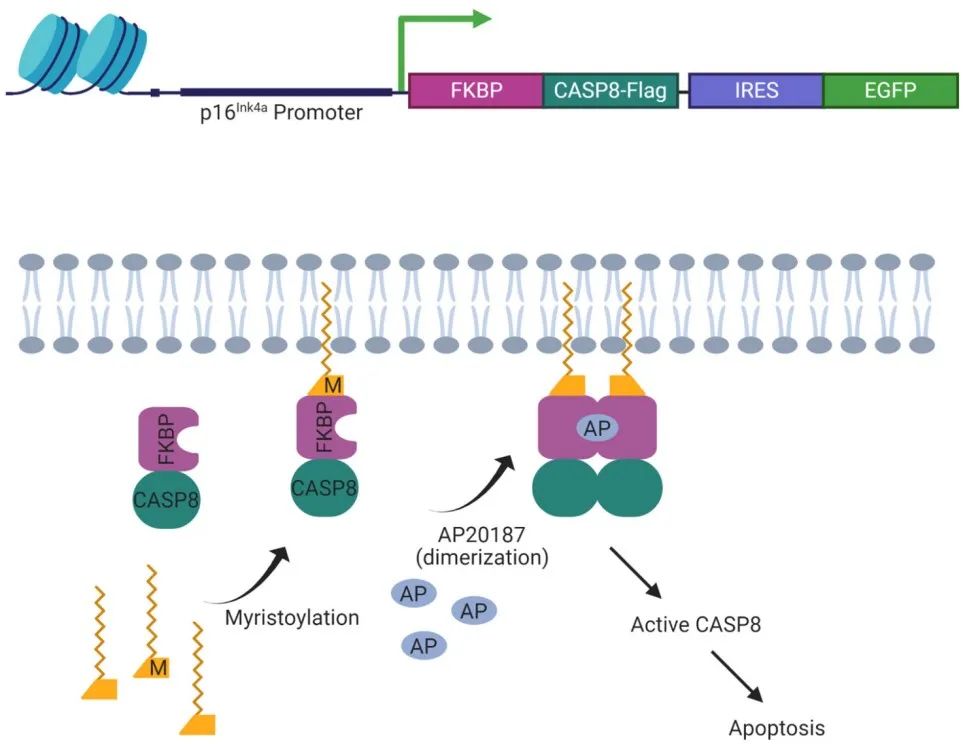
上图:INK-ATTAC结构示意图。下图:INK-ATTAC小鼠给药AP20187后p16Ink4a阳性衰老细胞的凋亡激活机制。由FK506结合蛋白(FKBP)和caspase 8 (CASP8)组成的融合蛋白是由衰老细胞中p16Ink4a启动子的转录活性元件驱动的。小分子化合物(AP20187)导致FKBP-CASP8形成二聚体,并导致p16Ink4a阳性衰老细胞发生caspase依赖的凋亡。通过增强绿色荧光蛋白(EGFP)等标记完成对p16Ink4a阳性衰老细胞的监测。通过内在核糖体进入位点(Internal ribosome entrysites, IRES)提高了对荧光报告基因产物如EGFP的检测。图基于Baker等人首次报道改编。
降低衰老细胞负担的药物
虽然上述清除衰老细胞的遗传学方法可以通过降低衰老细胞及衰老相关分泌表型的负担而延长寿命,但若想将衰老细胞清除方法应用于人类还需要依赖于抗衰老药物的研发(尽管抗衰老药物的研发是早于并独立于转基因小鼠相关研究的)。根据作用机理(促进衰老细胞死亡或正常化衰老相关分泌表型),这些药物被分为了衰老抑制剂(senolytics)和SASP抑制剂(图3)。
衰老细胞可以抵抗凋亡刺激,可通过提高其抗凋亡防御能力而增加其存活的可能性(框3)。在某些方面,衰老细胞与不分裂的癌细胞十分相似,如凋亡抵抗和代谢表型变化。事实上,许多一代抗衰老药物曾被用于癌症治疗,生物类黄酮是另一些抗衰老药物。衰老抑制剂已经在临床前模型中被用于预防、延缓和改善一些老年性疾病和综合征。理论上,靶向不同凋亡抵抗途径衰老抑制剂的联合应用能够清除更多衰老细胞及多种衰老细胞亚型。第一代衰老抑制剂达沙替尼和槲皮素的联合应用就是一个例子。达沙替尼是一种口服的SRC家族蛋白酪氨酸激酶小分子抑制剂,曾被用于治疗费城染色体阳性的慢性粒细胞白血病患者。槲皮素是一种存在于许多食物中的生物类黄酮和抗氧化剂。
在改善年龄相关表型方面,利用Janus激酶/信号转导和转录激活(Janus kinase/signal transducer and activator of transcription,JAK/STAT)抑制剂减弱衰老相关分泌表型的方法与利用遗传学方法(例如使用INK-ATTAC小鼠)或衰老抑制剂(senolytics)清除衰老细胞的方法十分类似。单次剂量或间断多次剂量的衰老抑制剂使用似乎或多或少都能改善年龄或衰老相关症状,但是SASP抑制剂不具有这种效果,因为SASP抑制剂不能清除衰老细胞。这可能与衰老细胞被清除以后重新积累需要时间有关。基于蝾螈肢体再生及博莱霉素诱导的幼鼠衰老等研究,衰老细胞的更替大约需要4周时间。因此,间歇性地使用衰老抑制剂可能是有效降低副作用的合理方法。因为衰老细胞不能复制,所以耐药性似乎不太可能。在年轻个体中,衰老细胞能够被宿主免疫系统清除。因此,在某种程度上,衰老细胞的清除可以进一步优化,因为衰老抑制剂也可以延缓免疫衰老或降低非免疫的衰老细胞对免疫细胞功能的不利影响(图3)。
衰老抑制剂能够有效地治疗直接或间接由衰老细胞积累而引起的各种疾病和现象,包括老年群体中高发病率、提前衰老(如儿童癌症幸存者、骨髓移植幸存者、早衰综合症、肥胖引起的糖尿病、人类免疫缺陷病毒相关痴呆、卵巢早衰)、局部细胞衰老(如骨关节炎,青光眼、黄斑变性、骨不连、放疗引起的旁观者效应、特发性肺纤维化、慢性阻塞性肺疾病和烟草相关性肺损伤、动脉粥样硬化、子痫前期、高氧致新生儿肺损伤和气道高反应性),以及衰老综合征。另外,发病机制与衰老细胞高负荷有关的致死性疾病也可以采用衰老抑制剂治疗(如特发性肺纤维化、原发性硬化性胆管炎)。衰老抑制剂也可以预防性地用于可能产生衰老细胞的临床刺激,如化疗、放疗、择期手术、骨髓移植、心肌梗死后康复、低氧复氧,以及其他与动静脉瘘血液透析相关的刺激。
小规模试点临床研究的早期结果表明,用衰老抑制剂清除衰老细胞的副作用较小。但是一代抗衰老药达沙替尼的使用仍然有很多禁忌,如QTc间隔大于450ms,肝功能不全,与CYP3A4抑制剂、CYP3A4诱导剂、解酸剂、H2拮抗剂/质子泵抑制剂的相互作用,以及许多完整处方中的其他注意事项。在用于抗癌作用时的剂量和频次下,达沙替尼会引起骨髓抑制、出血相关症状、液体潴留、心血管疾病、肺动脉高压、QT延长、严重皮肤反应、细胞溶解综合征和胚胎毒性,但是这些副作用是否会出现在达沙替尼用于清除衰老细胞时还未可知。同样,一代衰老抑制剂槲皮素也有潜在的药物相互作用(如与CYP3A4的强抑制剂)和常见副作用(如头痛),但是这些副作用在间歇性给药时的情况也还未知。
正在进行的临床试验主要在解决安全性和衰老细胞的靶向性问题,并期望深入研究衰老抑制剂的疗效。目前,亟需大规模的临床试验研究来更好地了解衰老抑制剂作为治疗干预措施的潜力,并更全面地评估其脱靶效应。目前临床试验的局限性包括招募规模小,缺乏适合老年人的可测量的临床相关指标,以及缺乏遵循药代动力学、药效学等可作为替代终点的生物标志物。
框3 凋亡抵抗网络
衰老细胞的凋亡抵抗网络包括ephrins/dependence receptors、PI3K/AKT、Bcl-2(Bcl-xl、Bcl-2、Bcl-w)、p53/FOXO4/p21/Serpine(PAI-1&2)、HIF-1α和HSP90。根据凋亡抵抗途径的不同,衰老抑制剂靶向不同的衰老细胞亚型。例如,达沙替尼与含有dependence receptors、Src和酪氨酸激酶的凋亡抵抗途径作用,靶向衰老的原代前脂肪组织细胞(如脂肪源性干细胞);槲皮素干扰含有Bcl-2家族、p53/p21/Serpine和PI3K/AKT的凋亡抵抗网络,靶向衰老的内皮细胞和间充质干细胞。联合使用以后,达沙替尼和槲皮素不仅分别靶向各自的衰老细胞亚群,还对衰老的肺和胚胎成纤维细胞起作用。
结论
目前正在探索针对主要衰老过程的多种干预措施。其中一个重要的衰老过程即衰老细胞的负荷,它可以在临床前水平通过遗传和药理学手段被靶向针对,而如今已经有了许多该方面的重大发现推动衰老医学的发展。许多有前景的药物干预手段转化为衰老治疗药物并进入了评估安全性和靶向性的阶段,这些药物应用于临床的未来挑战主要包括临床试验设计的优化、招募有风险或疾病的老年人、生物标志物的发现以及在减轻细胞衰老相关疾病方面有效性的证明。
衰老细胞负担的减少很可能改变临床实践,尤其是衰老医学。老年人临床试验的主要终点很可能包括客观和主观两个方面的生理功能,因为这些因素可以预测发病率和死亡率,有助于评估认知能力下降和受伤的风险,还是老年综合症的主要组成部分,也符合在短期内可检测的明显改善指标。
大型临床试验、多样本中多分析物的变化检测,以及在单一研究和不同研究中生物标志物的可行性和实用性的重复验证,都将促进生物标志物的发现。从长期来看,利用基于减少衰老细胞负荷的干预措施和衰老进程的其他干预措施,来评估慢性疾病和衰老综合征的发病延迟与发病率下降是可能的。
悬而未决的问题
(1)衰老细胞是否存在任何有益的功能,如在组织愈合过程中创造炎症环境?
(2)衰老细胞负荷一旦超过组织特异性的阈值,会促进组织功能障碍和全身有害的旁观者效应吗?
(3)衰老细胞的清除是否会减少其他衰老过程的影响?
(4)以怎样的频率使用“senolytic”类药物能有效减少衰老细胞负担?
(5)如何设计衰老药物的组合应用来优化衰老细胞的清除?
(6)调节免疫系统能与衰老药物协同促进衰老细胞清除吗?
(7)“senolytic”类药物是否能与特定疾病的治疗产生协同作用以产生更多的有益效果?
(8)旁分泌和其他旁观者效应是否是衰老细胞积累产生病理生理后果的主要机制?
(9)免疫清除机制是否对不同衰老细胞有相同的可及性?



原标题:《【学术前沿】衰老干预研究进展——清除衰老细胞》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




