- +1
同时激活T细胞和NK细胞,这个免疫靶点有望引领免疫治疗下一个十年
原创 奇点糕 奇点网

不过,当前免疫疗法带来的持久临床益处只发生在一小部分患者身上[1],还有很多患者不能从中获益,这说明一定还有其他的机制限制了肿瘤内的免疫反应。
近年来,科学家已经陆续发现了很多免疫抑制信号通路。临床前的研究也证实,同时阻断多个免疫抑制通路,可以增强抗肿瘤免疫力。更重要的是,在临床研究中,PD-1/PD-L1抑制剂联合CTLA-4抑制剂[2,3],已经在多个癌种中表现出1+1>2的组合效应。
这些研究都表明,不同的免疫抑制性信号通路在功能上是相互独立的,不冗余。因此,新的免疫抑制性分子让人充满期待。
实际上,时至今日,很多人都在暗自揣摩:在二十一世纪的第三个十年,哪个新靶点更有希望成为免疫治疗最凶猛的“后浪”。
在奇点糕看来,近年来颇受关注的TIGIT,极有可能是免疫治疗下一幕大戏的主角。
为什么这么说呢?这事儿咱们还得从头说起。
什么是TIGIT
2008年,任职于基因泰克的科学家Jane L Grogan率领她的团队,打算在已经激活的T细胞中寻找还没有被发现的共刺激或者抑制分子[4]。
他们在基因泰克的同事于2005年构建的数据库[5]中搜寻,偶然发现了一个在T细胞和NK细胞中特异性表达的基因。这个基因编码的蛋白由细胞外的免疫球蛋白(IgV)结构域,I型跨膜结构域,以及细胞内的免疫受体酪氨酸抑制基序(ITIM)共同组成[4]。
基于这个基因编码的蛋白信息,Grogan和她的同事就将这个蛋白命名为TIGIT(T cell immunoglobulin and ITIM domain,T细胞免疫球蛋白和ITIM结构域)[4]。这也就是备受关注的TIGIT名字的最初来源。
在这个研究中,Grogan团队还发现TIGIT是一个抑制T细胞活性的分子,它的高亲和力核心受体——脊髓灰质炎病毒受体(PVR),还可以称之为CD155[4]。
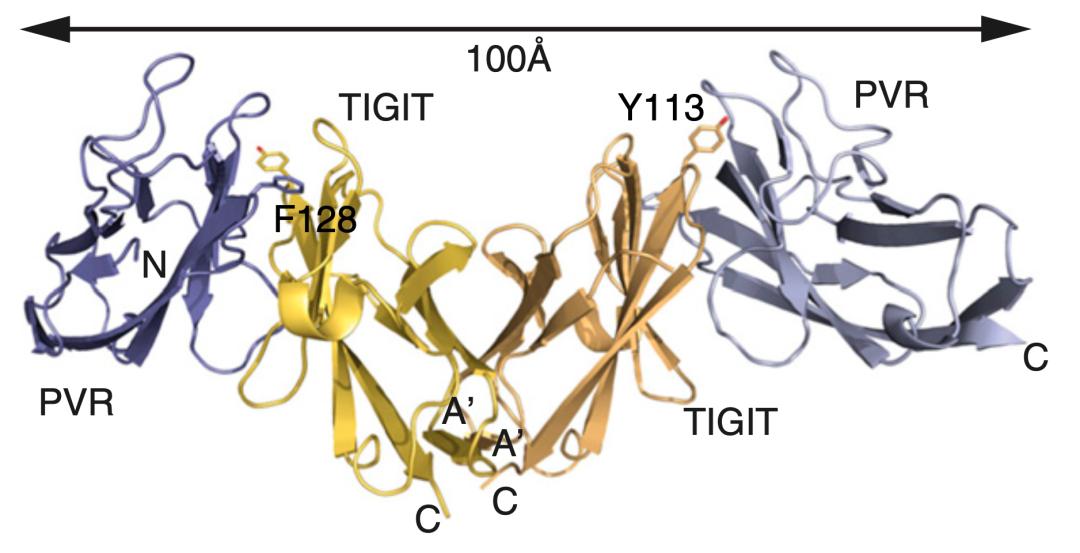
四年之后,Grogan团队又获取了PVR与TIGIT相互作用的晶体结构[6],从整体上看是个类似字母“M”的结构,两个TIGIT分子结合在一起居中,左右分别结合一个PVR分子,构成一个异源四聚体组合。
那TIGIT究竟是如何调节T细胞和NK细胞的抗癌活性的呢?咱们先看看TIGIT对T细胞的影响。
TIGIT是PD-1/PD-L1通路的同伙
一直以来,激活杀伤性T细胞的抗肿瘤反应是大多数免疫治疗的主要目标,因为科学家认为,杀伤性T细胞的活化是完全消灭癌细胞所必需的条件。
因此在2014年,Grogan团队在人类血液样本、非小细胞肺癌组织样本和荷瘤小鼠模型上,研究了TIGIT与抗肿瘤杀伤性T细胞(CD8+ T细胞)功能之间的关系[7]。
研究人员发现,与健康人外周血单个核细胞(PBMC)相比,非小细胞肺癌患者PBMC中的CD8+ T细胞TIGIT表达水平提高三倍,肿瘤浸润CD8+ T细胞的TIGIT表达水平提高四倍。
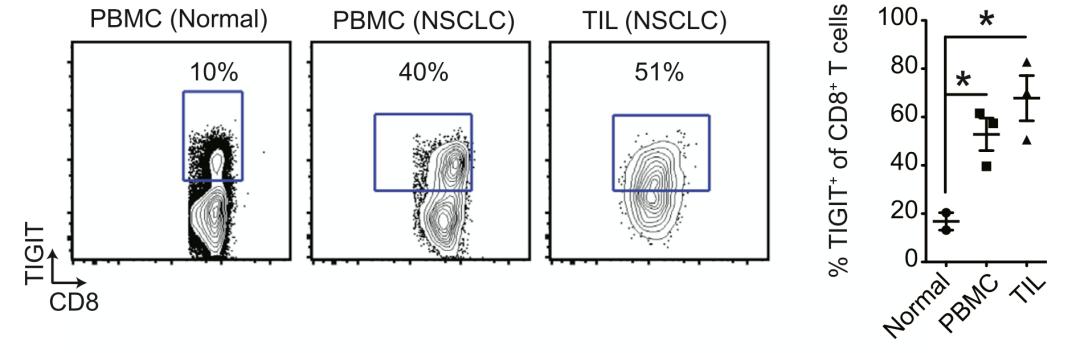
而且研究人员还发现,在肿瘤浸润CD8+ T细胞中,仅耗竭性T细胞的TIGIT表达量明显升高,且和PD-1的表达量变化同步。这就意味着TIGIT与PD-1/PD-L1通路对肿瘤浸润CD8+ T细胞有协同抑制作用。
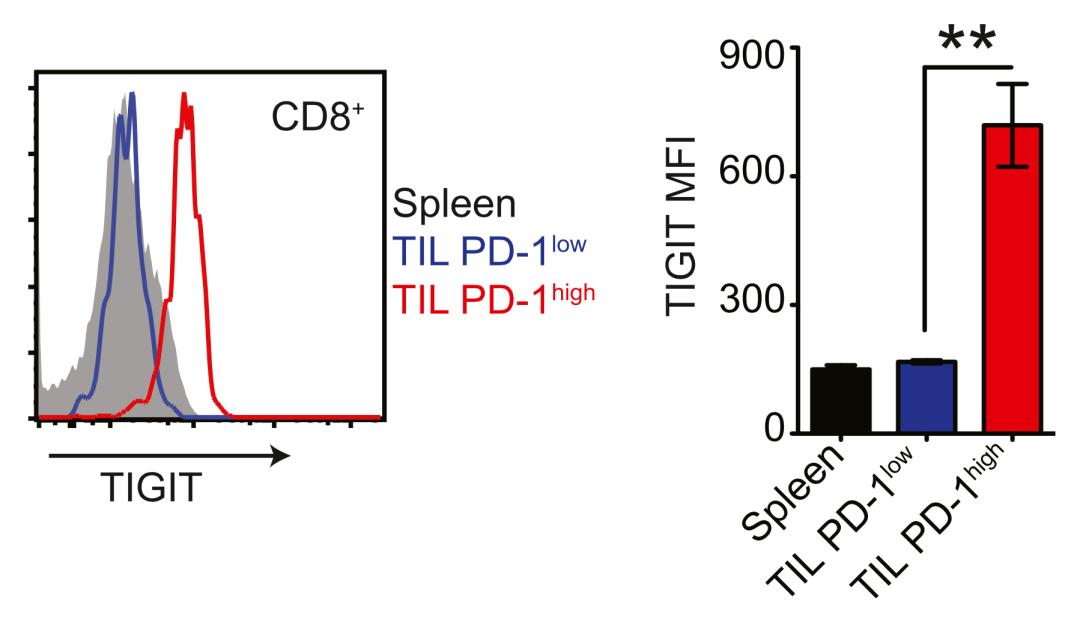
为了检验TIGIT与PD-1/PD-L1通路之间的协同抑制效果,Grogan团队又在荷瘤小鼠身上研究了分别或同时阻断TIGIT和PD-1/PD-L1通路的抗癌效果。
从结果看,相比于分别单独阻断TIGIT与PD-1/PD-L1通路,同时使用抗TIGIT抗体和抗PD-L1抗体的抗癌效果显著更好,肿瘤体积缩小和小鼠生存时间改善明显。
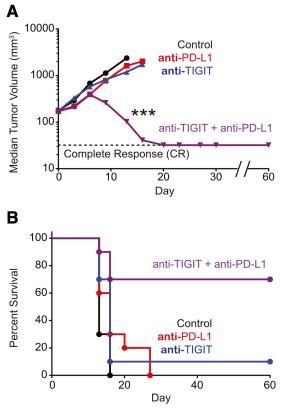
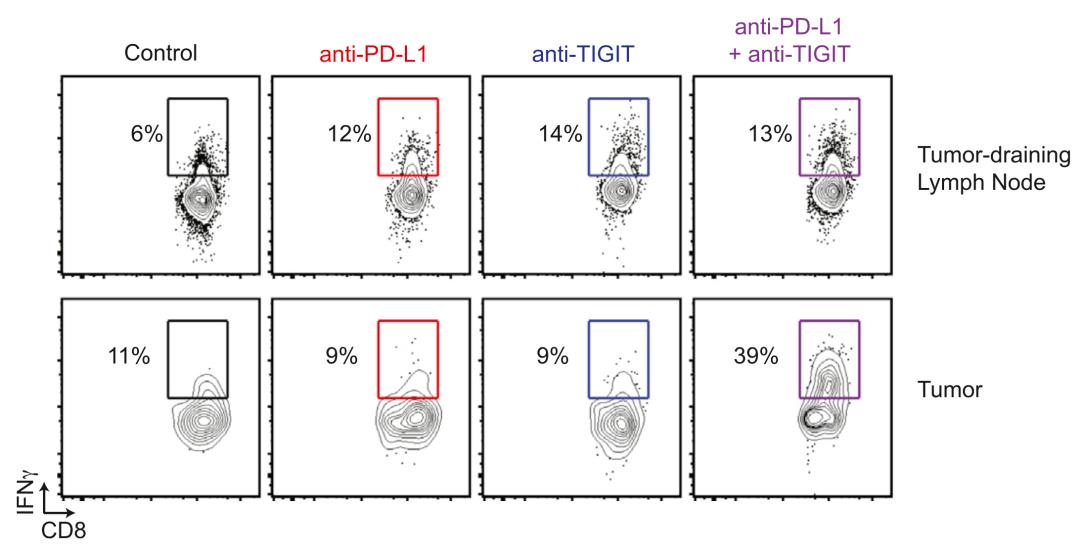
究其背后原因,是抗TIGIT抗体联合抗PD-L1抗体改善了肿瘤浸润CD8+ T细胞的效应功能,让产生IFNγ和TNFα的肿瘤浸润CD8+ T细胞水平增加数倍。
这就意味着,抗TIGIT抗体和抗PD-L1抗体的联合使用,能逆转肿瘤浸润CD8+ T细胞的耗竭状态,恢复其杀伤癌细胞的能力。即,抗TIGIT抗体与抗PD-L1抗体之间存在协同作用。
Grogan团队的研究成果不是证实TIGIT是免疫抑制分子的孤例。在2016年,宾夕法尼亚大学医学院和北京地坛医院的研究人员通力合作,在急性髓性白血病(AML)患者群体中分析了TIGIT表达与T细胞耗竭和患者预后之间的关系[8]。
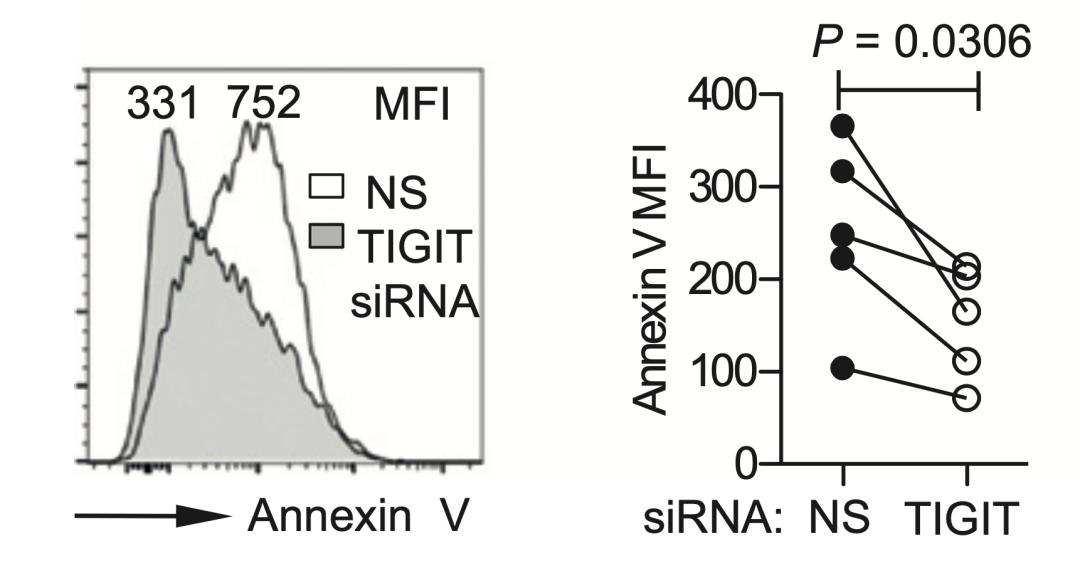
在这项研究中,研究人员发现,对比不表达TIGIT的CD8+ T细胞,表达TIGIT的CD8+ T细胞产生TNFα、IFNγ和IL2水平显著降低,而代表细胞进入耗竭状态的标志物Annexin V和CD95的表达显著升高。
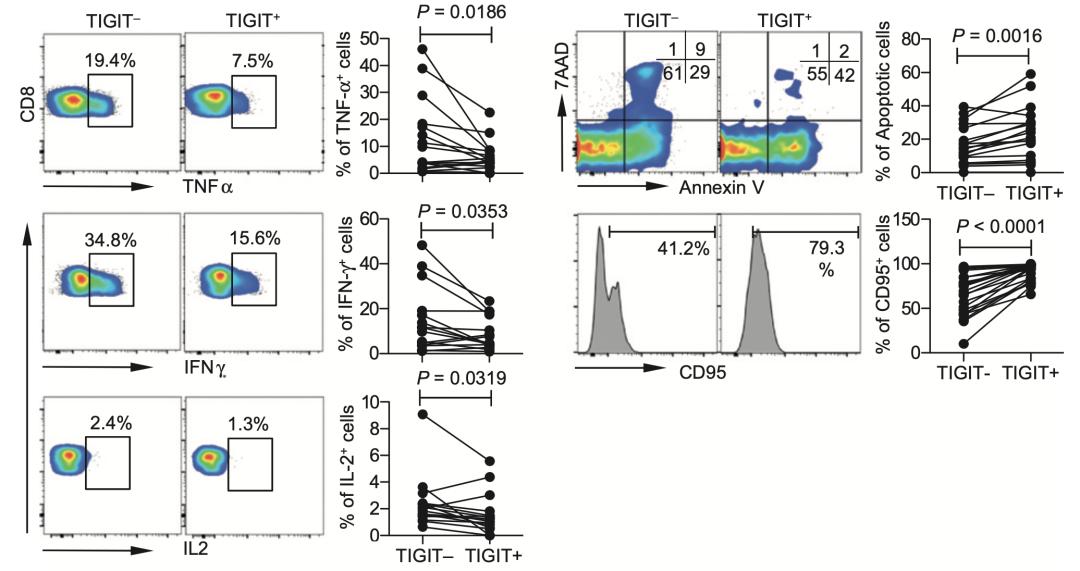
用siRNA敲低CD8+ T细胞的TIGIT的话,TNFα、IFNγ和IL2水平显著回升,而细胞耗竭标志物Annexin V和CD95的表达水平则显著下降。
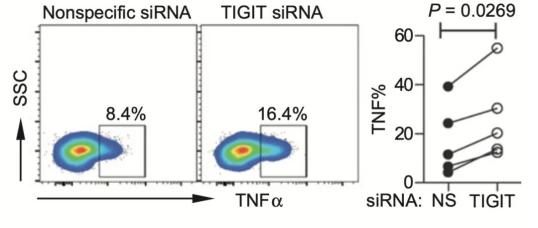
通过以上的研究我们不难发现,TIGIT的表达与CD8+ T细胞的耗竭密切相关,阻断TIGIT信号通路,能在一定程度上逆转CD8+ T细胞的耗竭。
不过,TIGIT对抗肿瘤免疫反应的影响远远不止抑制CD8+ T细胞的抗肿瘤活性。因为,近年来的研究表明,TIGIT对NK细胞的抑制作用,有可能也是抗肿瘤免疫抑制的关键。
TIGIT对NK细胞的影响
在T细胞占据免疫治疗舞台中央的今天,很少有人关注NK细胞在免疫治疗中的重要性。
实际上,NK细胞杀死癌细胞释放肿瘤特异性抗原,是启动免疫反应至关重要的一步。
正如前面所介绍的那样,早在2008年,Grogan团队就已经发现TIGIT在NK细胞表面高表达[4]。随后的研究发现,肿瘤细胞表面表达的PVR分子,可以与NK细胞表面的TIGIT结合,给NK细胞下达抑制性信号,导致NK细胞杀伤癌细胞的功能降低[9,10]。
这说明TIGIT也是NK细胞表面的一个抑制分子。
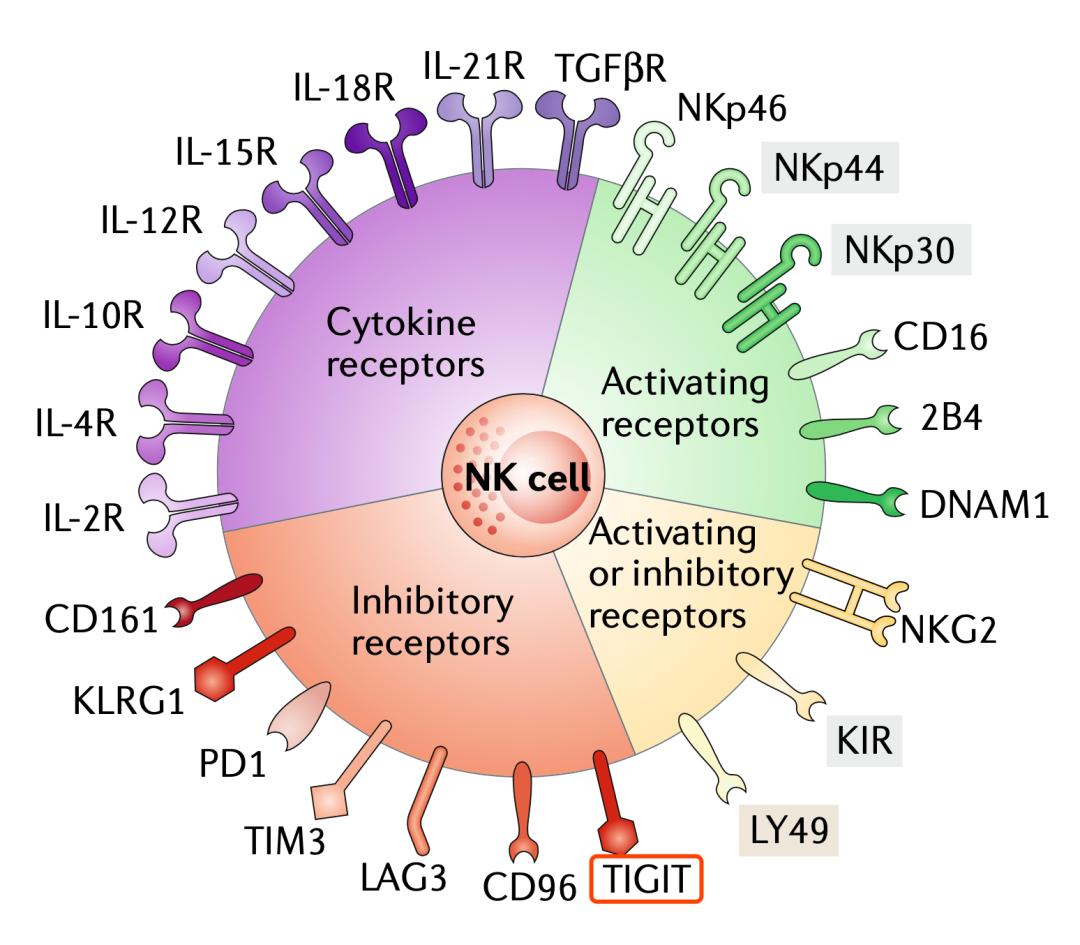
不过,NK细胞表面的TIGIT对抗肿瘤免疫的影响可能远不止于此。
在2018年,中国科学技术大学田志刚和孙汭团队有一个重要的发现。
研究人员首先发现,耗竭表型的NK细胞大量表达TIGIT而不是PD-1,无论是敲除编码TIGIT的基因,还是用抗TIGIT抗体抑制TIGIT,都能增加NK细胞表达CD107a和肿瘤坏死因子等抑癌因子的水平,增强NK细胞的抗癌能力,延长荷瘤小鼠的生存时间[11]。
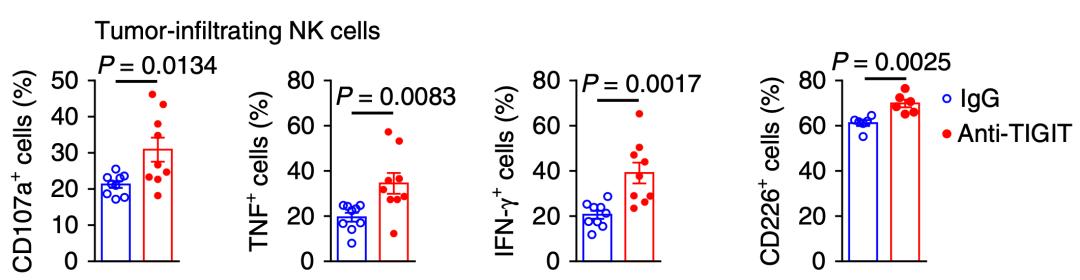
让研究人员感到惊喜的是,特异性的敲除NK细胞里面的Tigit基因后,不仅逆转了NK细胞的耗竭状态,甚至连肿瘤里面表达PD-1的杀伤性T细胞也显著减少。这说明,T细胞的耗竭与NK细胞的耗竭密切相关。
随后的研究更让人吃惊。如果定向清除小鼠体内的NK细胞,那么无论是抗TIGIT抗体,还是抗PD-L1抗体,甚至是两个抗体联合使用,治疗癌症的效果都严重下降。
具体到背后的原因,科学家发现,相比于NK细胞存在的抗TIGIT抗体联合抗PD-L1抗体,在NK细胞不存在的情况下,这个联合疗法导致耗竭的CD8+ T细胞更多,处于激活状态的CD8+ T细胞水平更低。
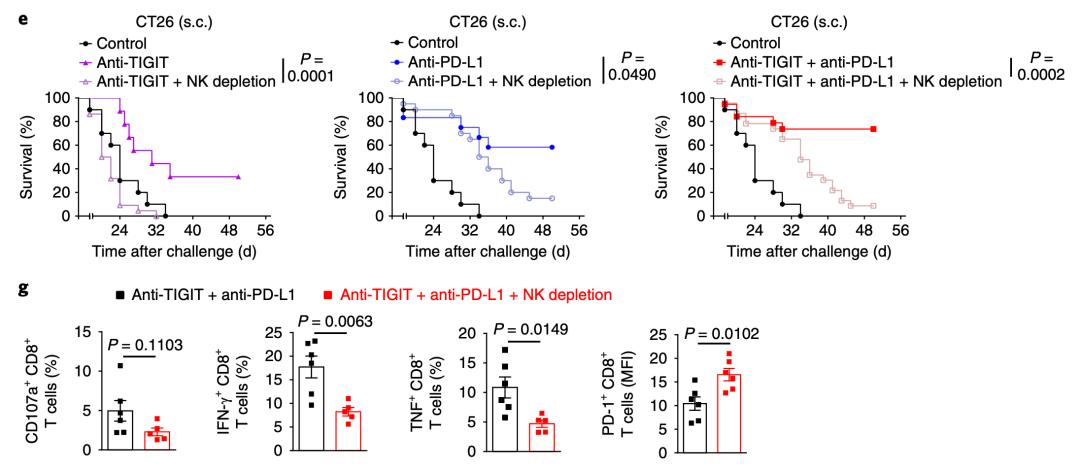
以上结果说明,TIGIT的表达与NK细胞密切相关,抑制TIGIT可以恢复NK细胞的抗癌活性。更重要的是,抗PDL1与抗TIGIT的治疗效果依赖于NK细胞的存在。
这也在一定程度上也是PD-1/PD-L1抑制剂联合TIGIT抑制剂,在临床前研究中表现出更好抗癌效果的原因。
通过以上的介绍,我们不难看出,用抗TIGIT抗体阻断TIGIT/PVR信号通路,能达到同时解除肿瘤对肿瘤浸润性CD8+ T细胞和NK细胞的抑制,真可谓一箭双雕。
实际上,随着对TIGIT信号通路研究的深入,研究人员发现,TIGIT对抗肿瘤免疫的影响不止T细胞和NK细胞,还有提呈抗原的树突状细胞,具有免疫抑制性的调节性T细胞(Treg)等。
具体而言,有三重机制[12]:第一,肿瘤细胞或树突状细胞的PVR与肿瘤浸润CD8+ T细胞和NK细胞表面作为受体的TIGIT结合,直接抑制二者的活性;第二,TIGIT还可以作为配体,肿瘤浸润CD8+ T细胞和Treg上的TIGIT配体,与肿瘤细胞或树突状细胞的PVR受体结合,会促进IL-10等抗炎因子的产生,抑制免疫反应;第三,肿瘤浸润CD8+ T细胞表面的TIGIT竞争性与肿瘤细胞或树突状细胞的PVR结合,导致T细胞激活受体CD226不能与PVR结合,进而抑制T细胞活性。
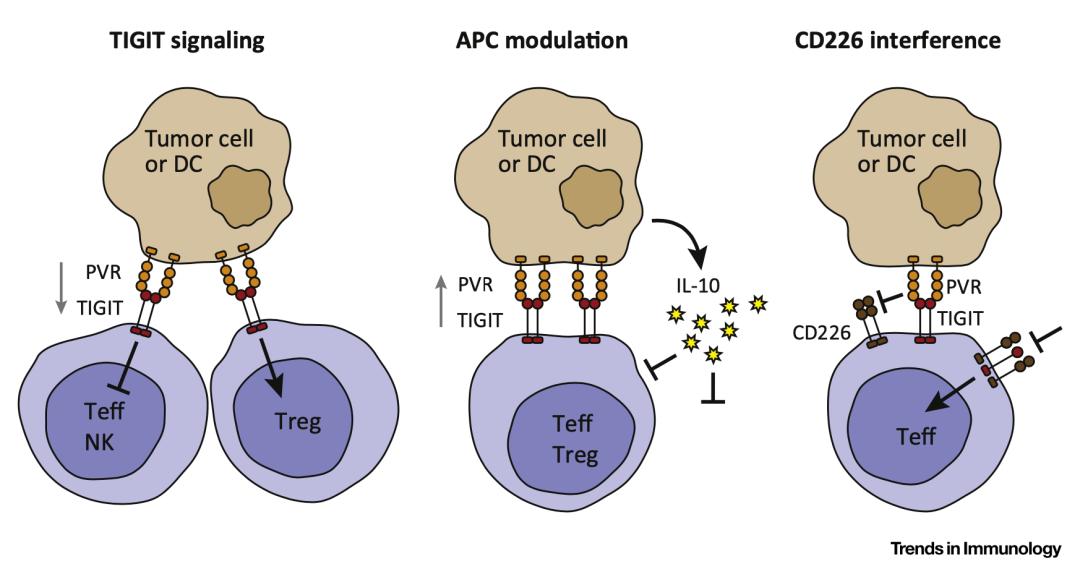
既然TIGIT作用于那么多免疫相关细胞,那么靶向TIGIT的抗体治疗效果究竟如何呢?
TIGIT抑制剂的抗癌效果让人期待
在刚刚闭幕的2020年美国临床肿瘤学会(ASCO)年会上,抗TIGIT抗体Tiragolumab联合阿替利珠单抗(Atezolizumab)一线治疗PD-L1阳性非小细胞肺癌患者的随机、双盲、安慰剂对照II期临床研究CITYSCAPE数据发布[13],该研究的主要终点,即客观缓解率(ORR)和无进展生存期(PFS)均取得了阳性结果。
在中位随访10.9个月的时间里,Tiragolumab+阿替利珠单抗组患者的客观缓解率(ORR)为37%,中位无进展生存期(mPFS)是5.55个月;安慰剂+阿替利珠单抗的这两个数据分别是21%和3.88个月。
探索性分析PD-L1 TPS≥50%的亚组数据发现,Tiragolumab+阿替利珠单抗组比安慰剂+阿替利珠单抗组疾病进展或死亡风险降低了70%,mPFS分别为未达到和4.11个月,相应的ORR分别为66%和24%。
总的来说,与安慰剂+阿替利珠单抗相比,Tiragolumab+阿替利珠单抗能显著提高患者的ORR和PFS,PD-L1 TPS≥50%的亚组的改善幅度更大;此外,两种治疗方式的安全性相似。
CITYSCAPE研究的成功,与前文介绍的作用机制相互印证,说明TIGIT不仅是一个免疫抑制分子,而且还与PD-1/PD-L1通路有协同作用。因此,同时抑制TIGIT和PD-1/PD-L1才表现出1+1>2的效果。
据了解,鉴于CITYSCAPE试验的优秀数据,在肺癌领域围绕抗TIGIT抗体tiragolumab的两项III期临床研究SKYSCRAPER-01(NCT04294810)和SKYSCRAPER-02(NCT04256421),也已经于今年年初开展。无论如何,这两项研究数据都让人满怀期待。
免疫治疗的未来
免疫治疗发展到今天,科学家和医生已经意识到,单凭单一的药物,几乎是没有可能战胜实体瘤的。
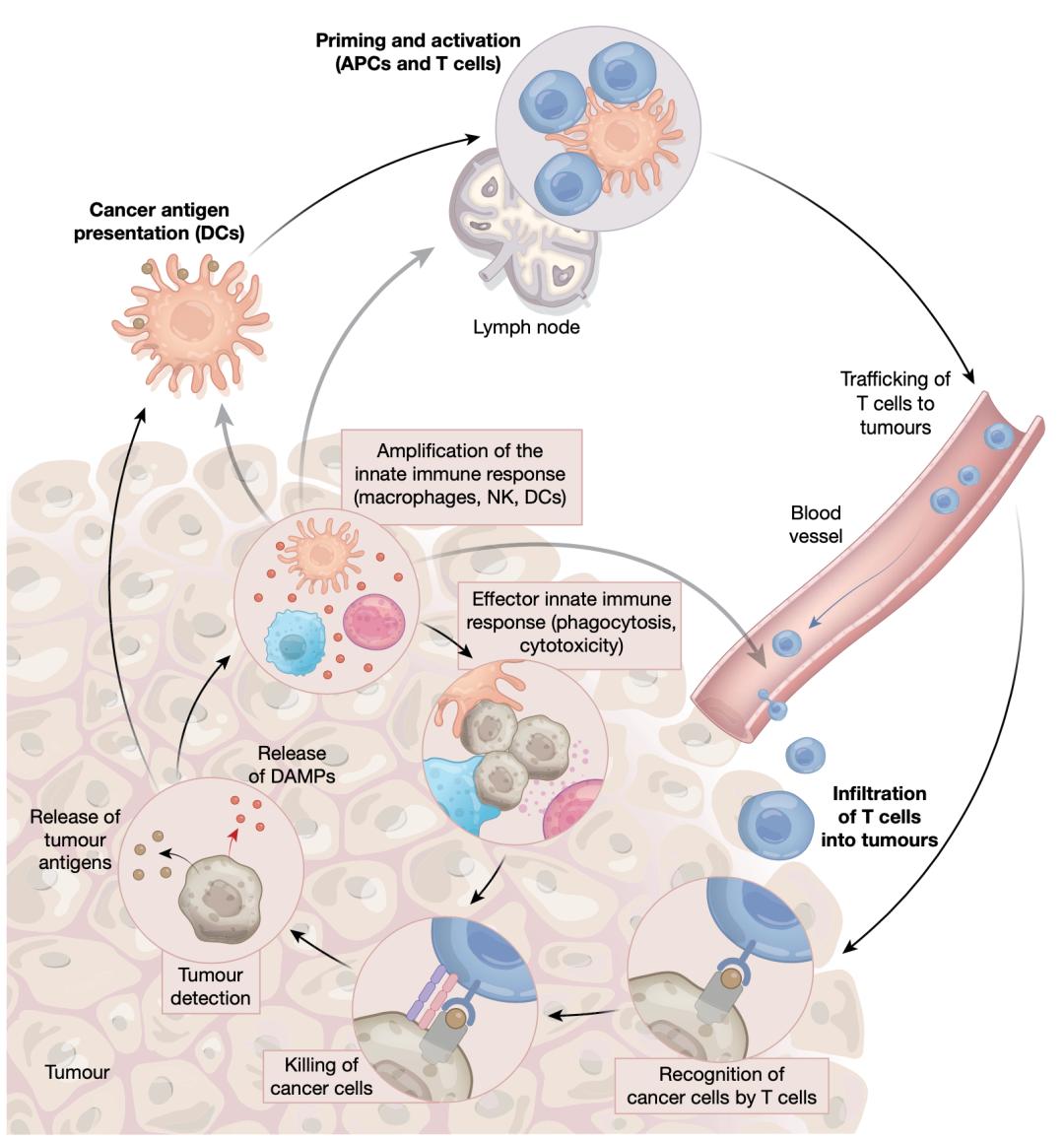
免疫治疗的未来必然是多种药物联合,无论是免疫药物联合放疗、化疗、靶药,还是免疫联合免疫,最终的目的都是要打通抗肿瘤免疫循环,激发更强大的抗肿瘤免疫反应,让患者从治疗中获得更多更持久的益处。
从这个角度看的话,参与到抗肿瘤免疫循环多个环节的TIGIT确实是一个能给人无限想象的新靶点。
或许TIGIT就是下一个十年引领潮流的后浪。
参考文献:
[1].Postow M A, Callahan M K, Wolchok J D. Immune checkpoint blockade in cancer therapy[J]. Journal of clinical oncology, 2015, 33(17): 1974.
[2].Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma[J]. New England journal of medicine, 2015, 373(1): 23-34.
[3].Hellmann M D, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus ipilimumab in advanced non–small-cell lung cancer[J]. New England Journal of Medicine, 2019, 381(21): 2020-2031.
[4].Yu X, Harden K D, Gonzalez L C, et al. The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells[J]. Nature Immunology, 2009, 10(1): 48-57.
[5].Abbas A R, Baldwin D T, Ma Y, et al. Immune response in silico (IRIS): immune-specific genes identified from a compendium of microarray expression data[J]. Genes and Immunity, 2005, 6(4): 319-331.
[6].Stengel K F, Harden-Bowles K, Yu X, et al. Structure of TIGIT immunoreceptor bound to poliovirus receptor reveals a cell–cell adhesion and signaling mechanism that requires cis-trans receptor clustering[J]. Proceedings of the National Academy of Sciences, 2012, 109(14): 5399-5404.
[7].Johnston R J, Comps-Agrar L, Hackney J, et al. The immunoreceptor TIGIT regulates antitumor and antiviral CD8+ T cell effector function[J]. Cancer cell, 2014, 26(6): 923-937.
[8].Kong Y, Zhu L, Schell T D, et al. T-cell immunoglobulin and ITIM domain (TIGIT) associates with CD8+ T-cell exhaustion and poor clinical outcome in AML patients[J]. Clinical Cancer Research, 2016, 22(12): 3057-3066.
[9].Stanietsky N, Rovis T L, Glasner A, et al. Mouse TIGIT inhibits NK‐cell cytotoxicity upon interaction with PVR[J]. European journal of immunology, 2013, 43(8): 2138-2150.
[10].Li M, Xia P, Du Y, et al. T-cell immunoglobulin and ITIM domain (TIGIT) receptor/poliovirus receptor (PVR) ligand engagement suppresses interferon-γ production of natural killer cells via β-arrestin 2-mediated negative signaling[J]. Journal of Biological Chemistry, 2014, 289(25): 17647-17657.
[11].Zhang Q, Bi J, Zheng X, et al. Blockade of the checkpoint receptor TIGIT prevents NK cell exhaustion and elicits potent anti-tumor immunity[J]. Nature immunology, 2018, 19(7): 723-732.
[12].Manieri N A, Chiang E Y, Grogan J L. TIGIT: a key inhibitor of the cancer immunity cycle[J]. Trends in immunology, 2017, 38(1): 20-28.
[13].Primary analysis of a randomized, double-blind, phase II study of the anti-TIGIT antibody tiragolumab (tira) plus atezolizumab (atezo) versus placebo plus atezo as first-line (1L) treatment in patients with PD-L1-selected NSCLC (CITYSCAPE).


本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




