- +1
人类肠道癌症精准治疗的新希望:可视化微米机器人
编辑│陈圆圆
审校│汤红明
【据《Science Robotics》2019年7月报道】题:基于光声断层成像技术实时控制微型机器人在体内肠道定向导航(作者Zhiguang Wu等)
随着纳米技术的发展,医疗机器人应运而生并不断趋于微型化。其中微/纳米级机器人以其尺寸小、穿透深、可载药等独特优势引起广泛关注,有望实现疾病诊断、靶向药物递送及精准微创手术等生物医学应用。然而,由于缺乏高分辨率的实时影像导航及控制手段,微纳机器人在机体深部进行实时监测定位、可控自主运动仍然是一大挑战和难题。因此,迫切需要一种能精确控制、靶向运动、滞留时间长且可持续释药的微型药物递送系统。
来自美国加州理工学院的Zhiguang Wu等近期有了可喜的新发现,他们构建了金包裹的Mg基肠道微米机器人,通过光声断层成像技术(PACT)引导,可以在体内实现实时影像监测、精确运动控制和药物靶向递送。在动物肠癌模型的治疗研究中,使用该机器人已取得较好的治疗效果。
这项研究主要解决了微米机器人在生物医学应用的两大难题:
一是成像,通过引入 PACT,研究者可实时追踪微米机器人在胃肠道中的位置,实现高分辨率和高对比度的光声成像和定位;
二是控制,一旦微米机器人到达肿瘤区域,连续近红外辐照可快速触发机器人自主运动开关,并激活喷气推动,双重控制其定向运动、黏附至肿瘤周围组织释药,有效延长了微米机器人在肠道中的滞留时间并提高药物释放精准性。
结合微米机器人与PACT两大新兴前沿技术,使机器人在体内能进行深层组织实时成像和精确控制,在生物医学应用中显示出巨大潜力和应用价值。
具体来说,微米机器人主体为镁金属球(直径约20μm),表面镀了一层薄薄的金属金和聚对二甲苯(抵抗胃酸消化),其间夹载抗肿瘤药物DOX构成复合微米机器人载药系统(如图)。镁金属球表面留有圆形区域未被镀层覆盖,这部分裸露的金属镁在肠道中发生镁-水反应产生气泡,推动微球前进,直到碰撞周围组织后停滞,有效提高了滞留时间和药物释放效率。此外,为了保护微米机器人免受胃部恶劣酸性环境的影响,将其封装在石蜡制成的微胶囊(MCs)中,当MCs到达病灶时施以连续近红外辐照,仅需0.1s由金引发的光热效应即可触发胶体相变引起MCs崩解进而释放微米机器人。这种可控性强、高效推进的激活方法为微米机器人提供了与靶向组织结合的机械驱动力,从而达到定点释放药物和延长滞留时间的目的,提高了治疗效果。
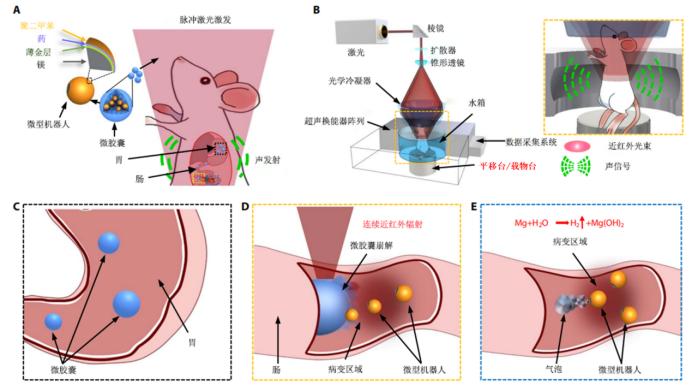
PACT可在深度7cm的组织内,对微米机器人进行高空间分辨率、高分子对比度的实时成像,实现深度追踪和精确定位。目前,PACT因其非入侵式、穿透深、高分辨率、高对比度等优点,广泛用于生物医学领域。在光声成像过程中,特定波长的激光照射生物组织,组织内发色团吸收的光子能量可转换为超声信号,随后被检测出形成具有高光学对比度和高分辨率的断层扫描图像。可以说PACT完美结合了光学成像的高选择性和超声成像的穿透深等优点,克服了传统光学成像在深层组织受光散射的阻碍,突破深度“软”极限(~1mm),实现高时空分辨率的深度成像;同时利用生物组织对光谱高选择性吸收的差异,能够实现高特异性、高对比度的分子水平成像。凭借以上优势,PACT有望在机体内实时监测、精准控制微米机器人,实现人体深层病灶如胃肠道肿瘤等疾病的靶向递药和精准治疗。
尽管目前PACT引导的微米机器人治疗效果已在小动物身上体现,但人类深部疾病可能需要数十厘米的组织穿透深度,而PACT因受光耗散限制只能提供最多7cm的组织穿透力,仍然是临床治疗的瓶颈。
小小机器人可以实现在人体胃肠道中实时成像、靶向递药和自主运动,这为下一代智能微纳机器人系统的研发、深部疾病的高精度微创治疗提供了新思路。同时,也给未来医学发展提供新的启示,微纳机器人研究的快速进步,尤其与先进的成像技术结合,不仅能从微观角度、分子水平进行疾病的诊疗,即使对单个细胞也能实现可视化精确操作,可为攻克肿瘤、血栓等机体深部疾病诊疗的难关提供新的机会和可能。
(本文来源于《医学参考报》干细胞与再生医学频道2020-01期第6版文章,ID:yxckbsc2020010602,图片来源于网络,如有侵权,请联系删除。)
《医学参考报》干细胞与再生医学频道
由同济大学附属东方医院承办
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




