- +1
【科技前沿】颜宁/杨洪远合作团队解析胆固醇进入细胞的分子机制
C型尼曼匹克氏症(Niemann-Pick disease type C,也称NPC) ,是一种跟溶酶体贮藏异常相关的遗传性神经退行性疾病,常常伴随着认知障碍,生理紊乱以及渐进性和致残性的神经症状。最新的研究表明,NPC疾病的总体发病率达到了1/19,000到36,000【1】。严重的病例通常出现在儿童,症状与老年痴呆很相似,所以NPC也叫儿童老年痴呆症,病患一般会在15岁之前死亡。NPC的致病机理是由于来自血浆低密度脂蛋白(LDL)的胆固醇堆积在溶酶体,无法进入细胞。NPC2和NPC1负责把胆固醇运送到溶酶体膜,然后胆固醇再通过胞浆到达质膜或内质网(图1)。在所有NPC疾病的突变基因中,NPC1基因突变约占95%,另外5%与NPC2关联。除了与NPC疾病相关,众多的研究还报道了NPC1与病毒入侵的关系。例如,埃博拉病毒会通过结合溶酶体上的NPC1而进入细胞【2,3】。HIV病毒也被发现与NPC1介导的胞内胆固醇转运分选相关【4】。新冠病毒是否能利用NPC1也是值得探索的。因此,解析NPC1和NPC2蛋白的分子结构对了解胆固醇稳态调控的机制和设计众多与胆固醇相关疾病的治疗方案非常重要,也有助于加深理解病毒是如何利用NPC1入侵人类细胞的过程。
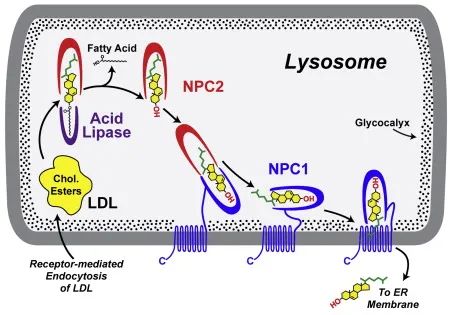
2020年6月15日,普林斯顿大学颜宁教授与新南威尔士大学杨洪远教授合作在Cell杂志上发表了题为Structural Basis of Low-pH-Dependent Lysosomal Cholesterol Egress by NPC1 and NPC2 的研究论文。该研究通过Cryo-EM技术对NPC相关蛋白进行了系统的结构解析,完整呈现了胆固醇从NPC2转运到NTD,然后转运到NPC1跨膜区的过程,并揭示了pH值对与NPC1结构和功能的影响。

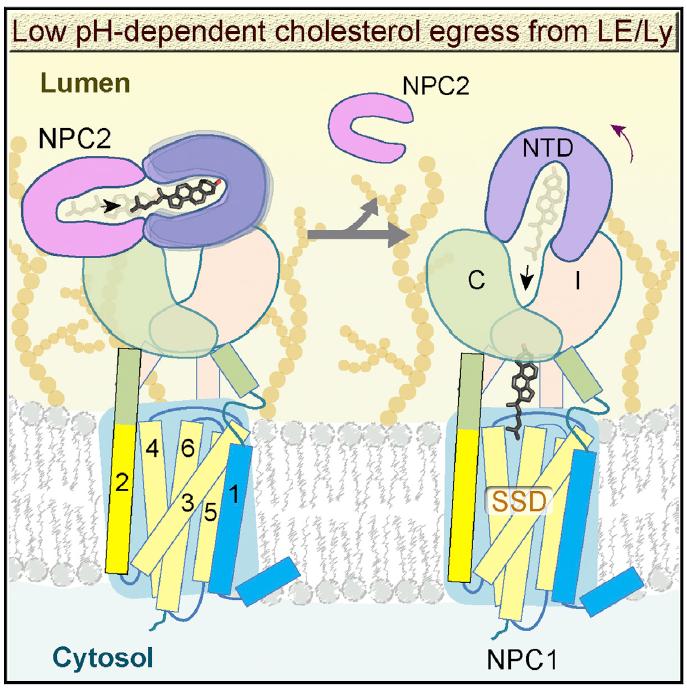
研究工作者首先解析了NPC1在pH 8.0条件下的高分辨率结构(3.0埃),这个结构可以为疾病突变提供了精确的定位,为后续研究疾病相关的突变提供了结构基础。同时在结构中发现了一个可以从NTD导向跨膜区的通道,这个通道位于domain C和domain I中间,由这两个结构域缠绕而成,也被称为中心通道(Central tunnel)。在同源蛋白Ptch1的结构中,也有一个相似的中间通道。中心通道在跨膜区的出口正好指向SSD结合胆固醇类分子的位点。这些发现暗示,胆固醇可能是通过中心通道从NTD转运到SSD,然后再释放到溶酶体膜上。
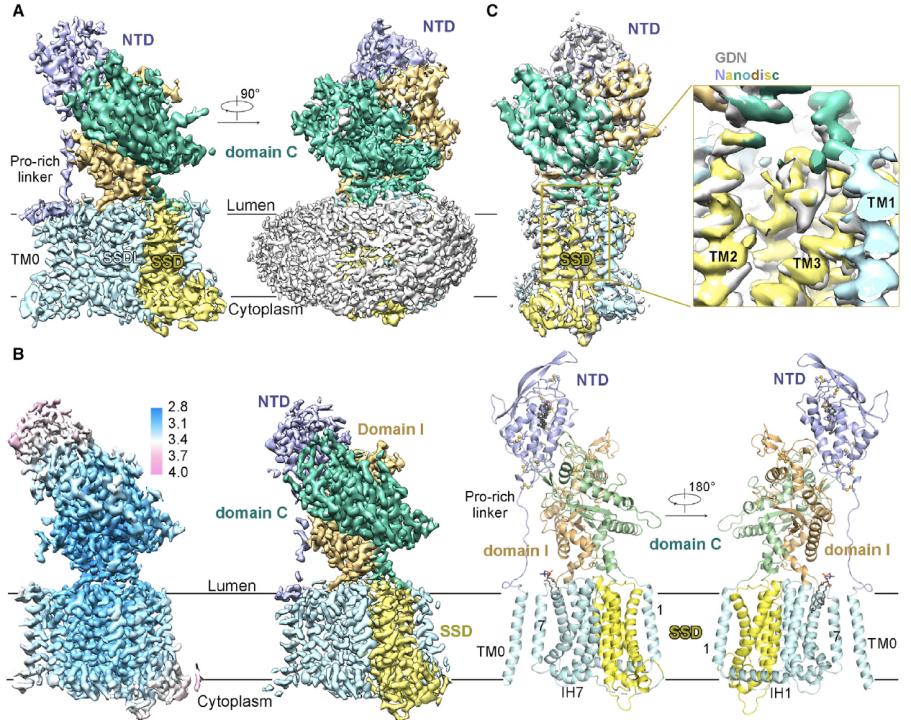
随后他们解析了NPC1在pH 5.5条件下的结构,在上述通道中发现了一个胆固醇分子,这进一步说明了胆固醇是可以在中心通道中被转运的。然后他们分析了胆固醇是如何从NTD中装载到中心通道里面的。通过精细的数据处理,作者们发现在pH 5.5条件下,NTD存在这两种构象状态(A和B)。在状态A中,NTD上胆固醇结合口袋的开口偏离中间通道,呈现出一种从NPC2接受胆固醇的构象。而状态B中,NTD上胆固醇结合口袋的开口更加接近于中间通道的入口,呈现出一种将要把胆固醇传递到中间通道的构象。通过对比这两个构象,可以近似呈现出NTD从NPC2接受胆固醇后是如何将其加载到中间通道的。到此,胆固醇从NTD到跨膜区的传递通道基本阐释清楚。
作者们还解析了在pH 5.5时,NPC1-NPC2的复合物结构,分辨率为4.0 Å (图3)。该复合物结构进一步揭示了胆固醇从NPC2被“手递手”地递送到NPC1-NTD过程的分子机制。
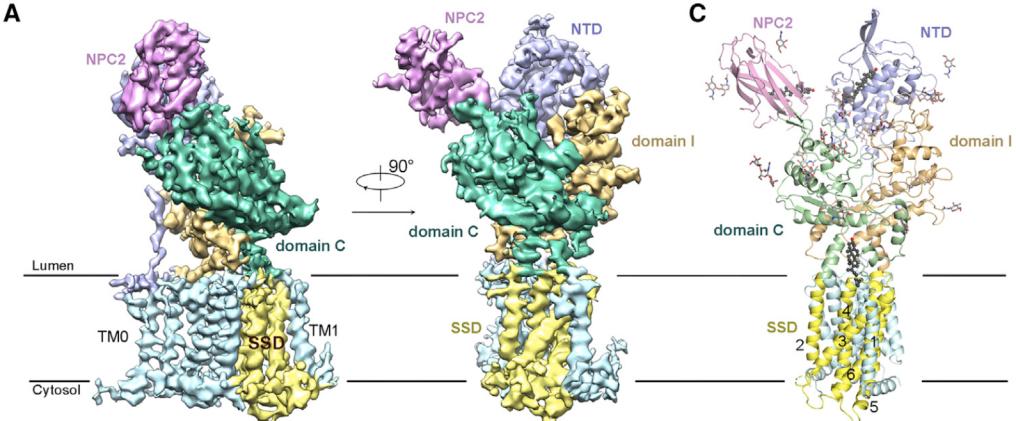
这些结构和此前的结构一起【3,10,11】,表明了一个“K-turn”弹道的胆固醇递送方式:胆固醇首先结合在NPC2上,并且暴露出亲水末端。随后通过NPC2与domain C的相互作用,将胆固醇转运给NPC1的NTD。然后,NPC2离开,同时NTD通过构象变化将胆固醇转载到中心通道,最后经过中央通道转运到SSD并释放到溶酶体膜中(图4)。在这个转运过程中,胆固醇分子的方向经过了一次颠倒从而方便其进入溶酶体膜,就好比汽车掉头一样(K-turn就是表示汽车掉头的意思)。
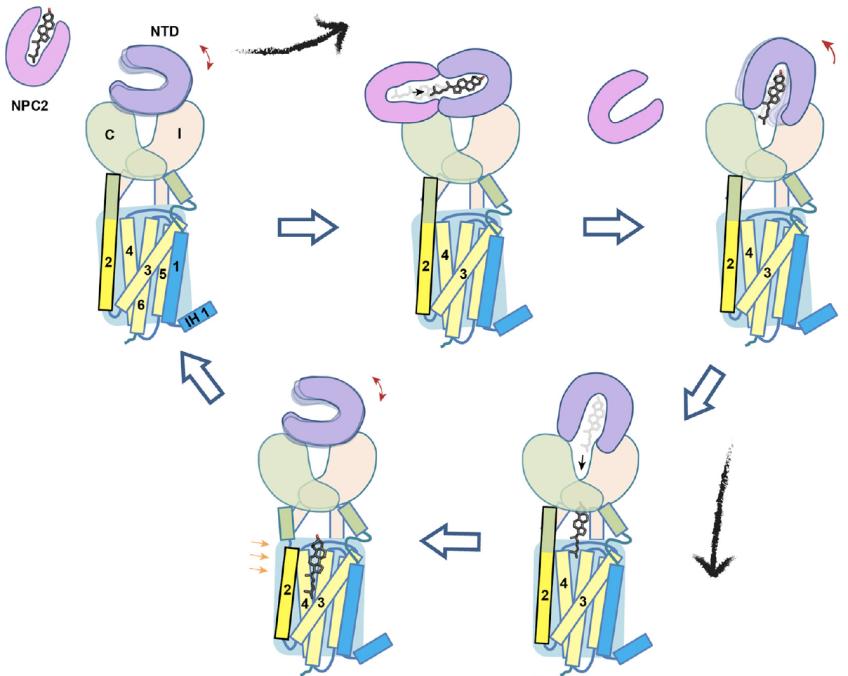
研究人员还对比了NPC1在pH 5.5和pH 8.0条件下的结构,发现SSD呈现出不同的构象,使得中间通道到SSD的开口分别处于闭合和开放的状态。同时也发现在pH 5.5条件下,NTD呈现出比在pH 8.0时更大的柔性。而NTD的柔性变化,正是“K-turn”过程中NTD将胆固醇装载到中间通道的关键。这些结构变化暗示pH对于NPC1结构和功能都有重要的调节作用,为NPC1的功能研究提供了一个新的方向。但pH是如何影响NPC1功能、其背后的生理学意义等等问题都需要进一步的研究。
总的来说,该工作结合此前的相关研究【3,10,12】,首次完整呈现了胆固醇在NPC蛋白的介导下从溶酶体腔转移到溶酶体膜的过程,并揭示了NPC1结构和功能可能对于低pH的依赖性,在NPC1-NPC2介导的胆固醇递送的研究领域迈出了重要一步。同时高分辨率的结构为疾病相关的突变提供了更为精确地定位,这也为将来进一步研究疾病相关突变提供了结构基础。未来将进一步研究pH对于NPC1结构和功能调节的机理,以及SSD如何释放从中间通道接收到的胆固醇,胆固醇又如何从溶酶体膜內叶转运到外叶的机制。更重要的科学问题还包括,胆固醇是如何从溶酶体膜上转运到其他膜结构上的,这很可能会涉及到胞浆内的胆固醇转运蛋白,例如ORP2 ()。
https://doi.org/10.1016/j.cell.2020.05.020
参考文献
1. Wassif, C. A. et al. Genetics in Medicine 18, 41-48, (2016).
2. Carette, J. E. et al. Nature 477, 340-343, (2011).
3. Gong, X. et al. Cell 165, 1467-1478, (2016).
4. Tang, Y. et al. Journal of virology 83, 7982-7995, (2009).
5. Kwon, H. J. et al. Cell 137, 1213-1224, (2009).
6. Gong, X. et al. Science 361, eaas8935, (2018).
7. Qian, H. et al. Nature communications 10, 1-9, (2019).
8. Qi, X. et al. Nature 571, 279-283, (2019).
9. Deffieu, M. S. et al. Proceedings of the National Academy of Sciences 108, 18932-18936, (2011).
10. Xu, S. et al. Journal of Biological Chemistry 282, 23525-23531, (2007).
11. Li, X. et al. Proceedings of the National Academy of Sciences 114, 9116-9121, (2017).
12. Infante, R. E. et al. Proceedings of the National Academy of Sciences 105, 15287-15292, (2008).
本文转载自公众号“BioArt”(BioGossip)
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
微信号:BSC-1979
原标题:《【科技前沿】颜宁/杨洪远合作团队解析胆固醇进入细胞的分子机制 》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




