- +1
【学术前沿】连发4篇Cell及Nature,赵金存团队,石正丽团队及秦川团队等开发出新冠小鼠动物模型
获取更多CSCB2020相关资讯
由于新病例的迅速增加,2019年冠状病毒病(COVID-19)很快引起了全球关注,病原体被鉴定为SARS-CoV-2。截至目前(6月11日),据约翰·霍普金斯大学发布的实时统计数据,全球累计新冠肺炎确诊病例超过744万例,死亡人数达41万。这些数字每天都会更新,而且预计还会进一步增加。但是,现在一直缺乏动物模型,这严重阻碍了药物及疫苗的研发。
2020年6月10日,广州医科大学赵金存,爱荷华大学Stanley Perlman及Paul B. McCray Jr.共同通讯在Cell 在线发表题为“Generation of a Broadly Useful Model for COVID-19 Pathogenesis Vaccination, and Treatment”的研究论文,该研究通过复制缺陷型腺病毒(Ad5-hACE2)外源递送人ACE2开发了小鼠模型。Ad5-hACE2的小鼠出现了肺炎,其特征在于体重减轻,严重的肺部病理以及肺部高滴度病毒复制。I型干扰素,T细胞,信号转导和转录激活因子1(STAT1)对于这些小鼠的病毒清除和疾病解决至关重要。Ad5-hACE2转导的小鼠能够快速评估候选疫苗,人类恢复期血浆以及两种抗病毒疗法(poly I:C和remdesivir)。总之,该研究描述了一种具有广泛和直接实用性的鼠模型,以研究COVID-19的发病机理,并评估新的疗法和疫苗。
另外,2020年6月10日,,华盛顿大学医学院Michael S. Diamond团队在Cell 在线发表题为“A SARS-CoV-2 infection model in mice demonstrates protection by neutralizing antibodies”的研究论文,该研究通过鼻内给药将编码人ACE2的复制缺陷型腺病毒转导到BALB / c小鼠中,并在肺组织中建立了受体表达。 hACE2转导的小鼠被SARS-CoV-2高效感染,这导致肺部病毒滴度高,肺部病理和体重减轻。中和性单克隆抗体的被动转移减少了肺部的病毒负担,减轻了炎症和体重减轻。 SARS-CoV-2感染和发病机理的可访问小鼠模型的开发将加快治疗剂和疫苗的测试和部署。
2020年5月21日,中科院武汉病毒所石正丽及杨兴娄共同通讯在Cell 在线发表题为“Pathogenesis of SARS-CoV-2 in transgenic mice expressing human angiotensin-converting enzyme 2”的研究论文,该研究成功开发了SARS-CoV-2 hACE2转基因小鼠(在C3B6小鼠中为HFH4-hACE2)感染模型。感染的小鼠产生典型的间质性肺炎和病理,与COVID-19患者相似。病毒定量显示肺是感染的主要部位,尽管在某些小鼠的眼睛,心脏和大脑中也可以发现病毒RNA。从感染的肺和脑组织中分离出全基因组序列中与SARS-CoV-2相同的病毒。最后,该研究表明预先暴露于SARS-CoV-2可以保护小鼠免受严重的肺炎的侵害。总而言之,该结果表明,hACE2小鼠将成为测试潜在疫苗和治疗剂的有价值的工具。
2020年5月7日,北京协和医学院秦川及中国疾病预防控制中心病毒病预防控制所武桂珍共同通讯在Nature 在线发表题为“The pathogenicity of SARS-CoV-2 in hACE2 transgenic mice”的研究论文,该研究使用感染SARS-CoV-2的hACE2转基因小鼠研究病毒的致病性。在感染SARS-CoV-2的hACE2小鼠中观察到了体重减轻和病毒在肺中复制。典型的组织病理学是间质性肺炎,肺泡间质中大量淋巴细胞和单核细胞浸润,肺泡腔内巨噬细胞聚集。在支气管上皮细胞,肺泡巨噬细胞和肺泡上皮细胞中观察到病毒抗原。在具有SARS-CoV-2感染的野生型小鼠(没有转hACE2的小鼠)中未发现该现象。该研究阐明了hACE2小鼠中SARS-CoV-2的致病性,并满足了Koch的假设,该小鼠模型可促进针对SARS-CoV-2的疗法和疫苗的开发()。



由于新病例的迅速增加,2019年冠状病毒病(COVID-19)很快引起了全球关注,病原体被鉴定为SARS-CoV-2。截至目前(6月11日),据约翰·霍普金斯大学发布的实时统计数据,全球累计新冠肺炎确诊病例超过744万例,死亡人数达41万。这些数字每天都会更新,而且预计还会进一步增加。
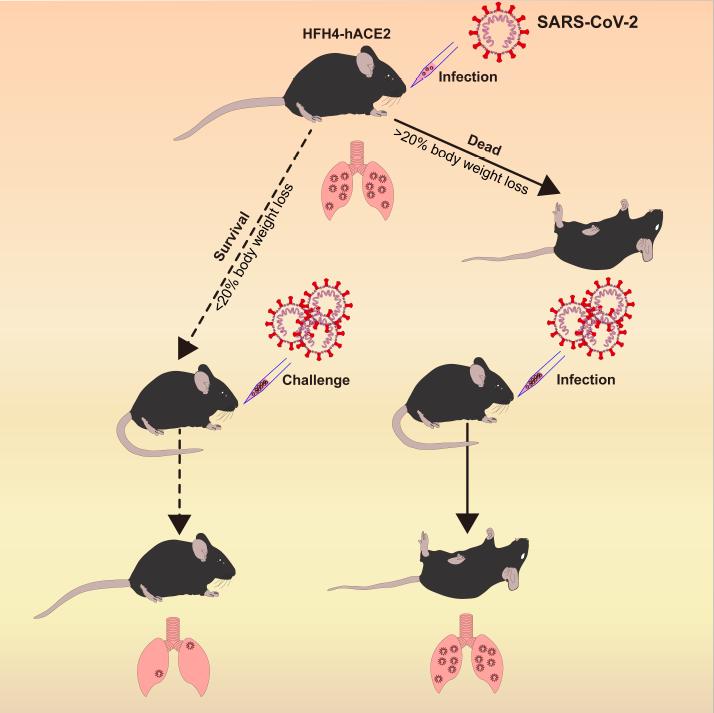
由于SARS-CoV-2与严重急性呼吸系统综合症冠状病毒(SARS-CoV)高度同源,通过分子生物学分析发现,SARS-CoV-2与人类血管紧张素转化酶2(hACE2)结合具有更高的亲和力。但是,现在一直缺乏动物模型,这严重阻碍了药物及疫苗的研发。
该研究成功开发了SARS-CoV-2 hACE2转基因小鼠(在C3B6小鼠中为HFH4-hACE2)感染模型。感染的小鼠产生典型的间质性肺炎和病理,与COVID-19患者相似。病毒定量显示肺是感染的主要部位,尽管在某些小鼠的眼睛,心脏和大脑中也可以发现病毒RNA。
从感染的肺和脑组织中分离出全基因组序列中与SARS-CoV-2相同的病毒。最后,该研究表明预先暴露于SARS-CoV-2可以保护小鼠免受严重的肺炎的侵害。总而言之,该结果表明,hACE2小鼠将成为测试潜在疫苗和治疗剂的有价值的工具。
参考消息:
https://www.cell.com/cell/fulltext/S0092-8674(20)30622-X
https://www.cell.com/cell/fulltext/S0092-8674(20)30741-8#%20
https://www.cell.com/cell/fulltext/S0092-8674(20)30742-X
来源:iNature


原标题:《【学术前沿】连发4篇Cell及Nature,赵金存团队,石正丽团队及秦川团队等开发出新冠小鼠动物模型》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




