- +1
《自然》:科学家揭示血红蛋白的进化起源,复杂功能竟然只需要几个简单突变
原创 奇点糕 奇点网

从混沌的原始海洋到第一个细胞,从水生到陆生,从蒙昧到智慧……在我们的认知里,进化就是无数个踏出的一小步组成的通途。
但是出乎意料的是,复杂的生物功能其实并不需要复杂的进化过程,几个小小的突变可能就是我们今天赖以生存的关键。
近期,芝加哥大学的科研团队在《自然》杂志发文,揭示了血红蛋白的进化起源,出乎意料的是,实现血红蛋白递送氧气的关键功能的多聚结构的出现,竟然只在于几个氨基酸的替换![1]
这意味着我们一直以来对进化的认知是片面的,生物功能并不只有通过漫长的自然选择优化,更可能突然“闪亮登场”。

今天要聊到的是一种蛋白质常见的存在形态,多聚体。
蛋白可以通过氨基酸之间的作用彼此连接,形成多聚体。连接面和活性位点的结构使得多聚体具有比蛋白单体更灵活的功能,包括变构效应和协同效应。
在传统的认知里,形成多聚体这样精巧的结构需要复杂的进化过程,一般认为其间经历了多个氨基酸的替换和漫长的选择,最终才得到形成多聚体的能力。
这种观点是否正确?如果能够把某种多聚体的进化过程一步一步列出来,那么一看便有分晓了。
在这个研究领域,血红蛋白(Hb)可以说是一种很好的研究对象。因为血红蛋白无论结构、功能、组成多聚体的机制、变构调节等等特征几乎都清清楚楚,而且血红蛋白的亚基们来自共同的祖先,在一次分析中就可以覆盖,可谓非常便捷。
在这里我们先来了解一下血红蛋白长什么样子。
在大多数脊椎动物中,血红蛋白分子是由四个亚基组成的异四聚体,这四个亚基两两一类,我们把它们分别叫做α亚基和β亚基。这两种亚基在进化上是有共同起源的。
目前科学家普遍认为,血红蛋白和肌红蛋白在很久很久之前是一家——这个时候血红蛋白的老祖宗还是保持着单体形态的,那么它是怎么逐步进化成今天的异四聚体形态的呢?
从研究者们推断的进化树中可以看出,从老祖宗AncMH到现代α、β亚基的祖先Ancα和Ancβ,中间还有一个完全未知的角色,Ancα/β,看来它就是我们要解析的“失落的环节”了。
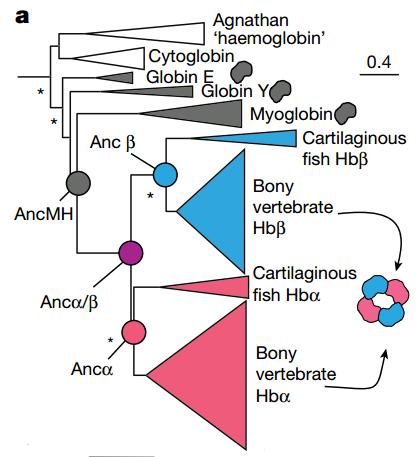
研究者们用推断的氨基酸序列重建了这几种蛋白。首先,Ancα和Ancβ两两组成四聚体的解离常数(Kd)是10μM,和现代人类血红蛋白的解离常数(15μM)基本一致,而且Ancβ可以自己组成同四聚体,这也和现代的β亚基性质一样。
不过Ancα/β就有些不同了,它可以组成二聚体,解离常数9μM,但是不能够组成四聚体。
在Ancα/β之后,肯定还有一些变化,才使得血红蛋白成为四聚体的模样。
另一方面,Ancα/β的功能也能说明这个问题。
我们知道,血红蛋白之所以能够担起氧交换的重任,正是因为它恰到好处的携氧能力。血红蛋白在肺或鳃中携带氧气,又在外周释放氧气,是因为血红蛋白的氧结合能力要比肌红蛋白低,而且血红蛋白的变构效应会进一步降低这种亲和力。
类似的,Ancα+Ancβ也具有与人类重组血红蛋白类似的携氧能力,且可以被效应分子六磷酸肌醇(IHP)调节,不过调节效果要弱一些。
但是,Ancα/β的氧亲和力要比Ancα+Ancβ更强,也不受IHP调节。
可见,Ancα/β的同二聚体在功能上也不能比肩血红蛋白。
那么我们继续看Ancα/β之后又进化成了什么模样吧。
血红蛋白之所以能够保持四聚体的模样,有两个关键的接口:IF1,负责连接α1-β1、α2-β2;IF2,负责连接α1-β2、α2-β1。实验发现,Ancα/β已经具有IF1,但是并不存在IF2。可以认为,是IF1让Ancα/β形成同二聚体,而此后进化出的IF2带它走向四聚体的道路。
而现代血红蛋白的α亚基可以通过IF1组成同二聚体,β亚基则可以同时利用IF1和IF2形成同四聚体,这也证实IF1应当继承自Ancα/β。
那么进化之路是不是很复杂呢?其实并不。
经过分析,研究者发现从Ancα/β到Ancα和Ancβ,其实发生的氨基酸替换根本没多少。Ancα的IF1只有3个改变,而Ancβ也仅仅是IF1 4个、IF2 5个的程度。
当把IF2的5个替换引入Ancα/β,就叫它Ancα/β5吧,Ancα/β5竟然立刻就可以和Ancα形成四聚体了,包括异四聚体也包括同四聚体。另外一个包含4个替换的版本,则是能够形成同四聚体,但不能够与Ancα形成异四聚体。就算只引入2个替换,也能够异高亲和力形成四聚体。
这可真是简单得出乎意料了!
通过进一步引入IF1的相关替换,研究者确定,IF1使得蛋白倾向于形成异二聚体,而IF2的存在则让它们再次组合成异四聚体。
绝大多数细胞过程都涉及蛋白多聚体的作用,今天介绍的这项研究是目前为止蛋白多聚体进化最清晰的步骤了。不过它仍旧遗留了很多待解决的问题。
比如实验中使用的效应分子IHP,其实它与血红蛋白结合位点并不与氧亲和位点完全重叠,实际情况可能会更加复杂。而二氧化碳、ATP等其他效应分子的调节作用,应该也是很有趣的探索方向。
此外,在整个进化过程中,基因层面是如何进行调控的也是值得讨论的。当然,这就是后话了。
参考资料:
[1]https://www.nature.com/articles/s41586-020-2292-y
[2]https://www.nature.com/articles/d41586-020-01287-8


本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




