- +1
【科学普及】生长素与植物花发育(下)
以下文章来源于植物器官发生 ,作者侯学仁
作为中国细胞生物学学会植物器官发生分会官方科普宣传平台,不定期发布植物细胞和发育生物学领域科普图文、视频,及分会动态资讯。

获取更多CSCB2020相关资讯
撰写|候学仁
花原基行程阶段:生长素又到花原基起始并调控FM与原基的命运
植物诱导成花时转变SAM从侧翼形成IM进一步生成FM,IM重复循环地向FM和花原基发育将逐步形成花序,而FM通过花原基分化出各轮花器官[3]。在这个阶段,分生组织向轮次和排列固定的花器官准确转化既是FM决定的过程也是落实其决定性的结果。
花原基作为类似于叶的植物侧生原基从生长植株顶端或SAM规则有序地启动和形成,生长素在这一过程中起着重要作用,植物运输生长素的能力受到遗传或化学损伤时将不能够形成花原基。已有IM研究发现PIN1极性转运依赖的生长素局部浓度决定花原基的起始位置和后续的发育,在花原基起始时生长素汇聚起诱导作用而随着IM的发育生长素回流到分生组织中心和邻近区域以诱导新的原基产生(图4)[6],这和生长素诱导叶原基起始和形成的过程非常相似。实验证明,之后的生长素从L1层向内重新定位(从初生原基处移走)同样由PIN1极性运输造成,且受MAB4基因家族调控[7]。
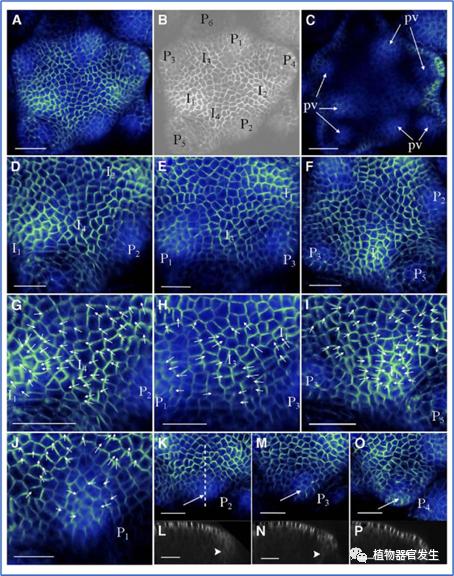
对拟南芥(Arabidopsis thaliana)FM发育过程中连续时间的共聚焦成像观察到生长素的积累主要局限于L1层,PIN1定位观察发现生长素的分布模式在空间和时间上与花器官发育模式相似,FM周围多器官原基起始对应多个生长素浓度最大值。比如萼片是由生长素最大值在分生组织早期生长过程中形成的,然后其引导与花瓣、雄蕊和心皮原基相关的较小生长素最大值的位置形成其它花器官原基[8,9]。有研究总结LFY和生长素共同参与花原基起始和形成的调控网络(图6),这和LFY与生长素在成花诱导过程中的调控网络有相似之处(诱导成花紧接着就是花原基起始),生长素启动花原基依赖于LFY这个关键的花分生组织特征决定基因[10]。
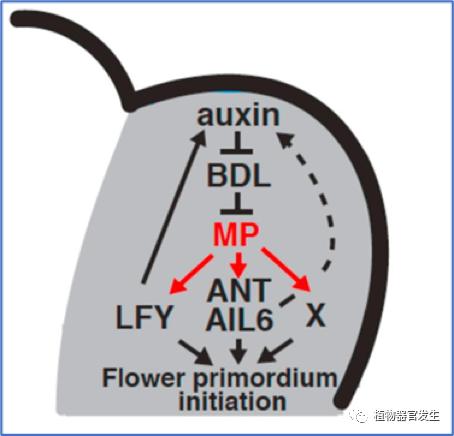
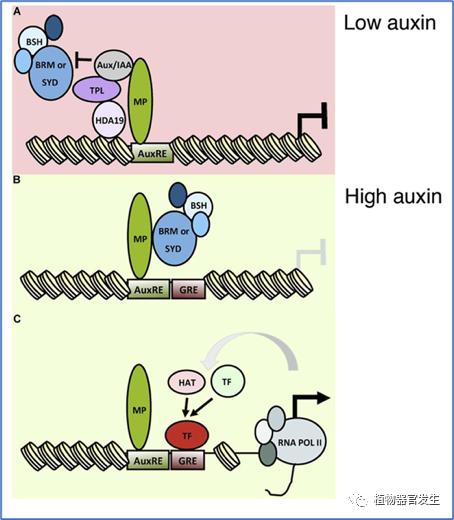
花原基的起始需要从干细胞到原基生成细胞命运的转换,细胞命运的转换很大程度上依赖染色质调控的基因的转录可及性。有研究发现生长素恰好可以介导花原基起始相关染色质开关的开启:首先需知SWI/SNF ATPases的活性对允许花原基起始非常重要,其可以打开染色质允许重编程;其次,招募SWI/SNF(BRM/SYD)是MP的主要功能之一,通过BRM/SYD的作用增强MP靶基因(如FIL)的转录可及性。而Aux/IAA会抑制BRM与MP的互作,这就需要生长素依赖的Aux/IAA降解途径来调控。如此,生长素通过Aux/IAA和MP的状态变化顺理成章地调控花原基起始相关基因的转录,赋予其原基生成细胞的命运(图7)[11]。总之,生长素局部高浓度水平和生长素信号通路都参与花原基起始调控。
花原基的形成不仅是分生组织生出组织学意义上的突起的过程,也是将FM内部程序集成于原基而待于后续花器官发育的“初始化”过程,所以花原基起始之初就意味着要对之后各类花器官的轮生和次序作出规划。FM与SAM的器官起始有一定区别,SAM向上生长且叶原基之间有顺序和角度;FM在生长时呈放射状扩展,同一类型的器官不是连续启动而是或多或少以同心轮的形式同步启动的。
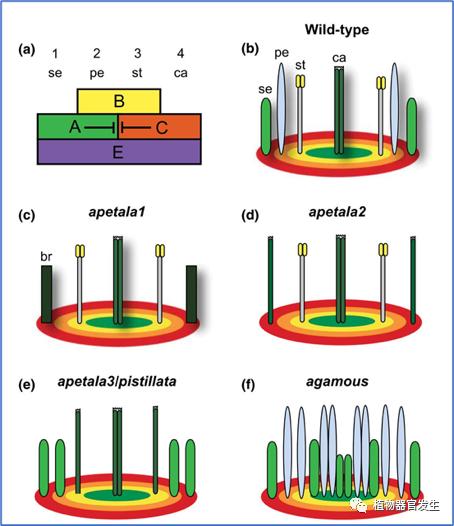
花原基起始初期阶段,各轮花器官的位置信息还不确定,但有证据表明最早的花发育沿着近/远轴进行(abaxial/adaxial axis)。基于双子叶植物拟南芥和金鱼草(Antirrhinummajus)的中心/径向ABCE模型可以体现基因表达如何决定各轮花器官的特性(图8)[12],花器官决定基因由LFY等分生组织决定基因产物激活,LFY同时抑制花器官决定基因负调控因子进一步促进其表达。如花器官决定基因AP1属于ABCE模型中的A类基因,在花发育早期只在外部两轮中表达,在花原基中心两轮受C类基因介导而被抑制表达,其它几类基因表达模式也比较类似。但是这只解释花器官的特性,而不是器官起始的相对时间或轮次内的位置。最早的器官发生事件包括单个或一组细胞在IM或FM侧面感受位置信号使其命运特化,随后的激活作用导致细胞增殖产生原基(anlage)或前原基(preprimodium),然后可见组织学上的原基[13]。所以,花原基形成的一个重要职责在于在特定区域激活特异的花器官决定基因,生长素在其中也发挥重要作用。
花原基形成过程中轮次和花器官位置被确定,比如雄蕊原基由BCE三类基因调控在第三轮次中发生。有研究发现,在这个过程中生长素由YUC基因在花幼芽中合成并由PIN蛋白定向运输到原基顶端达到雄蕊原基形成所需的最大值(图9)[14]。由雄蕊和花萼原基起始过程可知,生长素在花原基中可以通过浓度最大值信号定位不同花器官原基的位置。
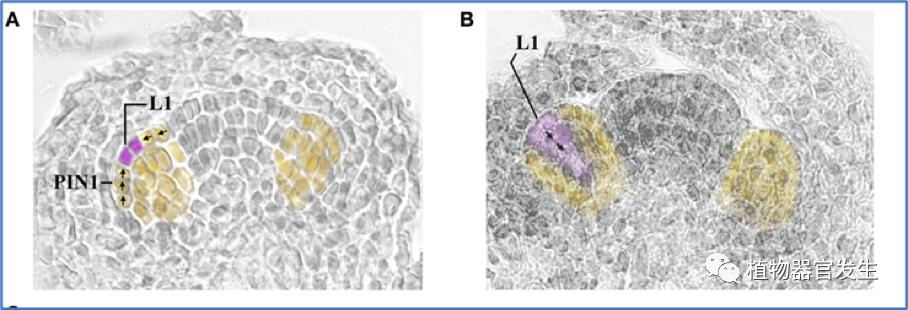
在拟南芥中表达WUSCHEL(WUS)的组织中心和表达CLAVATA3(CLV3)的干细胞之间的负反馈回路保持了FM和SAM的适当大小,WUS突变导致植物过早失去维持干细胞的能力阻碍器官形成,而CLV3突变会积累干细胞导致多器官形成[15]。
除上述机制外,花器官的位置和数目还受边界基因的控制,在这些过程中生长素的表现机会将更多。研究证明边界基因SUPERMAN(SUP)可以调控生长素合成介导花器官轮次和边界的发育:首先发现SUP非自主地影响FM中的干细胞进而影响花器官的数目和位置;其次,在sup突变体中生长素信号被破坏,之后被证明是因为局部生长素合成被抑制;其机制是SUP介导YUC1/4(生长素合成转运相关的基因)表达抑制性标记H3K27me3的去除。生长素与边界基因的合作显示其具备调控花原基中器官轮次和边界的能力,需知这种能力不仅是因为合成水平的改变还有其极性运输带来的调控作用。因为在没有生长素极性运输的情况下,花轮次3/4边界局部生长素生物合成的上调不足以引起sup突变体的表型缺陷,YUC1/4去阻遏产生的生长素可能通过极性生长素运输而触发FM中生长素梯度的动态变化[15]。
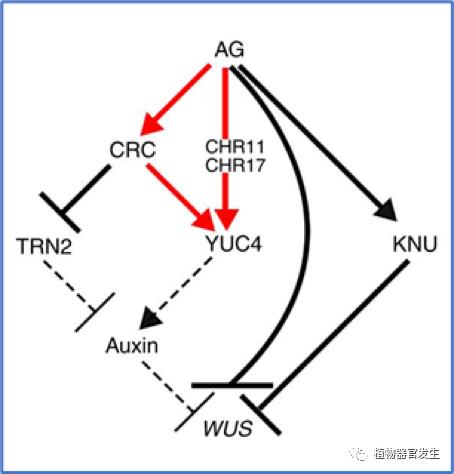
与SAM的不断更新不同,FM经过花原基形成阶段确定其花器官分化命运之后将经历终止过程,在心皮开始发育后停止维持干细胞。和其维持分化同样重要,FM的如期终止将保证花器官数目和位置的确定。WUS和C类基因AGAMOUS(AG)之间的一个负反馈在终止过程中起中心作用,如果这个程序出现意外也会导致多余的轮次发生。AG还激活YABBY家族转录因子CRABS CLAW(CRC),通过在第四轮次中建立生长素最大值来调节心皮器官发生和FM确定性。有研究发现生长素生物合成基因YUC4有助于拟南芥从花干细胞维持到雌蕊形成的转变,两种组织特异性转录因子AG和CRC直接与YUC4启动子结合并激活其表达(图10)[15–17]。
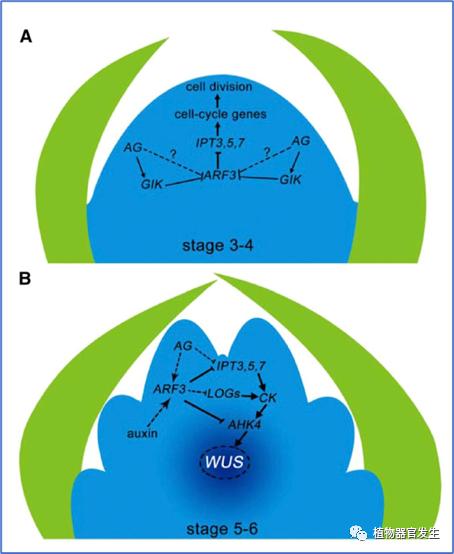
研究发现生长素在FM分化和终止过程中发挥重要作用:生长素通过促进ARF3表达抑制细胞分裂素(CTK)的活性进而促进FM分化,在分生组织中ARF3降低组织中心(OC)的CTK活性以终止WUS表达。在花原基形成后期,AG和生长素共同促进ARF3表达调控FM程序化终止(图11)[18]。
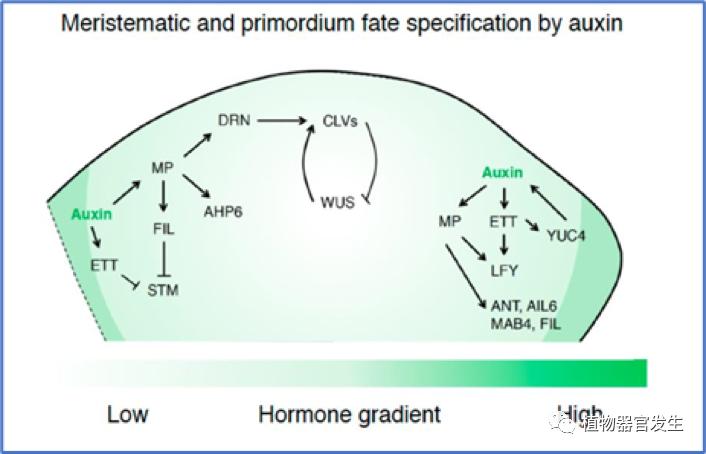
总之,生长素在决定SAM中分生组织和原基命运的过程中发挥关键作用。ARFs决定分生组织和原基的命运,主要通过与其靶基因启动子中的生长素响应元件(AuxRE)结合而发挥转录因子的功能。典型的ARF是MP,在SAM的CZ中低水平存在,在PZ中高水平存在并分别调控不同的下游靶基因。为了控制CZ的分生组织命运,MP直接抑制ARR7/ARR15,并通过调节细胞分裂素稳态激活AHP6,AHP6建立细胞分裂素信号的抑制区域以确定器官起始位点。为了决定原基在PZ中的命运,MP直接激活PIN1、LFY、ANT和AIL6以及FIL,这其中还涉及染色质重构复合物SWI/SNF的招募。由此可见MP协调分生组织和原基的命运决定以响应SAM中的生长素感应(图12)[19]。在分生组织分化和花原基命运决定的过程中,生长素信号有着简洁且有力的调控作用。
花器官发育阶段:生长素继续发挥层次丰富的调控作用
经过FM的分化和花原基的形成,各轮花器官的位置和发育顺序得到确定,FM程序化终止之后植物只需要按部就班地完成花器官的后续发育即可。但是此时原基距离成形和成熟的花萼、花瓣、雄蕊、雌蕊等组分的还有一段复杂的过程,生长素在这个过程中依旧发挥重要的调控作用。
比如,生长素在雄蕊原基形成过程中由YUC1和YUC4局部产生,在雄蕊发育后期由YUC2和YUC6局部产生,研究表明生长素在雄蕊发育的早期(原基和花粉的形成)和晚期(花粉成熟、花药开裂和花丝生长)具有双重作用[20]。
有证据表明,ABCB1和ABCB19生长素转运蛋白在雄蕊早期发育、绒毡层发育和减数分裂细胞同步中起作用:其在花药发育早期有助于生长素在膜内的分布;在绒毡层细胞和减数分裂细胞中合成的生长素被ABCB1和ABCB19转运出去,而这些转运蛋白的缺乏导致生长素的异常积累,在突变体中表现为绒毡层异常增生和减数分裂时间不同步[21]。
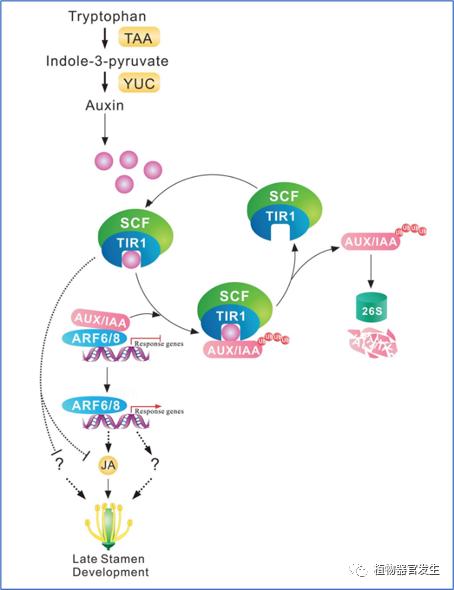
生长素对花器官发育的调控还体现在和其它类型激素的协调作用上。已知茉莉酸(JA)和赤霉素(GA)等激素能够调控雄蕊的发育,JA是根据花的发育线索生物合成的,随后被COI1感知,COI1招募JAZ蛋白进行降解以激活雄蕊发育所必需的MYB21、MYB24和MYB57的转录功能和表达,这些JA信号成分的突变会导致雄蕊发育缺陷。生长素调控雄蕊发育的信号包含通过ARFs(如ARF8和ARF6)控制JA生物合成等(图13),GA响应途径也和JA合成有关[22]。
生长素在协调雄蕊和雌蕊生长发育中的作用对于成功授粉尤为重要。雌蕊由柱头、花柱、子房和沿基/顶轴形成的雌蕊柄组成,与之相对应地存在着生长素梯度,在顶端区域的浓度相对较高,而在基底区域的浓度相对较低,可能对指定沿轴的组织发育起重要作用[20]。
FM分化后不同类型的花器官原基进一步发育成为成熟的花器官,不同轮次中多种花器官的协调发育对于调控的时空顺序要求更为严苛和精密,生长素作为极性转运和信号通路并用的调控“专家”在此阶段展现出了层次更为丰富的调控手段。
总结
花发育是一个精细的且对时空秩序要求极高的过程,复杂的调控网络使身处其中的生长素(事实上是大多数参与其中的调控分子)不得不表现出“承上启下,左右兼顾”的调控面貌。生长素既在合成上受发育过程线索的指定,又在运输上受转运蛋白的控制,看上去仿佛很被动。但生长素利用ARFs(如MP)对其的活性依赖和自身浓度诱导器官起始的能力借力打力,反将自己立于诱导原基起始和调控关键基因表达的重要位置。此外,生长素的调控手段极为丰富,生物合成、极性转运和信号通路使其可以在花发育的各个阶段对分生组织和多种花器官实施精准调控。结合其植物激素的特性,在沟通环境刺激和内部信号上生长素也拥有一定优势。
花发育本身也是一个连续且复杂的过程,各个阶段发育模式的设立与维持都不是某一因素独自作用的结果,因而在全局调控网络中的角色才是我们理解生长素功能和如何发挥功能的更重要的维度。花发育的多器官同时性和持续性使准确理解其动态调控过程变得困难,关注生长素调控通路和合成转运的时空变化会是理解花发育的很好的切入点。
参考文献
1. Denay G, Chahtane H, Tichtinsky G, Parcy F. 2017. A flower is born: an update on Arabidopsis floral meristem formation. Curr. Opin. Plant Biol. 35:15-22 DOI:10.1016/j.pbi.2016.09.003
2. Xiong Y, Jiao Y. 2019. The diverse roles of auxin in regulating leaf development. Plants 8:243 DOI:10.3390/plants8070243
3. Goldental-Cohen S, Israeli A, Ori N, Yasuor H. 2017. Auxin response dynamics during wild-type and entire flower development in tomato. Plant Cell Physiol. 58:1661-72 DOI:10.1093/pcp/pcx102
4. Yamaguchi N, Jeong CW, Nole-Wilson S, Krizek BA, Wagner D. 2016. AINTEGUMENTA and AINTEGUMENTA-LIKE6/PLETHORA3 Induce LEAFY expression in response to auxin to promote the onset of flower formation in Arabidopsis. Plant Physiol. 170:283-93 DOI:10.1104/pp.15.00969
5. Li W, Zhou Y, Liu X, Yu P, Cohen JD, Meyerowitz EM. 2013. LEAFY controls auxin response pathways in floral primordium formation. Sci. Signal. 6:ra23 DOI:10.1126/scisignal.2003937
6. Heisler MG, Ohno C, Das P, Sieber P, Reddy GV, et al. 2005. Patterns of auxin transport and gene expression during primordium development revealed by live imaging of the Arabidopsis inflorescence meristem. Curr. Biol. 15:1899-911 DOI:10.1016/j.cub.2005.09.052
7. Furutani M, Nakano Y, Tasaka M. 2014. MAB4-induced auxin sink generates local auxin gradients in Arabidopsis organ formation. Proc. Natl. Acad. Sci. U. S. A. 111:1198-203 DOI:10.1073/pnas.1316109111
8. van Mourik S, Kaufmann K, van Dijk AD, Angenent GC, Merks RM, Molenaar J. 2012. Simulation of organ patterning on the floral meristem using a polar auxin transport model. PLoS One 7:e28762 DOI:10.1371/journal.pone.0028762
9. Krizek BA. 2011. Auxin regulation of Arabidopsis flower development involves members of the AINTEGUMENTA-LIKE/PLETHORA (AIL/PLT) family. J. Exp. Bot. 62:3311-9 DOI:10.1093/jxb/err127
10. Yamaguchi N, Wu MF, Winter CM, Berns MC, Nole-Wilson S, et al. 2013. A molecular framework for auxin-mediated initiation of flower primordia. Dev. Cell 24:271-82 DOI:10.1016/j.devcel.2012.12.017
11. Wu MF, Yamaguchi N, Xiao J, Bargmann B, Estelle M, et al. 2015. Auxin-regulated chromatin switch directs acquisition of flower primordium founder fate. Elife 4:e09269 DOI:10.7554/eLife.09269
12. Ó'Maoiléidigh DS, Graciet E, Wellmer F. 2014. Gene networks controlling Arabidopsis thaliana flower development. New Phytol. 201:16-30 DOI:10.1111/nph.12444
13. Chandler JW, Werr W. 2014. Arabidopsis floral phytomer development: auxin response relative to biphasic modes of organ initiation. J. Exp. Bot. 65:3097-110 DOI:10.1093/jxb/eru153
14. Cardarelli M, Cecchetti V. 2014. Auxin polar transport in stamen formation and development: how many actors? Front. Plant Sci. 5:333 DOI:10.3389/fpls.2014.00333
15. Xu Y, Prunet N, Gan ES, Wang Y, Stewart D, et al. 2018. SUPERMAN regulates floral whorl boundaries through control of auxin biosynthesis. EMBO j. 37 DOI:10.15252/embj.201797499
16. Yamaguchi N, Huang J, Tatsumi Y, Abe M, Sugano SS, et al. 2018. Chromatin-mediated feed-forward auxin biosynthesis in floral meristem determinacy. Nat. Commun. 9:5290 DOI:10.1038/s41467-018-07763-0
17. Yamaguchi N, Huang J, Xu Y, Tanoi K, Ito T. 2017. Fine-tuning of auxin homeostasis governs the transition from floral stem cell maintenance to gynoecium formation. Nat. Commun. 8:1125 DOI:10.1038/s41467-017-01252-6
18. Zhang K, Wang R, Zi H, Li Y, Cao X, et al. 2018. AUXIN RESPONSE FACTOR3 regulates floral meristem determinacy by repressing cytokinin biosynthesis and signaling. Plant Cell 30:324-46 DOI:10.1105/tpc.17.00705
19. Lee ZH, Hirakawa T, Yamaguchi N, Ito T. 2019. The Roles of Plant Hormones and Their Interactions with Regulatory Genes in Determining Meristem Activity. Int. J. Mol. Sci. 20:4065 DOI:10.3390/ijms20164065
20. Robert HS, Crhak Khaitova L, Mroue S, Benková E. 2015. The importance of localized auxin production for morphogenesis of reproductive organs and embryos in Arabidopsis. J. Exp. Bot. 66:5029-42 DOI:10.1093/jxb/erv256
21. Cecchetti V, Brunetti P, Napoli N, Fattorini L, Altamura MM, et al. 2015. ABCB1 and ABCB19 auxin transporters have synergistic effects on early and late Arabidopsis anther development. J. Integr. Plant Biol. 57:1089-98 DOI:10.1111/jipb.12332
22. Song S, Qi T, Huang H, Xie D. 2013. Regulation of stamen development by coordinated actions of jasmonate, auxin, and gibberellin in Arabidopsis. Mol. Plant 6:1065-73 DOI:10.1093/mp/sst054
来源:植物器官发生


原标题:《【科学普及】生长素与植物花发育(下)》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




