- +1
《Science》:想避免早衰?先照顾好自己的T细胞吧
原创 马猴 时光派 来自专辑前沿追新

亚利桑那大学
神经科学与认知科学
朋友,干了这杯缸中脑
前段时间,时光派把“提升免疫力”这个骗局好好地锤了一遍。但各位可千万不要觉得,今后就能对自己的免疫体统爱答不理。
近日的一项研究表明:代谢不健康的免疫T细胞,与早衰存在着密切的联系[1]。

在这项发表在顶级科研期刊《Science》上的报告中,一支来自西班牙的团队使用基因手段,靶向破坏了小鼠(下称实验组小鼠)T细胞中的电子传递链,引发了严重的T细胞线粒体功能障碍。接着,T细胞就集体“癫狂”了。
线粒体出了问题的T细胞,在实验组小鼠体内疯狂释放IFN-γ和TNF-α等炎症因子,改变自己的分化倾向,使得实验组小鼠(7个月大)的整个免疫系统表现出严重的亲炎症倾向,慢性炎症水平变得比正常老年小鼠(22个月大)还要高。
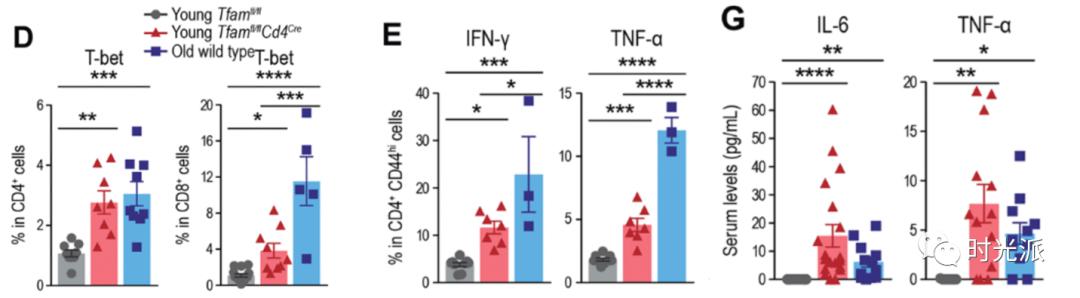
在引发慢性炎症的同时,不健康的T细胞还放弃了自己的本职工作,导致实验组小鼠的免疫力出现了大幅下降。
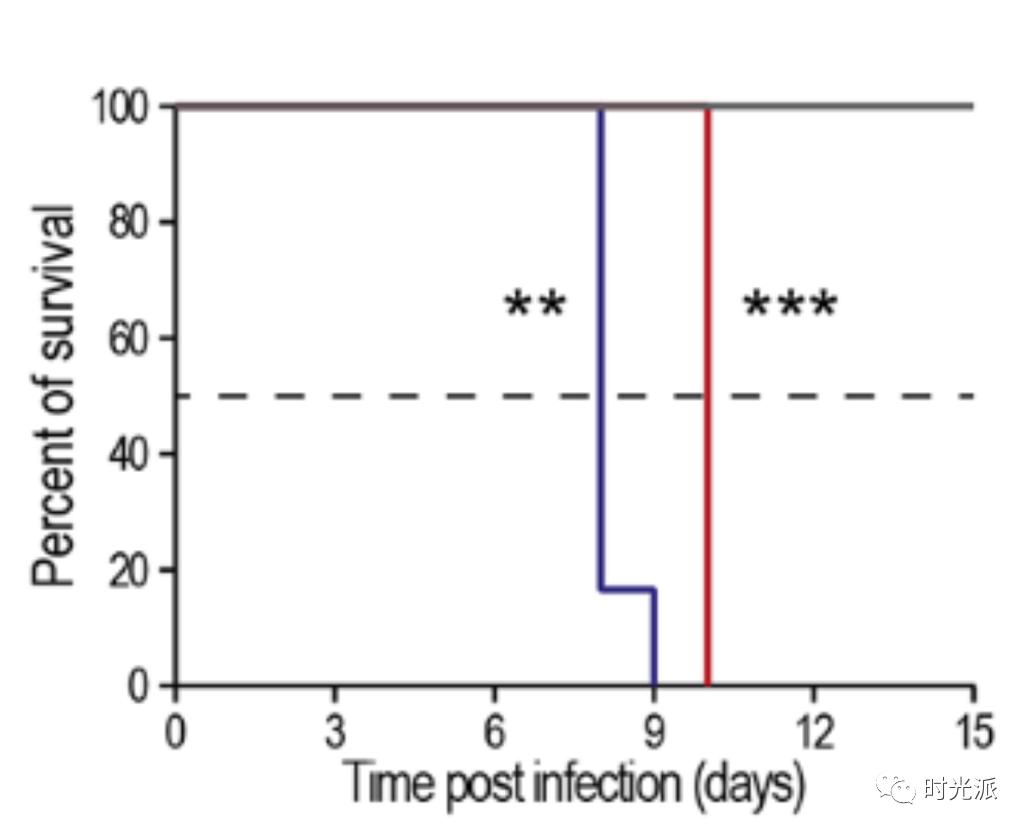
研究人员在使用一种类似天花的病毒(ECTV)感染了多组小鼠后,发现正常的年轻小鼠(7个月大)能够轻松的抵御这种病毒,而实验组小鼠和老年小鼠则在十天内就全部死于感染。
更致命的是,这些小鼠还出现了大量的心血管和代谢问题。实验组小鼠普遍患有心脏萎缩,左心室不论厚度、尺寸还是容量都明显低于正常水平,心肌细胞也更小。
代谢方面,实验组小鼠葡萄糖吸收能力极低;行动缓慢四肢乏力,但是能量消耗却异常巨大。

除此之外,驼背、贫血、肌肉纤维直径减小、各组织衰老细胞标识的表达,几乎所有的衰老相关症状,都出现在了实验组小鼠身上。
显然,代谢异常的T细胞在小鼠体内引发了早衰,并且使得这些小鼠的寿命缩短了整整一倍。
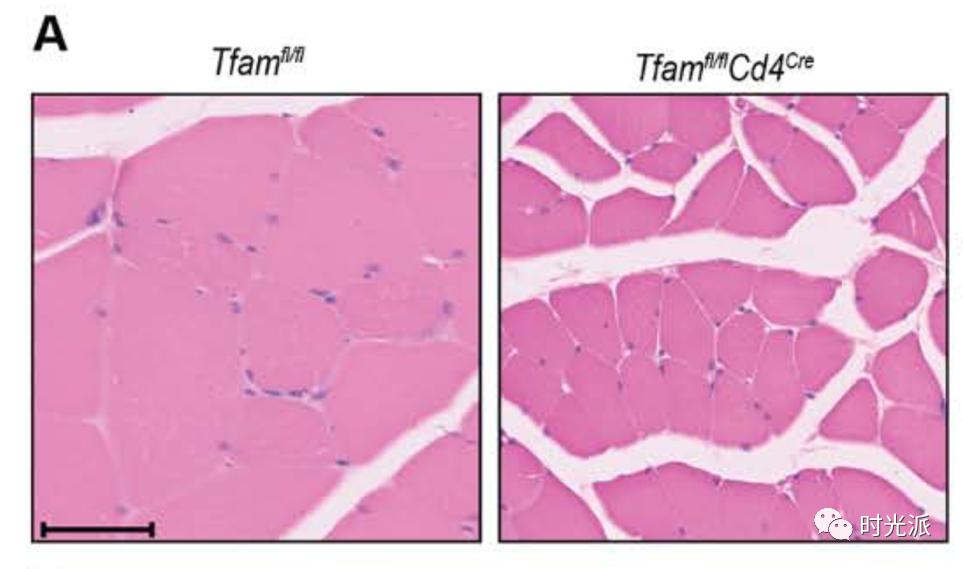
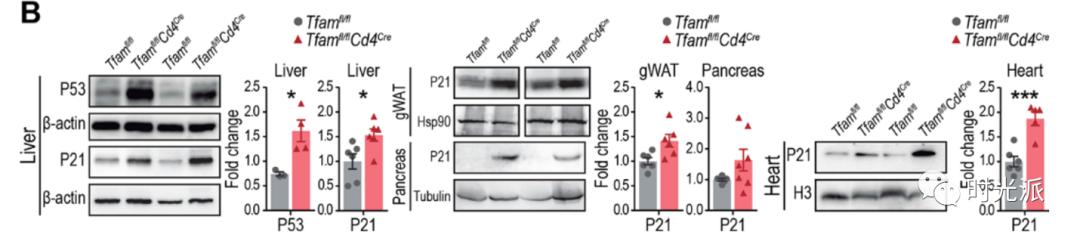
谁能想到,异常的T细胞,居然能引发这么多衰老症状。
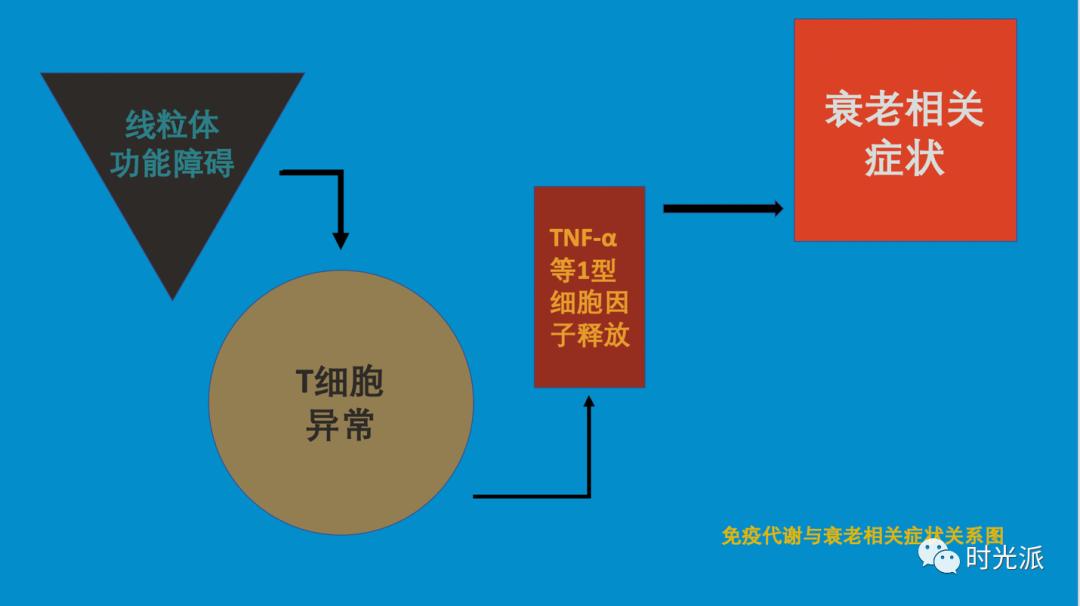
回想一下,所有变化的源头,无非就是T细胞大量的释放了IFN-γ和TNF-α等炎症因子,那么只要能够修正这一源头,所有的衰老相关症状,也就应该会被一并修复。
经过筛查后研究人员发现,对实验组小鼠使用抗炎药依那西普,有针对性的抑制了TNF-α对细胞的影响后,小鼠的早衰状况表现出了全面的好转。
更进一步的想,考虑到此次T细胞异常的根源是线粒体功能的障碍,研究人员又让实验小鼠进行了为期10周的NR摄入,试图通过这种NAD+前体,来提升实验组小鼠NAD+/NADH的比例,从而修复线粒体的功能异常,发现这种方式也可以大幅的扭转几乎全部的衰老相关症状。
至此,本项研究的数据,已经足够建立起一个完整的免疫代谢与衰老相关症状关系图:
时光派点评
如果说,这篇文章只能让读者记住一句话,我希望是下面这句来自著名抗衰学者Judith Campisi教授的评论:
“这项研究确实加深了我们对免疫系统与衰老关系的理解,但是作者所使用的模型是否真的等同于自然衰老,我不知道[2]。”
实验中的小鼠在T细胞代谢出现问题后,引发的所有这些问题,其实比起衰老,更接近我们所说的早衰症。
比如说体重,实验组小鼠的体重,并没有像正常的衰老模型一样有所升高[3],反而是随着体内的脂肪含量一并减少,结合小鼠体内ATGL等脂肪酶表达水平提升等数据,不难推测出,实验组小鼠变得更倾向于分解脂肪,这属于自然衰老与早衰症的典型区别之一[4]。
早衰症并不应该被理解成一种加速的衰老,两者之间虽然共有大量相同的分子通路,遗传标识,但是也存在着诸多决定性的不同[5]。笔者看到有不少报道,都把这项研究解读为“T细胞异常是造成衰老的原因”,也不知道是无心之过还是有意为止,所以在这里专程强调一下。
同理还有前段时间闹得沸沸扬扬的“PAPD5抑制剂修复端粒”事件[6]。那项研究使用的是端粒综合征模型,而且还是端粒综合征患者的干细胞模型,也是不能够被等同于自然衰老中端粒损耗的事情,结果国内媒体又是一片“端粒问题已被解决”“永生将要实现”,哎。。。

反正按照这些媒体的说法,我国人民平均每周要实现3次左右的永生。希望大家今后在读到相关文章时,不要被这些有煽动性的结论所误导,时光派今后也会竭尽所能,在第一时间为大家带来这些研究客观的,科学的分析。
THE END
如有任何对文章内容的疑惑、想法,或抗衰领域的问题,欢迎扫码联系小助理,更有超多独家惊喜福利免费放送哦!
参考文献
[1]. Desdín-Micó, Gabriela, et al. “T Cells with Dysfunctional Mitochondria Induce Multimorbidity and Premature Senescence.” Science, 2020, doi:10.1126/science.aax0860.
[2]. LeslieMay, Mitch, et al. “Defective Immune Cells Could Make Us Old.” Science, 22 May 2020, www.sciencemag.org/news/2020/05/defective-immune-cells-could-make-us-old.
[3]. Pirzgalska, Roksana M, et al. “Sympathetic Neuron–Associated Macrophages Contribute to Obesity by Importing and Metabolizing Norepinephrine.” Nature Medicine, vol. 23, no. 11, Sept. 2017, pp. 1309–1318., doi:10.1038/nm.4422.
[4]. Kreienkamp, Ray, et al. “Doubled Lifespan and Patient‐like Pathologies in Progeria Mice Fed High‐Fat Diet.” Aging Cell, Dec. 2018, doi:10.1111/acel.12852.
[5]. Burtner, Christopher R., and Brian K. Kennedy. “Progeria Syndromes and Ageing: What Is the Connection?” Nature Reviews Molecular Cell Biology, vol. 11, no. 8, 2010, pp. 567–578., doi:10.1038/nrm2944.
[6]. Nagpal, Neha, et al. “Small-Molecule PAPD5 Inhibitors Restore Telomerase Activity in Patient Stem Cells.” Cell Stem Cell, 2020, doi:10.1016/j.stem.2020.03.016.
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




