- +1
【科学普及】缘何花开花早落-“追凶”植物磺肽素
获取更多CSCB2020相关资讯
撰写|张廷浩
元代杂曲家王实甫在《西厢记》中写道:“花落水流红,闲愁万种,无语怨东风”,这里的“花落”指的就是植物花器官的脱落,而东风指的是促使植物花器官脱落的一种外界环境胁迫。在植物的生长发育过程中,无论是营养器官叶还是生殖器官花,其发生的器官脱落都是植物发育生物学进程中非常常见的一种现象。高等植物的开花调控通常是经过一系列营养生长的养分条件积累和充分满足光照温度等环境条件适宜的情况下,才能完成由营养生长向生殖生长的过渡,进而开始花的形成。花的发育可分为开花过渡、分生组织特征决定、花器官发生和花器官形态建成四个阶段,在植物花形成的每一个阶段都需要相应的基因在特定的时空下完成表达并通过各种相互作用来精准调控花器官发生网络,因此,植物花的发育受到严格的遗传调控。
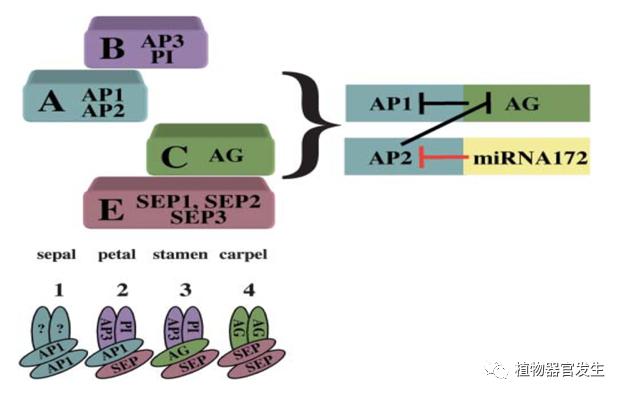
较为经典的是ABC开花模型的提出,1991年,一篇影响深远的文章首次将ABC开花模型完整的阐述出来,E. Coen和E. Meyerowitz从龙头花(Antirrhinum majus)和拟南芥(Arabidopsis thaliana)遗传分析入手,在对花器官发育有缺陷的突变体进行观察的基础上,系统介绍了各轮同源异型基因A、B、C的特异性组合决定花器官发生的机制[1]。随着研究的深入,SEPALLATA (SEP)基因的出现使得该模型更加完善,该基因也被称为E基因,SEP基因在花瓣、雄蕊和心皮发育中起重要作用的发现起初是由于矮牵牛和番茄的共抑制实验[2-3]。花器官发生的修正模型认为,A、B、C和E是花发育过程中出现的四种基因组合的表达活动,属于四种假定状态下的基因组合,不同组合对应花器官发生中萼片、花瓣、雄蕊和心皮,萼片仅由A来指定,花瓣由ABE调控,BCE控制雄蕊,CE调控心皮等。虽然各基因表达谱较为宽泛,但所编码的蛋白质都含有MADS盒区,使得表达产物与DNA相结合,进而影响转录,起到调控的作用,所以随着植物的发育,其表达开始受限,仅局限于相应表达区域。在拟南芥中,AP1的表达因AG在第三轮和第四轮的负调控作用由花芽限制到前两轮中(同AP2),在多个轮的表达中,其表达产物蛋白质通过相互作用联动了花器官各组分的确定及发育特化,形成稳定的蛋白质复合体协同作用,共同完成花器官的发生。
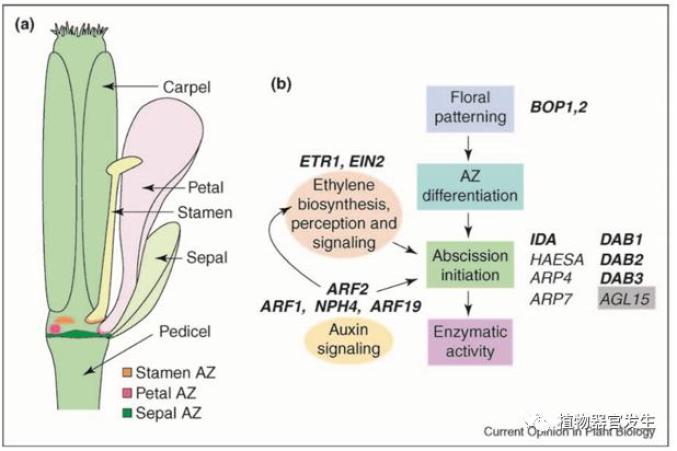
器官脱落是植物应对外界环境或到了一定的发育时期而选择自我凋亡的一种稳态机制,这种脱落器官附近的组织区域以及相邻数层细胞称为离层区(abscission zone, AZ ) [5]。番茄(Solanum lycopersicum)是研究双子叶植物花器官发育机制的重要模式植物,由于其日中性植物的原因,开花通常主要受发育阶段和遗传特性的影响和限制。目前蕃茄花器官建成主要有受UF和S调控的光周期途径以及受SFT和J调控的开花自主途径,J的作用相比于SFT较弱[6-7],番茄中自主开花途径中的J与拟南芥SVP为同源基因,但在调控开花中后者属于负反馈抑制拟南芥开花基因。上文提到花器官脱落与离层区密切相关,那么对于番茄花柄离层区的研究也就至关重要了,番茄离层区的发育控制基因J也是一个MADS盒区基因,研究证明J突变会导致离区的消失,而转基因互补实验也证实了这一点[8]。
以拟南芥的花器官脱落途径为例,拟南芥花器官建成后,花萼、花瓣和雄蕊三者在外部轮生并附着在花的基部,并具有不连续性的离层区。首先,花器官需要进行完整的形态建成,以便于在花的基部形成不同的分离带;BOP表达活性建立起花器官的近端识别体系,形成不同的离层区;在受精后,包括ETR1和EIN2在内的乙烯信号通路刺激花器官使其衰老脱落;ARF2与ARF1、NPH4、ARF19一起通过改变植物器官生长素的梯度,可能部分通过调节乙烯的生物合成来促进衰老(图2)。花器官脱落的具体时间由DAB2和DAB3决定,其部分机制仍不清楚。当发生脱落时,多种参与脱落的酶激发活性改变AZ细胞的细胞壁并进行溶解,从而达到花器官脱落的目的[9]。然而需要注意的是,这种脱落机制并非是单一孤立的,此外在番茄离层区特异表达上调的基因均与番茄的花序发育相关,也同样包括BL (blind), WUS (wuschel) 和LS (lateral suppressor)在内的许多分生组织发育相关基因,都直接或间接地参与了花器官的形态建成与脱落[10]。
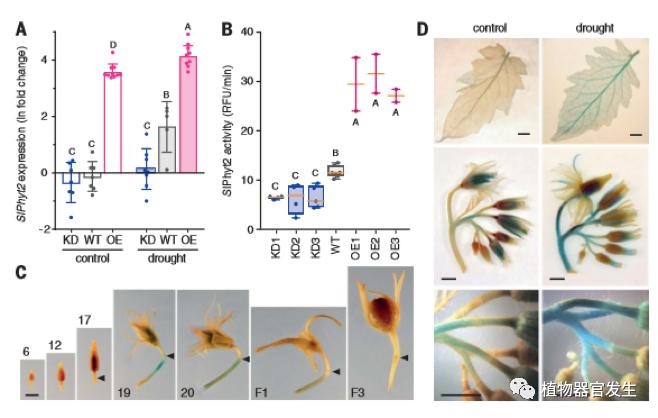
环境胁迫下植物花和果实的非正常脱落对作物的产量造成了严重的影响,器官脱落的调控机制主要在拟南芥花脱落系统得到了精准解释[11-12]。不久前德国霍恩海姆大学的研究人员发现了植物磺肽素(phytosulfokine,PSK)对于干旱胁迫下蕃茄花脱落具有十分重要的诱导调控作用[13],PSK属于一种由一个五肽和两个磺酸基团组成的多肽类激素,此前研究证实PSK可在促进植物生长发育和植物免疫系统中发挥作用。果茎上的离层区是蕃茄花器官脱落的主要发生区,正常的花需要保证离层区生长素的持续性供给,从而使得离层区维持非活跃状态,而当遭受外界环境胁迫或者花器官发育成熟时,便会通过一系列基因和激素的运转调控完成花器官脱落。在拟南芥中存在一个从IDA(INFLORESCENCE DEFICIENT IN ABSCISSION)蛋白中释放的小肽,它由类枯草杆菌蛋白酶丝氨酸蛋白酶调控表达,IDA多肽成熟后会激活一个包含受体激酶HASEA和SERK共受体的复合物,级联丝裂原活化蛋白激酶(MAPK)来调控细胞壁的水解和响应因子的表达。为了阐明番茄中花器官受环境胁迫提早脱落的相关分子机制,了解肽信号如何参与花和果实等器官脱落诱导,S. Reichardt等人筛选了大量不同的枯草蛋白酶过表达植株(图3),并发现过表达肌醇六磷酸酶phytaspase 2(SlPhyt2)的番茄转基因植株在干旱条件下存在花器官的过早凋落表型,同时SlPhyt2基因沉默的转基因植株(KD)坐果率高于该基因过表达的植株(OE)。

KD:SlPhyt2-silenced;OE:SlPhyt2-overexpressing
经过进一步研究发现,SlPhyt2的特异性底物是植物磺肽素PSK的前体,且存在于番茄中的8种PSK前体基因中SlPhyt1、SlPhyt4和SlPhyt6均在离层区表达,SlPhyt1表达量最高,且有三种PSK前体基因受干旱胁迫诱导。研究人员分析了SlPhyt2底物的特异性,发现PSK前体被SlPhyt2以Asp的特异方式进行切割并释放PSK,若将Asp切割位点换成Ala后SlPhyt2就无法识别切割PSK,这一点也说明Asp位点的重要性。前文提到,花器官脱落是通过离层区细胞中细胞壁水解完成的,而研究人员也证实PSK是通过诱导了细胞壁水解酶基因的相应表达和下调离层区保持在非活性状态的基因来实现番茄花梗脱落,并完成干旱胁迫下花器官脱落的,这与前文拟南芥花器官脱落中也通过AZ细胞完成脱落的机制具有相似性。
虽然在植物中广泛存在的PSK在干旱胁迫下对番茄提早花落的研究打破了此前所报道的具有促进植物生长和植物免疫的局限性,然而需要注意的是SlPhyt2在枯草蛋白酶中所属亚类的植酸酶是受植物种类限制的。根据现有资料,仅在少量的双子叶植物中发现,因此关于PSK调控离层区发育和器官脱落机制是否广发存在于开花植物中还有待于研究;同时,果实脱落受到生长素和乙烯信号的介导,而番茄中响应干旱胁迫的PSK如何参与两种脱落有关的激素介导仍是未解之谜。
参考文献
1. Coen ES, Meyerowitz EM. 1991. The war of the whorls: genetic interactions controlling flower development. Nature353:31-7 DOI: 10.1038/353031A0
2. Angenent GC, Franken J, Busscher M, Weiss D, van Tunen AJ. 1994. Co-suppression of the petunia homeotic gene fbp2 affects the identity of the generative meristem. Plant J. 5:33-44 DOI: 10.1046/J.1365-313X.1994.5010033.X
3. Pnueli L, Hareven D, Broday L, Hurwitz C, Lifschitz E. 1994. The TM5 MADS box gene mediates organ differentiation in the three inner whorls of tomato flowers. Plant Cell 6:175-86 DOI: 10.1105/TPC.6.2.175
4. Jack T. 2004. Molecular and genetic mechanisms of floral control. Plant Cell 16:S1-S17 DOI: 10.1105/TPC.017038
5. Bleecker AB, Patterson SE. 1997. Last exit: senescence, abscission, and meristem arrest in Arabidopsis. Plant Cell 9:1169-79 DOI: 10.1105/TPC.9.7.1169
6. Dielen V, Quinet M, Chao J, Batoko H, Havelange A, Kinet J-M. 2004. UNIFLORA, a pivotal gene that regulates floral transition and meristem identity in tomato (Lycopersicon esculentum). New Phytol. 161:393-400 DOI: 10.1046/J.1469-8137.2003.00937.X
7. Molinero-Rosales N, Latorre A, Jamilena M, Lozano R. 2004. SINGLE FLOWER TRUSS regulates the transition and maintenance of flowering in tomato. Planta 218:427-34 DOI: 10.1007/S00425-003-1109-1
8. Mao L, Begum D, Chuang HW, Budiman MA, Szymkowiak EJ, et al. 2000. JOINTLESS is a MADS-box gene controlling tomato flower abscission zone development. Nature 406:910-3 DOI: 10.1038/35022611
9. Lewis MW, Leslie ME, Liljegren SJ. 2006. Plant separation: 50 ways to leave your mother. Curr. Opin. Plant Biol. 9:59-65 DOI: 10.1016/J.PBI.2005.11.009
10. Szymkowiak EJ, Sussex IM. 1992. The internal meristem layer (L3) determines floral meristem size and carpel number in tomato periclinal chimeras. Plant Cell 4:1089-100 DOI: 10.1105/TPC.4.9.1089
11. Patharkar OR, Walker JC. 2018. Advances in abscission signaling. J. Exp. Bot. 69:733-40 DOI: 10.1093/JXB/ERX256
12. Ito Y, Nakano T. 2015. Development and regulation of pedicel abscission in tomato. Front. Plant Sci. 6:442–442 DOI: 10.3389/FPLS.2015.00442
13. Reichardt S, Piepho HP, Stintzi A, Schaller A. 2020. Peptide signaling for drought-induced tomato flower drop. Science 367:1482-5 DOI: 10.1126/SCIENCE.AAZ5641
来源:植物器官发生


原标题:《【科学普及】缘何花开花早落-“追凶”植物磺肽素》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




