- +1
新冠疫苗研发到底有多难?
原创 朱石生 读库
按:新冠肺炎在世界各地继续蔓延,还没有停息的迹象,许多人在期待相关疫苗早日问世,但研制疫苗并非那么简单。
读库“医学大神”系列的作者朱石生老师,专文介绍从乙肝到新冠的疫苗研发过程,展现人类在面对疫病的困难和智慧之光。
▼
歪打正着:乙肝病毒的发现
美国医师布隆伯格(Baruch Samuel Blumberg,1925-2011)是1976年诺贝尔生理学或医学奖得主,被誉为“拯救最多肝癌病人的人”。1950年代,他还是个医学生的时候就在想一个问题:为什么传染病的传播并非人人平等?
生活在同样的环境下,面对同样的传染病,有些人感染,有些人却不感染。于是他构筑了一个假说:每个人血液里的蛋白质形态不完全一样。这些不同的蛋白质结构,让人对传染病有不同的抵抗力。
他把这当作博士研究课题,决心找到这种特殊的蛋白质。1950年代,为了采集不同人种的血清样本,他跑遍亚非欧,把不同族群的血样带回实验室,分析血清里的蛋白成分。
分析思路是这样的:他知道血友病人需要反复接受输血,于是会接触到各种人的血清蛋白,而血友病人自身的免疫系统发现外来蛋白,会认为是一种抗原,进而产生一套对应的抗体。这种配对的抗原和抗体,外部形状能完美嵌合,嵌合之后产生的沉淀物,用染色剂去处理,会有不同的染色后果,根据这种染色变化,就可以分析抗原和抗体的生物学特性。
经过几年的研究,他发现所有人的血清里都有一种β脂蛋白,而这种脂蛋白似乎就是他想寻找的特种蛋白质,因为他似乎看到一种倾向,就是不同的族群,这种β脂蛋白似乎会有不同的形态特点。不过,这只是一种初步的猜测,是不是确实如此,需要检验更多的样本。于是他让助手继续用这种β脂蛋白跟来自世界各地的血液样本做测试。
正常情况下,这种β脂蛋白跟别人的血清相遇,产生的沉淀物会被一种叫作苏丹黑的染料染成深蓝色。但有一天,某个样本的沉淀物却没有出现这种蓝色。助手尝试不同染料,发现这种沉淀物能被偶氮胭脂红染成红色,这说明该样本具有某种与众不同的蛋白质,或者说,一种与众不同的抗原。
布隆伯格查看了样本来源,这份血清的主人是远在澳大利亚的一个毛利土著,于是布隆伯格把这种抗原叫作澳大利亚抗原,简称澳抗。
那么,这是不是毛利人特有的什么蛋白?凭一个案例不能下结论。布隆伯格以这种反应作为新的出发点,顺藤摸瓜,继续调查,发现有不少白血病人的血液里也会出现这种属性的沉淀物,就是说,这些白血病人的血液里也有这种特殊抗原。
看来这种抗原不是那位毛利人特有,而是跟白血病的发病有关。如果能证明这一点,今后一个婴儿刚生下来,我们就可以检查他的血液里是不是有这样的抗原。如果有,就意味着他将来很可能会患白血病。这对诊断有价值,甚至可能对治疗和预防也有价值。
根据统计,唐氏综合征的患儿后来患白血病的概率很高,所以布隆伯格追踪观察一批唐氏综合征患儿的血清,试图证明澳抗跟白血病存在必然关联。那个年代,唐氏综合征患儿会集中在精神病院或者疗养院接受护理。布隆伯格在一个大型精神病院检测了一批唐氏综合征患儿,发现澳抗阳性率高达30%。
这符合他的假说:唐氏综合征患儿有澳抗,所以容易出现白血病。好像可以出论文了?
布隆伯格没有立即下结论。他给自己提出的下一个问题是,所有唐氏综合征患儿的澳抗阳性率都这么高吗?
他继续在不同场合给唐氏综合征患儿做检测,结果却很不一样。在大型精神病院里的患儿,澳抗阳性率固然很高,但如果是在小型家庭式疗养院里寄养的患儿,阳性率会下降到10%,如果患儿住在自己家里,阳性率则只有区区1%。
这些数据让他开始质疑自己的假说。如果澳抗是先天携带的特殊抗原,那么后天的生活环境几乎不可能改变它的出现概率。而历史上,大型医院里常常发生交叉感染,这些大型精神病院里的患儿大量出现澳抗阳性,难道是因为一种能传染的疾病?
为了持续追踪澳抗的属性变化,他定期给作为研究对象的唐氏综合征患儿复查。最近一轮复查中,一名十二岁患儿的澳抗是阳性,但记录说明早先他的澳抗是阴性。
这就完全推翻了先天体质的理论。如果是先天决定的特异蛋白质结构,应该是生下来就有,不会等到十二岁才出现。这男孩十二岁才出现澳抗,最可能的原因是最近他患上了某种传染性疾病。
他给男孩做传染病筛查,果然发现这男孩患有肝炎。
恰好这个时候,实验室里的一个助手维尔纳(Barbara Werner)提供了有力证据。维尔纳从项目一开始就自愿充当实验对象,但她那时检测澳抗阴性,所以她是作为对照组提供血样。最近因为不舒服去看病,检查发现她患了肝炎。回到实验室复查,布隆伯格发现维尔纳的澳抗转成了阳性。
这么看,这种特殊血清抗原,不是白血病的表现,而是肝炎的表现。
这打破了他追求十几年的假说,但是他立刻意识到,能找到肝炎的病因,意义更为深远。全球有上亿人患肝炎,而其中许多人最终会转变成肝癌。这样的疾病,对人类的危害比白血病更大,能在这方面有突破,对医学发展的意义也就更大。
1965年,布隆伯格把研究结果发表之后,全世界的科学家都明白这个发现的潜在意义,于是纷纷设计实验,试图证实澳大利亚抗原跟肝炎的关系,很快就积累了许多间接证据。最后,1970年,英国生物学家戴恩用电子显微镜观察澳抗阳性血清,看到了特征性的病毒颗粒。

接下来他直接在肝炎病人的肝细胞里看到同样的病毒颗粒,这就是乙肝病毒。而布隆伯格发现的澳大利亚抗原,后来我们都知道了,那是乙型肝炎病毒的外壳蛋白。
那以后,澳抗的名字就变成了乙肝表面抗原。
明白这一点之后,美国雅培公司探索出一种测试方法,用来检测献血人的是不是感染了肝炎。这可以避免带病毒的血液进入血库,于是大大减少了输血导致的肝炎。
十年之功:传统乙肝疫苗
发现乙肝病毒让人们兴奋,是因为,通常来说,知道了原因就可能找到治疗方法。但人们很快发现,病毒比细菌要难对付得多。1930年代我们就有了杀菌的磺胺药,1945年青霉素进入市场,那以后细菌感染的治疗不再是什么难题。可是对于病毒,别说是1960年代,如今二十一世纪了,能在体内有效杀死病毒的药物依然寥寥无几。
既然没有治疗药物,能不能用疫苗预防?天花也是病毒感染,也没有药物可以治疗。但在1960年代,凭借牛痘疫苗,人类已经几乎从地球上消灭了天花。如果能开发出乙肝疫苗,我们也有可能控制住乙型肝炎。
詹纳找到的牛痘疫苗,让我们能消灭天花,但那是利用天然病毒的近似抗原,是没法重复的特例。我们后来能人工制造疫苗,是因为十九世纪末叶法国科学家巴斯德的一个重大发明,基本原理就是是用各种方法(加热、脱水、氧化、迭代培养等等)处理致病微生物,让它们的毒性减弱(减毒处理)。
用这种毒性减弱的微生物给人接种,不会让人真的生病,却能在人体内激发一套免疫反应。于是人体就获得了针对这种微生物的免疫力。这段故事,详见“医学大神”之《天花旧事:詹纳与牛痘接种》和《天纵之才:巴斯德与人工疫苗》。
在巴斯德之后,技术细节有一些改进,比如可以把微生物杀死(而不是减毒)做疫苗,或者只用微生物的一些残片,比如膜上的一个结构特殊的蛋白质,也能激发免疫反应。这是因为,人体免疫系统寻找致病微生物的时候,并不需要看到微生物的整体,只需看到这些微生物的一个特征标志就行。这就像在战场作战的时候,士兵不需要知道对面壕沟里的人是张三还是李四,他只要看到对方穿着敌军军服就可以开枪。
默克公司名下的默克学院,有一位病毒学家叫作希勒曼(Maurice Ralph Hilleman,1919-2005)。希勒曼看到乙肝表面抗原的报道,结合以往的疫苗研发经验,就有一个想法:乙肝表面抗原是病毒的一个残片,这是乙肝病毒的一种特殊标志,那就有可能可以用来做疫苗。
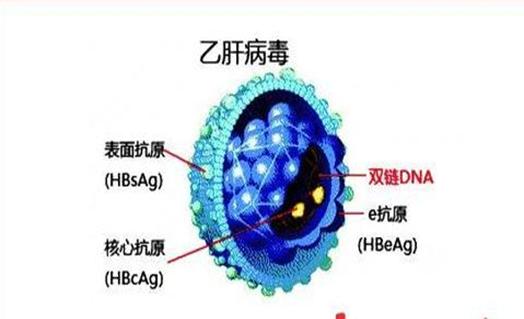
1971年,希勒曼和同事们开始做这种尝试。他们的目标是要找到一种方法,可以把乙肝表面抗原从病毒身上剥离,然后在混合液里去掉病毒的基因载体DNA以及其他附件,只保留外壳上面的那个表面抗原。乙肝病毒能致病是因为它内部的DNA。它的外壳是没有致病能力的。所以只要能提取纯净的乙肝表面抗原,它具有的特征蛋白结构依然可以激发免疫反应,同时又不会让人生病。
他们研究近十年,最后找到的方法是用蛋白酶、尿素和甲醛来处理乙肝病毒,这样就能把病毒的外壳蛋白给剥离。然后再用高精度的过滤筛选方法,从混合液里去除壳蛋白之外的其他成分,成功开发出第一代乙肝疫苗,1981年进入市场。
超乎想象:基因时代的疫苗研发
这种疫苗效果很好,但其中的乙肝表面抗原只有一个来源:肝炎病人的血清。这就让人感觉不放心。实际上,希勒曼的乙肝疫苗确实曾经被指控传播了艾滋病。这是因为,当时希勒曼是从同性恋者和静脉用药的吸毒人群里寻找肝炎病人。这两类人都特别容易罹患各种病毒性传染病,包括肝炎和艾滋病。但是希勒曼研发乙肝疫苗的时候,医学界还不知道艾滋病这种东西。
1981年,正好是第一代乙肝疫苗获得上市许可的时候,艾滋病被鉴定出来,于是很多人指责希勒曼制作的疫苗导致了艾滋病传播。管理部门响应舆论,对这种疫苗做了检验,证明希勒曼是无辜的。他们的过滤法可以去除一切病毒,包括艾滋病毒,所以他们制作的疫苗不会导致肝炎,也不会导致艾滋病。
但是,担心的人还是继续担心,觉得从病人血清里获得疫苗素材太危险。生产厂家也有自己的忧虑,随着乙肝疫苗的推广,患乙肝的病人或许会越来越少,那么就会越来越难找到带乙肝病毒的血清做原料。
理论上说,在实验室里培养微生物是另一种方法。比如流感病毒可以用鸡胚培养。但是每种病毒要求的培养基不一样。那个时候,医学界还没找到培养乙肝病毒的可靠方法。
当然,希勒曼的疫苗,需要的不是完整病毒,而只是它的外壳残片,就是叫作乙肝表面抗原的那个东西。如果我们不能培养完整的病毒,能不能想办法培养这个外壳残片?
这种想法本来近乎天方夜谭。用一个比喻来说,这就像有人跟你说他养鸡养不活,所以吃不到鸡腿,然后你跟他建议说:“那你能不能别养鸡,只养鸡腿?”
但是1980年代出现的基因工程技术,让我们真的可以做这样的事:生产出纯净的乙肝表面抗原,也就是乙肝病毒的外壳蛋白。仅仅是外壳,不含病毒本身。
怎么做到的?
原理其实并不复杂。所有生物体内的蛋白质都是在基因指导下合成的,包括乙肝表面抗原这样的蛋白质。我们要做的就是,第一,找到控制生产乙肝表面抗原的那段基因;第二,找一个代孕生物,让它按照这个基因的指导来生产蛋白质。这么产生的蛋白质就是乙肝表面抗原。这是纯粹的病毒外壳蛋白,没有病毒核心的DNA,不会导致肝炎。另外,因为现在我们是用代孕生物来生产这种蛋白,不需要从病人血清里采集原料,也就不用担心会有其他细菌或者病毒的污染。如果我们能这样生产乙肝疫苗,安全性就可以大大提高。
什么样的生物可以做代孕生物?说起来很家常,最佳选择就是酵母菌。把找到的那段基因用化学方法嵌入一种叫作质粒的细胞器里,再把这样的质粒植入酵母菌体内。这种酵母菌的基因里嵌入了乙肝表面抗原的片段,它肚子里的核糖体就会根据这段基因的指导,不断生产出乙肝表面抗原,这就是做疫苗的原材料。酵母菌虽然小,但是繁殖速度非常快。把它们放到几米高的培养罐里培养,很快整个大罐里就都挤满了这样的酵母菌。所以大量生产不是问题。这就是第二代乙肝疫苗,1986年获得FDA批准。
在掌握基因工程技术之前,要开发针对某种微生物的疫苗,我们必须用各种物理或者化学方法处理这种微生物,试试看哪种方法能让微生物减毒,或者通过一代又一代的培养,等待微生物变异,从变异的后代里面寻找低毒株。这样的做法,碰运气的成分很大。用一个比方来说,就好像是把乐高玩具放在一个黑箱里,再端起来用力摇晃,让乐高在碰撞中拼出不同的组合,然后我们从里面选出我们需要的形状。
基因工程技术让我们能直接检视所有基因,分析这些基因的功能,然后有针对性地处理它们。这就像是把乐高从黑箱里拿出来,按照需要精确拼装。
每一种致病微生物的基因都有很多片段,能控制不同蛋白质的生产。其中有些蛋白质是让我们生病的关键成分,有些则只是装饰成分或者冗余成分,没有致病能力。比如霍乱弧菌,它有三个特征性的蛋白质,分别叫作A1、A2和B。
其中A1和A2有致病毒性,B是无毒的附属成分。借助基因工程技术,我们可以敲掉控制生产A类蛋白质的那些基因,只保留控制生产B类蛋白质的基因。这么处理过的霍乱弧菌做疫苗,能激发我们需要的免疫反应,却不会导致疾病,这就很安全。一种叫作CVD103-HgR的霍乱疫苗就是这么制作的。
除恶扬善:更高效,更安全
剔除致病基因片段可以叫作除恶。基因工程技术不仅可以除恶,也可以扬善,就是挑选优质基因片段。“优质”的标准是,这段基因指导生产的蛋白质,没有致病力,却能激发最有效的免疫反应。人类乳头瘤病毒疫苗(HPV疫苗)是这种技术的实例之一。
人类乳头瘤病毒是最常见的性传播疾病,跟很多皮肤粘膜疾病有关,比如宫颈癌、阴道癌、生殖器疣等等。人类乳头瘤病毒的亚型非常多,其中能经性行为传播的就有近四十种。目前最常用的两种疫苗,针对的是6、11、16、18这四种危害最大的亚型,所以叫作四价疫苗。后来的疫苗针对的亚型增加,这个“价”前面的数字也就相应增加。
人类乳头瘤病毒的外壳由两种蛋白质构成,其中一种叫作L1的蛋白质占了83%。L1蛋白质被生产出来之后会自动扎推,然后折叠成病毒外壳的形状,看起来就跟一个真的病毒差不多。这样的习性对于疫苗开发非常有利,因为它看起来很像完整的病毒,这就会激发强烈的免疫反应。但它实际上是个空壳,没有致病能力,用这样的蛋白空壳做疫苗,效果好,却又很安全。
因为这样的优势,免疫学家特意给这种高仿真的蛋白外壳起了个名字,叫作类病毒颗粒(virus-like particles, VLP)。人类乳头瘤病毒的L1蛋白质,就是一种能形成类病毒颗粒的蛋白质。有这样的特性,我们自然应该充分应用。生物学家把负责生产L1蛋白的基因植入酵母菌或者昆虫细胞里,让它们代孕生产出L1蛋白质。
这些蛋白质一旦被生产出来,就自发形成一个个病毒外壳蛋白。有了这样的蛋白质空壳,再加上一些辅剂,就能激发有强烈杀病毒能力的抗体。目前在使用的人类乳头瘤病毒疫苗就是这么生产出来的。
这些技术都是利用某种代孕微生物替我们生产特定蛋白质,然后用这种蛋白质做疫苗。我们能这么做,是把特殊的基因片段(比如控制生产L1蛋白的基因片段)植入代孕微生物体内,利用代孕微生物的核糖体“打印”出我们需要的蛋白质。后来有生物学家想到,核糖体是生物共有的东西,人体细胞自己就有核糖体。那么我们是不是可以跳过代孕微生物这一步,直接利用人体自己的核糖体?
要做到这一点,关键在于把那个特殊基因片段送入人体细胞里,这就需要有个载体做运输工具。一番探索之后,发现病毒就可以拿来做载体。我们可以选相对无害的病毒,比如腺病毒,再用基因技术敲掉它的一些基因片段,让它绝对不可能让人生病,然后把特殊基因(比如L1控制基因)拼接到腺病毒身上。
这样处理过的病毒进入人体之后,有能力进入细胞,但不会导致疾病。而他们携带的那段基因却会被人体细胞的核糖体解读,然后打印出我们需要的蛋白,比如L1蛋白。这就可以激发出对应的免疫反应。
再后来,研究发现,其实连病毒载体都不是必须的。某些种类的基因片段,直接注射进肌肉里之后,它们会自己钻进人体细胞,于是被核糖体解读和“打印”。这种类型的疫苗被叫作基因疫苗。
光速仍嫌慢:新冠疫苗研发现状
病毒载体疫苗和基因疫苗都是从病菌或者病毒的基因里截取一个片段,这样的片段对人无害,却能激发有效的抗体,理论上说很理想,只是因为具体实施的技术要求高,直到2019年底都还处于动物实验阶段,但2020年的新冠病毒疫情让人们大幅度调整了战略。
新冠病毒跟萨斯病毒虽然都属于冠状病毒,但两者的病理特点却非常不一样。萨斯能被消灭,是因为它在潜伏期没有传染性,而一旦发病就有很容易识别的症状,比如体温升高,于是我们能有效地识别出病人,及时阻断传播链。新冠病毒感染早期症状不明显,甚至很多人感染全程都毫无症状,但无症状的感染者却有传染性,这就意味着这种病毒非常不可能从地球上消灭。
所以,世界各地的科研机构都在全力以赴研发新冠病毒疫苗,为了加快研发速度,连FDA也放宽了一些传统的伦理要求。目前有近五十种新冠疫苗项目在紧锣密鼓地进行,各种疫苗研发技术,包括最尖端的病毒载体技术和基因注射技术都有机构在尝试,有些已经进入临床一期实验。
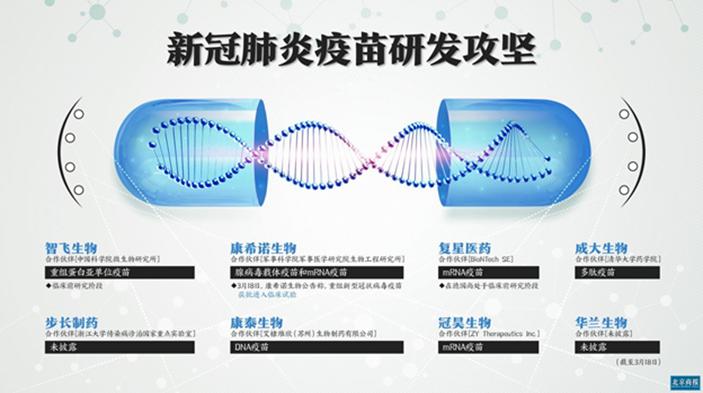
中国康希诺公司采用的是病毒载体技术。新冠病毒要入侵人体细胞,靠的是蛋白外壳上一种形状特别的刺突蛋白(S蛋白)。我们需要做的是找到生产刺突蛋白的基因片段,把它截取下来,用基因工程技术拼接到腺病毒的基因里,然后把这样的腺病毒注入人体。
腺病毒带着这种基因片段进入人体细胞,核糖体就会根据这段基因打印出刺突蛋白——仅仅是那个刺突,没有完整蛋白外壳,更不会产生病毒内部的RNA,这样的蛋白残片对人体无害,但因为它是人体免疫系统没见过的外来蛋白质,免疫系统照样会发起攻击,制造出针对这种刺突蛋白的抗体,于是可以把入侵人体的病毒消灭掉。
法国巴斯德研究院采用的是类似的技术,但他们是利用现有的麻疹疫苗。麻疹疫苗是用真正的麻疹病毒减毒之后制作,因为经过减毒处理,就不再有致病能力。这样的疫苗使用多年,安全性早已得到确认。巴斯德研究院的研究者把刺突蛋白基因片段组合进麻疹疫苗里,让它们把这段基因带进人体细胞,就可以激发我们需要的抗体。
这个做法若是成功,就可以利用各个厂家现有的设备,因为麻疹疫苗是很多厂家都在持续生产的。目前这个疫苗在小鼠实验里能激发抗体,接下来还有许许多多的步骤需要完成。如果实验结果理想,大约二十个月之后可以获得认证,之后需要解决的,就是量产和运输问题了。
美国麻省的摩登那药业(Moderna)正在研发基因疫苗,就是直接把控制刺突蛋白生成的基因片段注入人体。他们从2020年3月16日开始做早期临床测试。这个测试只是初步检验人体安全性,并证明注射这样的基因片段确实能激发人体免疫系统产生抗体。
但是,激发出抗体并不保证能在人体里控制住病毒,某些时候,抗体甚至会加速病毒的扩散。在菲律宾暴发登革热的时候就曾经发现这种逆反现象,术语叫作抗体依赖性增强机制(antibody-dependent cell-mediated cytotoxicity,缩写ADCC)。所以看到一种候选疫苗能在实验对象体内激发抗体,并不等于这种抗原必定能控制疾病。摩登那的这个疫苗要真正获得批准,还需要做很多实验,证实有效性和安全性,探索适合剂量,观察特殊人群(老年或是幼儿)的反应等等。摩登那预计需要十八个月才能完成研发。
即使摩登那的这种疫苗获得批准,进入量产也需要时间。基因疫苗是一种全新技术,世界上任何疫苗生产厂家都没有现成的生产设备,需要从零开始学习技术,建立生产线,如果运输有特殊要求,还需要建立专用的运输网。
为什么研发新冠疫苗需要这么长时间?
其实,对于疫苗研发,二十个月已经可以算是光速。一般情况下,一种新疫苗的开发周期是十到十五年。疫苗跟药物一样,需要证实有效性,也需要观察毒性。急性毒害相对容易发现,有些慢性毒性则需要很长时间才能观察到。为了防止误伤人类,早期都只能用动物做实验,然后才是更为慎重的人体试验阶段。药物只用在病人身上,疫苗却要用在健康人身上,而且理论上应该是全民接种,所以涉及面要比药物大得多,安全性的检验也就必须更加严格。
新冠病毒疫苗研发困难,还有一个原因,就是这课题太新。
萨斯之前,传统的冠状病毒只会导致感冒这样的轻微疾病,所以没人试图研发针对冠状病毒的疫苗。2003年萨斯暴发,曾经有机构紧急研发萨斯疫苗,但几个月之后萨斯疫情平息,野外已经不再有萨斯病毒,对疫苗的需求不复存在。中东呼吸综合征也是冠状病毒导致,但根据世界卫生组织报告,这种病毒人传人的可能性“极低”,相对而言风险也不是太大,于是研究人员就把视线转向了更紧迫的项目。
这次新冠暴发,我们仅有的知识积累就是萨斯和中东呼吸综合征病毒的研究所得。跟其他病毒(比如流感病毒)相比,这样的知识积累谈不上丰富,但也不是一无所知。就疫苗开发来说,我们知道新冠疫苗身上有一种东西很能制造麻烦,就是聚糖。本来病毒结构特别简单,基本上就是一层蛋白壳包着肚子里的遗传物质(DNA或者RNA)。
但病毒入侵宿主之后,在宿主的免疫系统试图消灭病毒时,病毒的变异过程会让它们产生出一些逃避免疫系统攻击的本事。聚糖就是这样产生的。一些病毒感染宿主之后,除了能劫持宿主细胞的核糖体来制造蛋白外壳,还能劫持宿主细胞的某些酶类,给自己的蛋白外壳添加一个附加成分:聚糖。
为什么这样的聚糖能制造麻烦?
因为免疫系统发动攻击的时候,必须确保攻击对象是病毒而不是自己主人的细胞。能有这样的准确性,是因为免疫系统产生的抗体都有特别的三维结构,可以跟病毒蛋白外壳上的某种三维结构准确嵌合,就像一把钥匙配一把锁。
这样的三维结构识别是精准攻击的关键。如果病毒蛋白外壳有太多的聚糖,就会干扰抗体的识别过程。用一个比方,病毒外壳的特征蛋白就像一颗灌木,那些聚糖就像乱草。灌木周围乱草越多,我们就越难发现掩埋在里面的那丛灌木。
更可恶的是,这些聚糖的外形并不是固定不变的。病毒蛋白外壳上有几十个可以让聚糖停留的位点,但聚糖只有跟外壳蛋白联接的时候才会固定下来,否则它们的结合位点随时可以变动,也就是说,这堆杂草的外形会随时改变。
目前研发的新冠疫苗,攻击对象都是新冠病毒蛋白外壳上的刺突蛋白。这样的疫苗如果成功研发出来,注射给人之后,会激发出一套抗体,这些抗体有特殊的三维结构,能跟新冠病毒刺突蛋白的三维结构精准嵌合,这就让刺突蛋白不能去欺骗人体细胞膜上的血管紧张素转化酶2(ACE2)受体,于是失去感染能力。
但所有冠状病毒的蛋白外壳都有大量聚糖结合位点,比其他病毒多得多,新冠病毒外壳上丰富的聚糖,很可能让抗体难以正确识别那些刺突蛋白。
能感染人类的冠状病毒有七种,包括萨斯病毒和中东呼吸综合征病毒,但迄今我们没能开发出针对冠状病毒的疫苗,这些聚糖的干扰是一个很重要的原因。从现有经验看,新冠病毒的研发会遭遇很多难题,并不是说投入人力物力就必定成功,有可能耗费无数资源,最终还是没法开发出有效的新冠疫苗。
另外,新冠病毒是RNA病毒,这种病毒变异非常快,那么从理论上说,就算疫苗研发成功,也可能几个月之后新冠病毒就变异出新的株型,于是现有的疫苗不再有效。
无方之法:群体免疫
万一无法开发出疫苗,或是疫苗的更新赶不上病毒的变异,我们的最后一道防线就是群体免疫。
群体免疫是一种自然存在的现象,它指的是,一个群体里如果有足够多的人对一种疾病有免疫力,病菌或是病毒就难以传播。因为,即使群体里有一个人感染,倘若周围其他人大都有免疫力,这种致病微生物就没法传播出去,也就是没法形成传播链。
因为这个原理,一个群体里,只要有免疫力的人数达到某个阈值,就可以阻止一种致病微生物的广泛流行。这个阈值是多少,取决于病毒的传染力。比如1918年的大流感,在全球造成超过五千万人死亡,当时没有药物也没有疫苗,但两年之后大流行也就自行平息。之所以会平息,最大可能是因为有足够多的人感染了病毒并随即康复,于是具备免疫力,这些人就为整个社会提供了群体免疫。
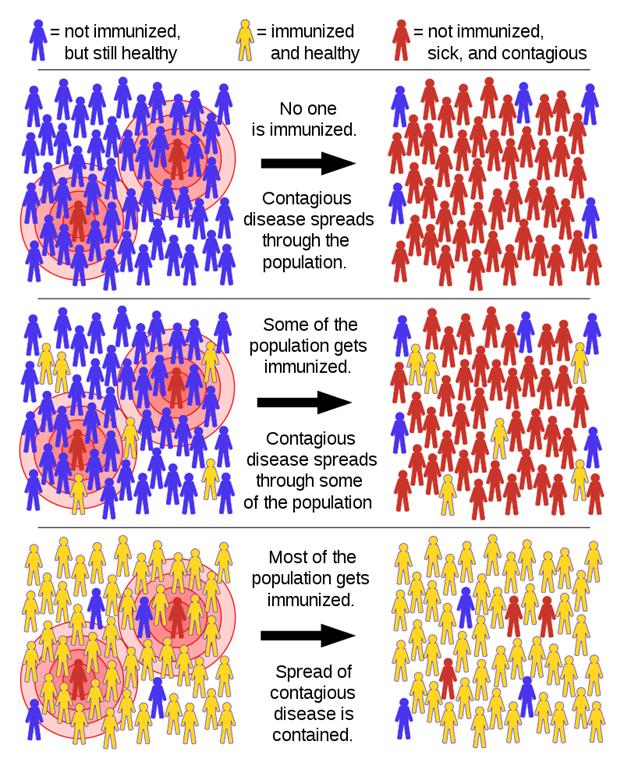
需要多少人具备免疫力,才能形成有效的群体免疫?根据传染能力(R0)推测,对于那次流感,大约只需要三分之一的人具备免疫力,就可以截断病毒的大面积传播。新冠病毒传播能力比流感强,需要的阈值更高,但只要人口里有足够多的人具备抵抗力,就可以形成群体免疫,那么即使今后有新冠病毒出现,也只会在小范围内传播,这样的局面就跟现在的流感类似,不会对社会造成巨大冲击。
即便是依靠“群体免疫”,也不是说人类毫无作为,听任病毒肆虐。
群体免疫是一种社会状态,要达到这种状态,靠接种疫苗是最理想的,在缺乏疫苗的情况下,另一种做法是靠自然接触。倘若必须走自然接触的道路,正确的做法是优先保护高危群体,比如让老人、婴幼儿或是有其他健康问题的人全天居家,避免接触病毒。而年轻人感染死亡率近乎零,可以有控制地让年轻人在社会活动。“有控制”的意思是,根据流行趋势,实施特定人群甚至全社会的人际疏离(social distancing),避免短时间太多病人感染,以至于超过医院的处理能力。有这些控制措施,就能让病毒对社会的破坏降到最低。
当然,无论怎么小心,这个过程中,总会有一批人因为免疫系统敌不过病毒而死去,但如果没有疫苗和药物可用,这将是我们必须面对的现实,不管这个现实如何残酷。
新冠病毒传播方式隐匿,可谓防不胜防,而我们也不可能长期让所有人躲在家里逃避病毒,那样做,造成的损失(包括新冠病毒感染之外其他病人的生命损失)很快就会超过新冠病毒可能带来的损失。
▲
本文作者:朱石生
前医生,科普作家
原标题:《新冠疫苗研发到底有多难?》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




