- +1
姜世勃:应砍掉重复新冠研究,勿重演“非典一走一哄而散”
编者按:面对全世界多达78个已获确认的新冠疫苗候选项目,长期从事抗冠状病毒疫苗和药物研究的复旦大学病原微生物研究所所长姜世勃感到“悲喜交加”。喜的是,以前绝对不敢想象有56个私人药企能够投资研究抗冠状病毒疫苗;悲的是,怕17年前SARS疫情时的情景再现:病毒一来,一哄而上,病毒一走,一哄而散。
“我回国十年来,我们是很少几个还在做抗SARS药物和疫苗研究的团队之一,工作非常困难,无论如何都申请不到研究基金,因为大家都认为SARS永远不会再来,为什么要做一些没有意义的研究。”
4月23日,姜世勃在科学公益组织未来论坛发起的“《理解未来》科学讲座:病毒与人类健康-专题科普”上呼吁,尽快将那些重复的项目或者成功率很低的项目砍掉,将那些可能浪费的资金抢救过来用于长期战略储备的科研项目,比如广谱抗冠状病毒疫苗和药物的研发。
他认为,本世纪近20年来3次冠状病毒的疫情造成的经济损失多达数万亿美元,政府和各类组织如果能拿出1%损失的经费来支持广谱抗冠状病毒疫苗和药物的研发,今后就可以从容地应对新发与再现的冠状病毒疫情的爆发。
演讲全文由中科院生物物理所博士生李敏、郭丽洁整理。澎湃新闻经授权后二次整理、发布。
姜世勃:广谱抗冠疫苗和药物是战胜新冠疫情的终极武器
今天的演讲分三部分,第一部分介绍中国科学家在防控新冠肺炎疫情中所创造的几项历史记录。第二部分介绍为何我们要研发安全、高效、广谱的抗新冠病毒疫苗以及如何研发。第三部分讨论为何要研发安全、高效、广谱的抗新冠病毒药物以及如何研发。
2020年春节是一个惊心动魄、令人难忘的春节,早在去年11月我就已经买好了回纽约的机票,期望和家人过一个愉快的团圆年。为了给我那刚半岁的小外孙见面礼,我订购了一箱子衣服和玩具。元月3日我在打包的时候忽然看到电视报道,“武汉市卫健委通报,武汉发现不明原因的病毒性肺炎诊断患者44例,重症11例。
元月8日国家卫健委宣布武汉不明肺炎的病原体为一个新型冠状病毒,凭着自己17年从事SARS和MERS研究的经验,立刻意识到一场类似于2003年SARS的瘟疫可能会暴发,所以我立即决定退票,并要求实验室几位还未离校的同事和研究生也要退票,组织了一个攻关小分队。
1月11日,新冠病毒的基因上线,我们立即分析了刺突(S)蛋白序列,设计了多肽和疫苗抗原,建立了假病毒感染和细胞融合系统,联系了国内外多家合作单位开展基础合作研究,联系国内外生物制药公司开展临床前合作研究以及向国内外多个基金组织申请科研基金。


还有武汉病毒所肖庚富研究员的团队,在20天内发现可用于治疗新冠肺炎的药物比如瑞德西韦、氯喹,他们文章发表在Cell Research,在短短的两个月之内已经被98万人次点击,引用107次,现在这两个药已经在临床使用或在临床观察当中。这也是一个奇迹。
在3月19日,军科院陈薇院士领先研发的新冠疫苗获批临床试验,现在108名志愿者已经完成了一期临床试验,同时第二期临床试验已经于4月9日开始,该科研团队在三个月内完成了抗新冠疫苗的设计、实验室制备、动物免疫及抗血清检测、在新冠肺炎动物模型中的有效性评估、疫苗的cGMP制备、动物的GLP安全性评估、I期临床试验,这绝对也是一项世界纪录。
国家卫健委卫生科技发展中心的郑主任介绍,我们目前有5条研发技术路线,包括灭活疫苗、基因工程重组亚单位疫苗、病原体载体疫苗、减毒流感病毒载体疫苗、核酸疫苗等等,大概有十几项疫苗项目正在进行中。
他特别提到研发单位不计成本将部分串联的研发过程进行合理并联,有效地推进了研发过程。什么叫“并联”?我们按正常程序一个疫苗研究从最初抗原制备到动物免疫、中和活性鉴定、动物攻毒保护实验、动物安全性评价到临床试验,一直到规模化生产,这整个过程可能需要四至五年甚至十几年才能完成。但是现在我们希望能在一年之内完成这些工作,所以不能按照常规的方法进行。常规方法是循序渐进,一步完成以后再进行第二步、第三步,现在是多个团队在同时进行,有人在检测中和活性,另外有人做动物攻毒实验、动物安全性评价以及临床研究,多个团队同时进行就是将串联改成并联。
为什么说“不计成本”?这是有一个风险非常大的研发策略,比如一个团队在动物攻毒实验的时候发现这个疫苗没有保护效果,而其它团队已经完成的工作,如规模化生产等这些部分都前功尽弃了,可能会损失很多经费。所以,只有在特殊情况下才能采取这种策略。
美国在这方面的研究进展也很快,3月16日美国一个公司在新冠病毒基因序列公布8周后宣布首个新冠冠状病毒疫苗I期临床试验在美国西雅图开始,首批45名被试中的4名成年受试者接受了第一针试验性疫苗注射。这是一种mRNA疫苗,由美国国立卫生研究院和生物制药公司Moderna共同研发,如果这批疫苗能够成功地通过考验上市,它将是世界上第一个被用于预防接种的mRNA疫苗。除了这两种疫苗外还有第三种DNA疫苗进入临床试验。现在全世界在研发的候选疫苗有115个,这是在WHO疫苗开发计划清单中的疫苗,有100多个,其中5个已经进入了临床试验,18个进入了临床前试验阶段。
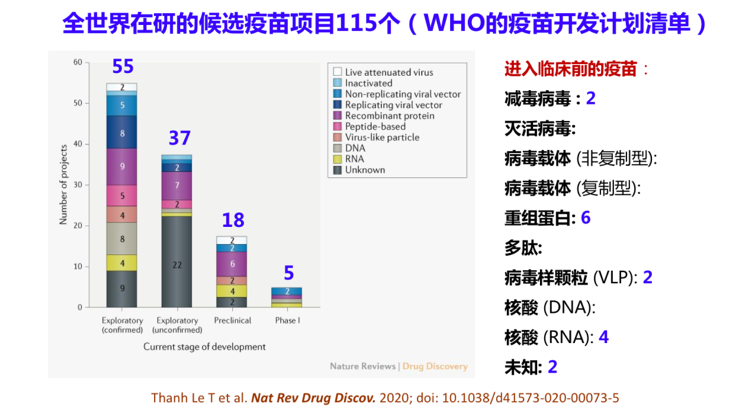
喜的是终于看到有56个私人药企能够投资研究抗冠状病毒疫苗,这是以前绝对不敢想象的。悲的是,17年前的SARS悲剧可能再次重演。病毒一来,一哄而上,病毒一走,一哄而散。当年SARS出现的时候也是几十、上百个抗SARS疫苗和药物项目匆忙,但SARS过后,95%以上的项目撤掉了,造成了人力、物力和财力极大的浪费,可是一些坚持从事抗SARS药物和疫苗研究的科研人员却申请不到经费。我回国十年来,我们是很少几个还在做抗SARS药物和疫苗研究的团队之一,工作非常困难,因为无论如何都申请不到研究基金,因为大家都认为SARS永远不会再来,为什么要做一些没有意义的研究。
这次新冠出来以后全世界有800多个,中国有500多个新冠病毒相关的临床试验注册,其中包括疫苗、药物和诊断试剂,很多是重复的项目。如果此次疫情在年内缓解,绝大多数项目会立刻下马,又要造成巨大的物力和财力得浪费。所以我建议应该由世界卫生组织和多国政府进行协调,尽快将那些重复的项目或者成功率很低的项目砍掉,将那些可能浪费的资金抢救过来用于长期战略储备的科研项目,比如广谱抗冠状病毒疫苗和药物的研发。本世纪近20年来3次冠状病毒的疫情造成的经济损失多达数万亿美元,政府和各类组织如果能拿出1%损失的经费来支持广谱抗冠状病毒疫苗和药物的研发,今后就可以从容地应对新发与再现的冠状病毒疫情的爆发。
在3月17日,我在Nature发文呼吁“不要匆忙部署没有足够安全保证的疫苗和药物”。文章发表后,国内外几十家媒体要求采访,大家都对这个事情非常感兴趣,也对我的看法表示认同。大家认为安全性、有效性和广谱性是疫苗研究中非常值得重视的。
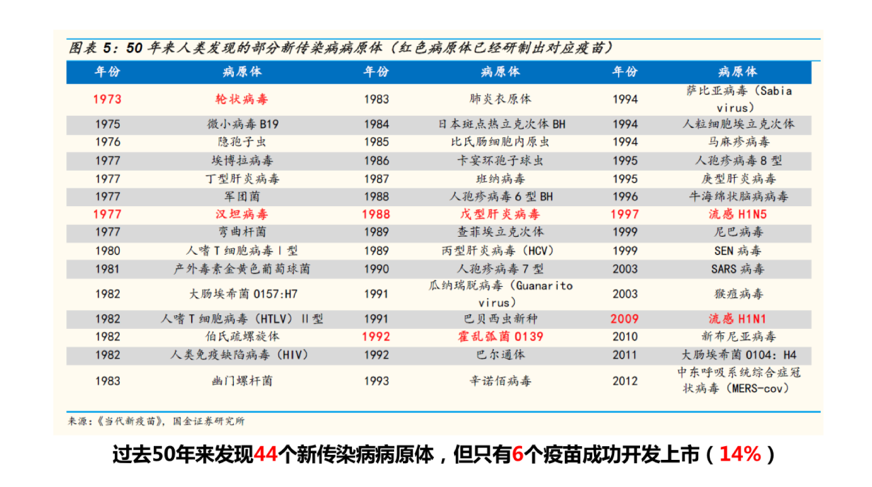
过去50年来我们已经发现了44个病原体,只有6个疫苗成功开发上市,其中主要的难题是不能找到一个安全、有效的病毒疫苗。前不久,《Vaccine》(疫苗)杂志主编发表评论问到:新冠肺炎疫苗能否让接种者产生足够且持久的抗体?如何避免由疫苗导致的疾病增强作用?希望大家不要忘记60年前呼吸道合胞病毒RSV疫苗曾留下的惨痛记忆。
1966年,在美国给小孩注射RSV灭活疫苗以后,发现一些小孩得肺炎的程度比没有接种疫苗的小孩还要严重,甚至会死亡。此后美国和欧洲政府投资了很多钱做新型呼吸道合胞病毒疫苗,但至今仍然没有一个安全有效的RSV疫苗上市。也就是说RSV疫苗进行了近60年还在路上,新冠肺炎疫苗是否能在数月之内上市,这的确是令人非常关心的事情。
灭活RSV疫苗免疫引起的“增强RSV疾病”称之为ERD。其发生的原因直到九十年代才搞清楚。发现注射戊二醛灭活的RSV疫苗在攻毒动物或感染人之后产生了Th2偏向的免疫学病理损伤,主要是产生一些Th2偏向的淋巴因子和炎症因子,肺部出现过量的噬酸性粒细胞浸润,中和抗体水平低,而非中和抗体水平高,不能有效地激活特异性的细胞毒性T细胞功能。
在2012年,我在美国德州UTMB的合作伙伴Tseng教授设计了三个疫苗,第一个疫苗是包含有S蛋白的疫苗,二是用化学灭活的SARS疫苗,三是用生物物理学方法灭活的SARS疫苗,然后免疫了小鼠,56天后用病毒进行攻击,两天后进行检查。结果发现注射S蛋白疫苗的小鼠在攻毒后,肺部出现嗜酸性细胞浸润,肺泡中也有很多细胞的渗出,当然还不是很严重,可以看到很多肺泡存在。但在注射化学灭活的SARS疫苗之后攻毒可以造成严重的嗜酸性粒细胞浸润,肺泡内已被渗出细胞完全填满,如在X光下或许可以看到“白肺”的现象。用生物物理学方法灭活的疫苗免疫所产生的病理损伤就介于两者之间,也有细胞渗出,但是不像化学灭活疫苗引起的这么严重。主要问题是显示了Th2型偏向的免疫学病理损伤。
一个日本团队为了弄清楚到底哪个蛋白造成了肺部的Th2型免疫学病理变化,他们用病毒表面的三个蛋白质,即S蛋白、M蛋白、E蛋白和核内的N蛋白做成疫苗,免疫小鼠后再进行攻毒。结果发现N蛋白疫苗造成非常严重的嗜酸细胞的浸润和渗出,其病理损伤明显高于E蛋白、M蛋白和S蛋白疫苗组。所以他们认为冠状病毒N蛋白是造成肺部Th2偏向的免疫学病理的主要因素。
最近报道在新冠肺炎病人的血浆中,Th2细胞因子有明显上调,比如说白细胞介素4、6、10和13,这样看新冠病毒感染也有可能造成Th2偏向的炎症因子增加。
在2004年加拿大P4实验室的Cao Jingxin主任使用能表达全长S蛋白的改良痘苗病毒载体做的疫苗来免疫雪貂,免疫后发现可以产生很高效的中和抗体。但是在用活病毒攻毒以后,雪貂肝脏的转氨酶增加,肝脏造成了损伤。所以他们认为用S蛋白作的病毒载体疫苗免疫雪貂在攻毒之后也可以造成严重的肝损伤。所以,我们做疫苗的动物试验时,不光是用小鼠或猴子感染模型,最好也用雪貂感染模型,因为它更加敏感。有时候我们看不到疫苗免疫造成的病理损伤,也可能是使用的动物模型不够代表性。
香港大学艾滋病研究所陈志伟所长的团队去年发了一篇文章,发现有些产生中和及非中和抗体特别快的SARS病人反而病情恶化更快。打了SARS病毒S蛋白疫苗的猴子用活的SARS病毒感染后,其肺部病理比没有打疫苗的还要严重。如果将这些免疫猴子的抗体注射到健康的猴子,再用活的SARS病毒感染以后,打了这些抗体的猴子比没有打抗体的猴子损伤更严重,所以他们怀疑可能是疫苗引起的一种抗体依赖性的感染增加效应,即ADE效应。单核巨噬细胞表面上没有病毒受体ACE2,一般情况下不能被SARS病毒直接感染。但是它表面有抗体受体FcR,当病毒和非中和抗体结合之后,它不会中和病毒,反而把病毒通过巨噬细胞表面FcR侵染单核巨噬细胞,所以让病毒能够感染这些本来不应该被感染的细胞,造成ADE。
清华大学刘刚教授的团队发现S蛋白的S597-603区诱导的抗体可以在体外导致非常明显的ADE效应,然后用灭活病毒疫苗加上这个多肽以后来免疫猴子,然后再进行活病毒攻击,结果发现会造成病变反应,这是另外一个角度反映SARS病毒的S蛋白疫苗具有ADE效应。
最近复旦大学金山公卫中心、深圳第三人民医院、武汉大学人民医院的科研人员发表了三篇文章,结果表明:年龄越大,血浆中和抗体及S蛋白结合抗体水平越高;抗体水平越高,粒细胞/淋巴细胞比例越高,患者病情越严重;血浆中的抗体水平越高,病人的病情越严重。这三篇文章发表以后,引起了世界卫生组织官员的高度重视,他们也怀疑这些病人的血液中可能含有ADE效应的抗体,这对疫苗的研发以及用康复期血清治疗都是一个严峻的挑战,应该引起高度重视。
当然,也可能我们是杞人忧天,也许新冠病毒和SARS-CoV或RSV完全不同。它可能具有超强的传染性,但超低的疫苗抵抗性,可能任何一个抗新冠病毒疫苗免疫所诱生的抗体都能有效的抑制新冠病毒的感染。如果真是这样的话,那将是不幸中万幸。
最近也是捷报频传,中科院武汉病毒所和国药集团武汉生物制品研究所宣布,全球首家新冠病毒灭活疫苗已经获得临床试验批准件,即将进入临床试验。几乎在同一天,北京科兴控股生物技术公司也宣布,北京首支新冠病毒灭活疫苗即将进入临床试验。而且实验证明该灭活疫苗免疫后在动物体内能够产生良好的免疫反应,对动物有明显的保护作用,也没有观察到ADE效应。
最近有一些文章发表,发现新冠病毒在S蛋白特别是受体结合域发生重大变化。例如,昨天刚刚发表的文章证明RBD的重要位点发生R408I突变,它和ACE2的亲合力明显降低。但目前不清楚这一突变是否会影响抗体的敏感性。所以,即使现在抗新冠病毒的疫苗能够成功上市,但如果将来新冠病毒发生严重突变,这些“有效”的疫苗可能会变得无效。对未来出现的新的高致病的冠状病毒,比如来自蝙蝠的冠状病毒,可能同样也没有效果。所以研发安全、高效、广谱的抗冠状病毒疫苗成为当务之急。
冠状病毒属于套式病毒目,冠状病毒科,分为四个属:甲型、乙型、丙型、丁型。在乙型里面又分为四个亚型,包括A亚型、B亚型、C亚型和D亚型。目前大家知道的甲型里有两个病毒,229E和NL63,在B亚型里有OC43和HKU1,这四个人类冠状病毒可以感染人,但引起的症状很轻,像感冒一样,所以并没有引起人们重视。直到2003年的SARS冠状病毒,2012年的MERS冠状病毒,和今年的新冠病毒出现以后,它们的高传染性、高致死率才引起了人们的高度重视。
我说的广谱是指:小广谱、中广谱、大广谱。小广谱是针对B亚型的β冠状病毒,包括SARS冠状病毒、新型冠状病毒以及来自蝙蝠的SARS相关病毒,这三个病毒可引起现在和未来的新型冠状病毒疫情,而且它们都使用ACE2作为受体。所以这种小广谱抗冠状病毒疫苗不是很难研发出来。第二种是中广谱,包括所有B型冠状病毒,包括SARS冠状病毒、新冠病毒和SARS相关病毒以及MERS冠状病毒,这个可能比较困难一点,因为MERS冠状病毒使用不同受体。第三种是大广谱,包括所有的人类冠状病毒,这是非常困难的。刚才说到不同型的冠状病毒可能使用不同的受体,因此,它们的受体结合域氨基酸序列可能是大不相同的。
刚才谈到新冠疫苗有很多类型,比如灭活疫苗、载体疫苗、核酸疫苗、亚单位疫苗,根据疫苗抗原主要分为三类:一是病毒颗粒,包括灭活和减毒疫苗;二是S蛋白疫苗,包括全长S蛋白;三是受体结合域(RBD)疫苗。全长S蛋白在酶解之后分为两个亚单位,S1亚单位含有NTD、RBD两个重要功能区域。综合看来,RBD是研发疫苗最佳的抗原选择。
我们准备采取以下的步骤研发高效、广谱的抗冠状病毒的疫苗。第一步,对RBD进行优化,增强它的中和免疫原性和广谱性。我们将使用“中和免疫原性指数(NII)”和“广谱中和免疫原性指数(BNII)”来评估RBD的中和免疫原性。采用“摘帽”和“带帽”的策略优化。因为RBD中有些和受体结合的关键部位可能被糖基化帽子掩盖了,我们就把它的糖基化帽子去掉。而有些部位诱导的非中和抗体过强,我们就用糖基化帽子遮盖住。通过测试我们发现,这样做中和抗体效价明显上升。这个方法我们还在优化,不单提高RBD的中和免疫原性,也提高它的广谱性。RBD中有些保守区域也可以诱导一些广谱中和抗体,但是由于被非中和抗体显性表位的免疫优势所压制,它的中和抗体免疫原性无法显现出来。如果将这些非中和抗体显性表位带帽遮住后,那些比较保守的中和抗体位点就占据了优势,就可能产生更多的广谱中和抗体。第二步是将优化后的RBD与含有T细胞抗原表位的蛋白片段连接形成疫苗抗原。虽然RBD也含有一些T细胞抗原表位,但更多的是在N蛋白或S蛋白的S2区,我们通过不同的方法把这些T细胞抗原表位找出来以后和将它们与RBD连接,形成一个既可以产生高效价中和抗体,也可以有T细胞免疫反应的抗原。最后我们将使用适当的免疫佐剂提高其免疫原性。
目前免疫佐剂在新冠疫苗中获得非常高的重视,因为它可以增强疫苗抗原的免疫原性,降低其使用量,从而使更多人得到疫苗接种。比如以前小鼠接种需要10微克,用佐剂以后可以降到1微克,可以大大减少抗原的使用。现在十几家公司宣布将他们拥有的佐剂贡献出来,供其它单位研发抗新冠病毒的疫苗。
下面谈一下如何研发安全、高效、广谱的抗冠状病毒药物。
冠状病毒和受体结合以后,通过表面膜融合或内吞膜融合进入细胞内,在冠状病毒酶的作用之下产生新的病毒颗粒,并释放出来。所以这里有两个酶可能成为重要的广谱抗冠状病毒药物的作用靶点。它们分别是Mpro(M蛋白酶)、RdRp(RNA 依赖RNA 聚合酶)。例如瑞德西韦和NHC都能作用在RdRp酶。最近饶子和院士团队先后在Science、Nature发表了这两个蛋白质的空间结构,为设计广谱抗冠状病毒药物提供了药物靶点的结构学基础。我们研究的多肽主要作用在病毒的融合和进入阶段,从而使得病毒没办法进入细胞。
在2004年我们发现第一个高效抗SARS冠状病毒的多肽。SARS起源于蝙蝠,中间宿主是果子狸,病毒传到人以后,感染人含有ACE2的呼吸道上皮细胞。我们当时很快的分析了S2区域的序列,找到HR1和HR2的片断,然后设计了4条HR1P多肽和2条HR2P多肽。我们发现HR2P多肽能够和HR1P多肽结合形成六聚体,具有很好的抗SARS病毒的作用。它的机制和HIV非常相似。SARS冠状病毒表面也有两个蛋白S1和S2,S1和受体结合以后,S2的融合多肽扎入靶细胞膜内,HR2区和HR1区相互作用形成六聚体,把病毒膜和细胞膜融合在一起。如果我们在HR2区设计多肽,它也可以和HR1结合形成六聚体,这样就阻止了病毒HR2和HR1相互作用,也就不能形成六聚体进入病毒细胞。
我们也发现了抗MERS冠状病毒多肽。2012年中东地区出现了MERS冠状病毒,已经传到全世界27个国家,近2500个确诊病例,病死率达到34%。这个病毒最初来源于蝙蝠,中间宿主是单峰骆驼。这个病毒是有限人传人,大部分还是从动物到人。
我们找到HR1和HR2区域之后,表达了HR1和HR2蛋白,做了X光衍射,发现它们也可以形成六聚体。这个六聚体和SARS六聚体很相似,一个很长的HR1区,很短的HR2区。我们设计了两个多肽,HR1P多肽和HR2P多肽,这两个多肽相互作用形成一个六聚体,和SARS一样。我们发现MERS冠状病毒的HR2P多肽能够非常有效地抑制MERS冠状病毒与靶细胞融合,也可以抑制MERS活病毒感染,而且它的抑制活性比抗SARS多肽抑制SARS-CoV感染的活性高几十倍,表明了MERS冠状病毒可能主要通过表面膜融合。
除此之外,我们又发现一个广谱抗冠状病毒多肽 - EK1。
世界卫生组织从2015年12月开始发布可导致大规模爆发的严重疾病的清单,用于确定公共卫生紧急情况下应优先研究和解决的疾病和病原体。这个名单在2017年首次审视,2018年2月第二次审视并于同月底发布《预测流行病行动的研发蓝图》,包括“有大爆发危机、难以防范的八大疾病”,即埃博拉、寨卡、SARS、MERS、拉萨热、克里米亚刚果出血热、裂谷热,以及第一次出现的“X疾病”,即由一个不明病原体所引发的全球性传染病的大流行。
这个通告发出以后,我们马上预测第一个“X疾病”很可能是由源于蝙蝠的冠状病毒所引起。石正丽老师的团队和其他几个团队发现很多来源于蝙蝠的SARS冠状病毒,可以使用人的ACE2作为受体感染人的细胞。另外来源于蝙蝠的HKU2相关病毒也可以导致猪瘟流行。他们在云南、山东找到几个源于蝙蝠的SARS冠状病毒的直接后代毒株。因此我们当时决定要尽快研发广谱的基于多肽的冠状病毒融合/进入抑制剂。
我们把五个现有的冠状病毒设计了5条HR1多肽和5条HR2多肽,检测这10条多肽对5个不同病毒的细胞融合作用。结果发现,衍生于不同冠状病毒HR2P多肽都能有效地抑制同源冠状病毒的感染,而衍生于OC43的HR2P多肽可以抑制所有的5种冠状病毒的感染。表明了OC43的HR2P多肽可能是一个广谱多肽。我们把OC43多肽进行了修饰,引入了带有正电荷和负电荷的氨基酸,形成一个内部盐桥,使其更稳定更有效,这就是EK1多肽。我们发现EK1比OC43多肽具有更高的抑制活性,而且对我们检测的几种冠状病毒,包括人的冠状病毒和3种来自蝙蝠的冠状病毒都有效,对细胞融合、假病毒和活病毒感染都有很好的抑制效果。
我们做了动物实验,发现EK1多肽能有效地治疗和预防OC43和MERS冠状病毒对小鼠的感染。
我们对这几个病毒的序列进行分析,发现他们关键的作用位点非常保守,我们称为a、d和e、g位点,这就是为什么我们设计一个多肽,能够和所有的人冠状病毒的S蛋白HR1区结合形成六聚体,发挥广谱抗冠状病毒的作用。
新冠病毒出现以后,我们立即检测了EK1多肽的抗病毒作用。大家知道从1月首先在武汉地区报道的新冠病毒感染,至今不到4个多月,全世界超过200万人感染,造成13万人的死亡。这个传播速度是以前没有过的。
我们很快把新冠病毒S蛋白序列分析出来了,找到它的HR1和HR2区,设计了衍生于新冠病毒HR2区的多肽,实际上,这个多肽和SARS冠状病毒S蛋白的HR2区的氨基酸序列是完全一样的。
我们发现无论是新冠病毒的HR2多肽(HR2P),还是EK1都能够和新冠病毒HR1P多肽形成六聚体。我们建立了细胞融合实验,发现EK1能够有效地抑制S蛋白介导的细胞融合,也能抑制假病毒的感染。
同样我们也解析了它的六聚体结构,发现新冠病毒和其它冠状病毒的结构非常相似,也是由长的HR1和短的HR2形成一个核心的融膜结构。
我们对EK1多肽进行了优化,在其C端用不同长度的PEG连接胆固醇,后来发现其中一个叫做EK1C4的活性比EK1和新冠病毒HR2P多肽细胞融合抑制活性高出240倍,它抑制假病毒活性是EK1和HR2P的150倍,可以说是最有潜力的广谱抗冠状病毒药物的候选,它的半数有效抑制浓度(IC50)可以到1.3nmol,这是非常有效的。
我们发现EK1C4能够抑制6种人的冠状病毒的膜融合,3种蝙蝠的冠状病毒的膜融合,而且活性比EK1多肽高出100到200倍。它还能抑制人的冠状病毒(假病毒)和2种蝙蝠SARS相关病毒(假病毒)感染活性。除此之外,我们还研究了其对5种活的人冠状病毒的作用,包括MERS冠状病毒、新冠病毒、OC43、229E以及NL63,发现它同样有非常好的抑制作用。
这些工作证明,EK1C4脂多肽是高效广谱的抗冠状病毒多肽,将来有望能以鼻腔喷雾或者吸入剂的形式预防和治疗新冠病毒、SARS-CoV、MERS-CoV感染,也可以预防和治疗将来新发与再现的SARS相关病毒(SARSr-CoV)的感染,这是非常广谱的。
下面总结第二部分内容,广谱抗冠多肽是防控现在和未来新冠疫情的最佳武器之一。刺突蛋白HR1区是研发广谱抗冠多肽药物的最佳靶点之一。因为它是S蛋白中最为保守的区域,特别适合于研发多肽药物。这个区域只能让40kD以下的多肽或小分子蛋白进去,而抗体的分子量在150kD进不去,因此并不适合开发抗体。但小分子又太小,没有力量阻止病毒HR1和HR2区的相互作用,所以最适合研发多肽。
这个多肽容易规模化生产,生产成本远低于抗体。我们现在国内有很多大的多肽公司,把序列交给公司以后,大概一个月或两个月可以生产一公斤的cGMP多肽用于临床使用。其成本是远远低于生产抗体的成本。多肽粉可以在常温下储存和运输,而抗体必须要低温储存和运输。多肽可用于预防和治疗冠状病毒感染,可以用鼻腔喷雾和雾化吸入,这个使用方法既方便又安全。比如我们要参加一个聚会,吃饭的时候不能戴口罩,可以带上这个小喷雾瓶,提前自己喷上,避免被别人感染。如果你得了新冠肺炎感染以后,可以买一个小的雾化吸入器放在家里面,多肽进入肺泡以后抑制病毒复制和感染,病毒载量大大降低,造成的肺损伤概率也明显降低。同时因为降低肺部病毒载量,也减少了感染家人或其他人的机会,可以说一举两得。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




