- +1
赛迪顾问︱收益过低,企业抗病毒药物研发动力不足
抗新型冠状病毒药品是指能抑制新型冠状病毒繁殖或杀灭冠状病毒药品的统称,这类药品可以直接抑制或杀灭病毒、干扰病毒吸附、阻止病毒穿入细胞、抑制病毒生物合成、抑制病毒释放或增强宿主抗病毒能力等。
截至3月24日,针对本次新型冠状病毒引发的肺炎疫情,中国临床试验注册中心已登记了449项新型冠状病毒研究,其中,获批准的药物临床试验共120项。试验涉及洛匹那韦、利托那韦、双黄连口服液、血必净注射液、连花清瘟胶囊/颗粒等药物。
一、国内产业链总体布局情况
抗新型冠状病毒药品产业链包括上游的抗新型冠状病毒药品原料药与制药设备、中游的药品研发与生产、下游的药品流通与销售等环节相关产业在内的统称。其中最核心的是中游的药品研发与生产,主要分为化学药、生物药和中药三大细分领域。
图1 中国抗新型冠状病毒药物产业链
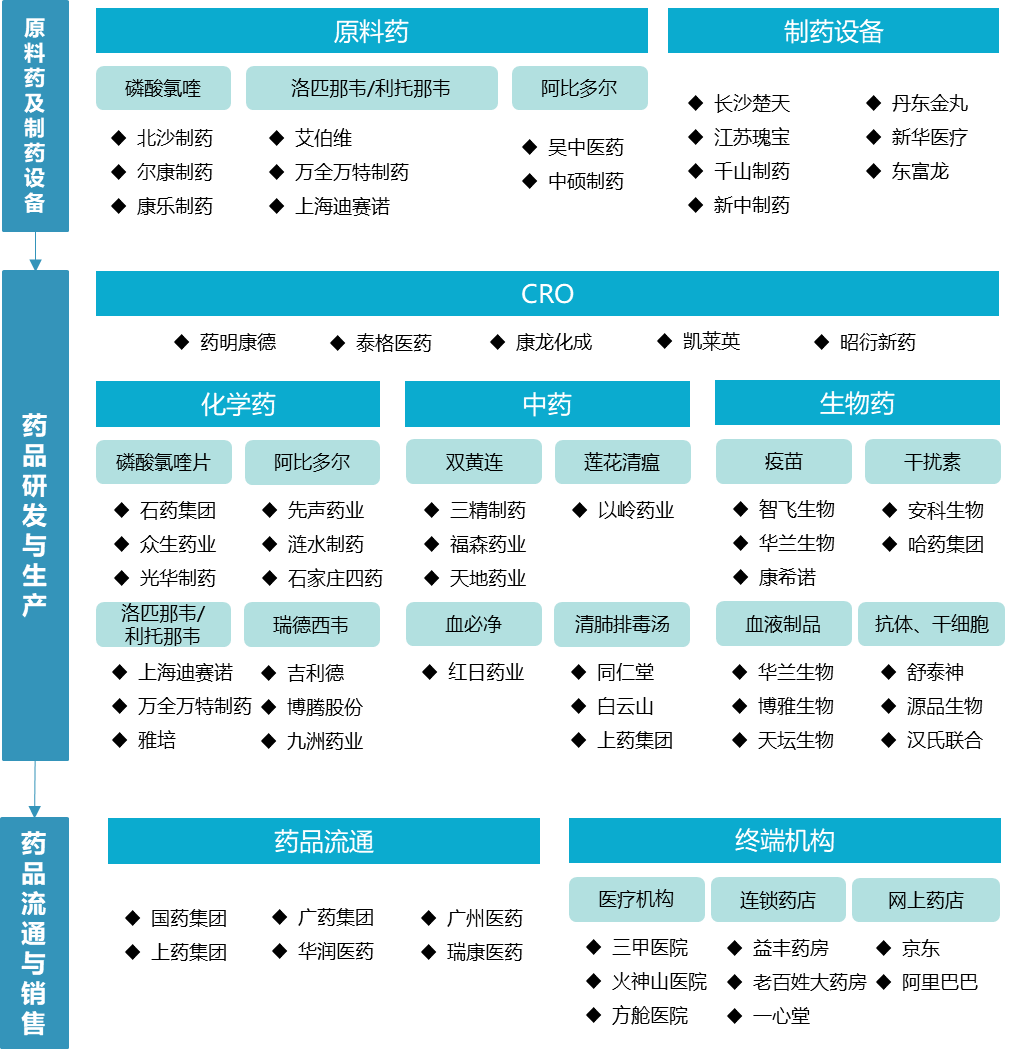
二、重要环节进展情况
1、大宗原料药较有优势,抗新型冠状病毒原料药部分依赖进口
我国是全球最大的抗病毒药品原料药生产和出口国,尤其在大宗原料药领域占有绝对优势,重点产品包括抗生素、微生物、解热镇痛类等原料药。从产业布局看,亚洲、欧洲和北美洲为我国三大出口市场,印度、美国和日本为我国原料药前三大出口国家。在抗新型冠状病毒原料药方面,磷酸氯喹、利托那韦、阿比多尔等为主要原料药。其中,洛匹那韦和瑞德西韦国内暂无生产厂家。
图2 我国原料药(含医药中间体)出口量(万吨)
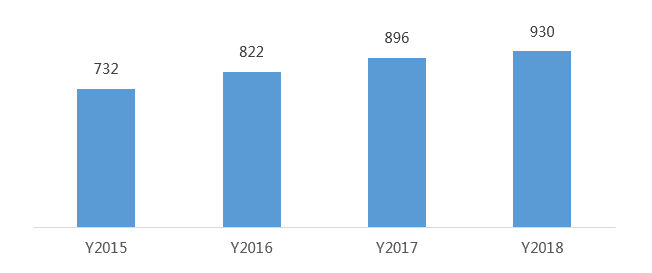
图3 我国抗新型冠状病毒原料药生产企业

2、CRO产业规模高速增长,企业积极进行抗新型冠状病毒产品研发
2019年我国CRO(合同研究组织)产业规模536亿元,同比增长31.1%。我国CRO起步较晚,已涌现出一批优秀的CRO企业
图4 中国CRO产业规模及增长率
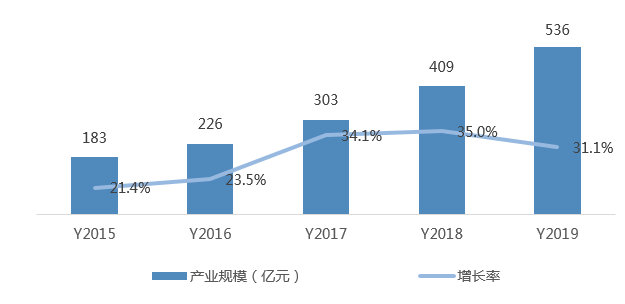
表1 部分CRO企业开展的抗新型冠状病毒相关研究

3、化学药产业规模稳定增长,抗新型冠状病毒药物以化学药为主
抗病毒药物以化药为主,“老药新用”是治疗新冠病毒的重要近期策略。目前,超过50种已有MERS或SARS抑制剂可以被用于筛选治疗新冠病毒的候选药物。目前较常用的药物主要以洛匹那韦/利托那韦、奥司他韦、瑞德西韦、法匹拉韦等国外药企主导的化学药为主。其中,瑞德西韦(Remdesivir)是美国吉利德公司针对埃博拉病毒开发,目前正在开展三期临床,可作为“同情用药” 在临床使用。法匹拉韦(Favipiravir)是日本富山化学公司开发的广谱抗RNA病毒药物,在临床试验中显示了较明显的疗效,海正药业购买了该产品国内授权,并将该产品以“流感适应症”率先获批上市,该药物亦可作为新冠肺炎的临床试验用药。
图5 中国化学药产业规模及增长率
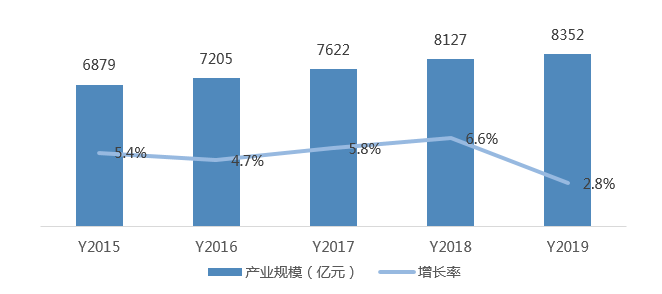
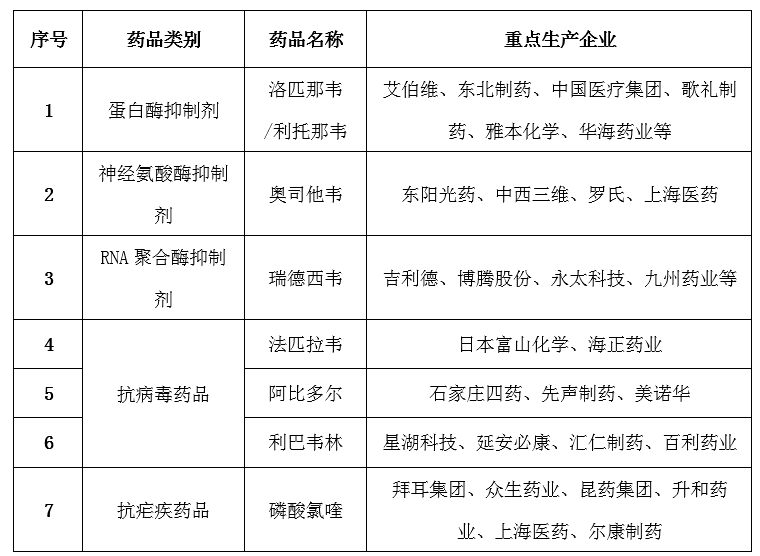
表2 抗新型冠状病毒化学药生产企业
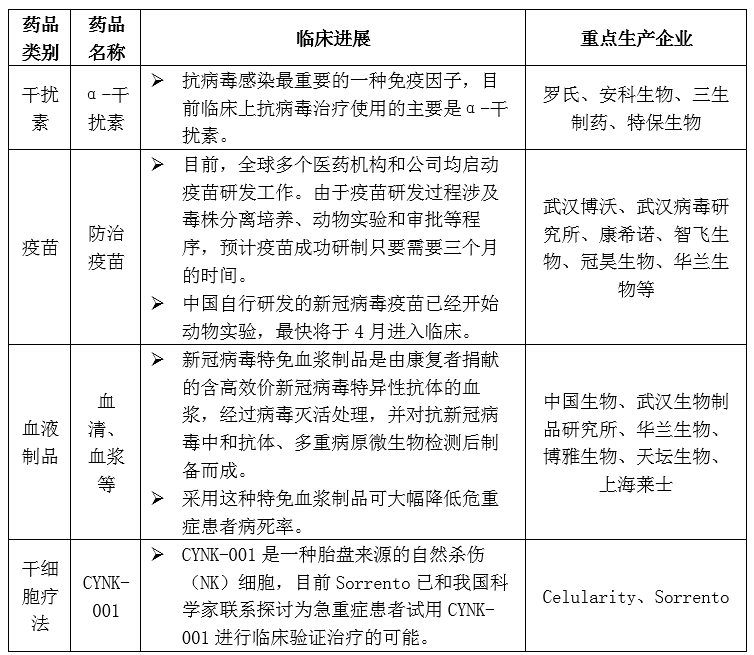
4、生物药产业规模高速增长,生物药为抗新型冠状病毒新疗法
在抗新型冠状病毒原料药方面,干扰素临床应用最多,疫苗和干细胞产品正在研发中。干扰素是抗病毒感染最重要的一种免疫因子,目前临床上抗病毒治疗使用的主要是α-干扰素。
图7 中国生物药产业规模及增长率
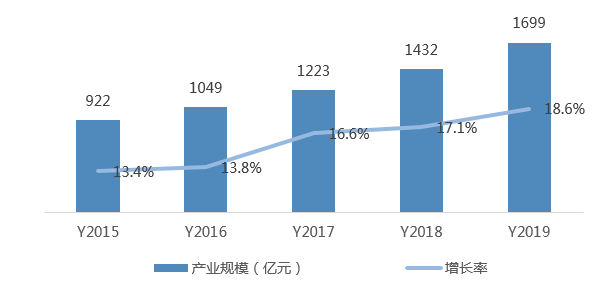
表4 抗新型冠状病毒生物药生产企业
三、产业链关键短板分析
1、企业创新动力不足
近些年,我国创新药临床申请主要集中在抗肿瘤领域,抗病毒药创新普遍不足,具体到烈性传染病抗病毒药的研发创新更少。2009-2019年,我国药监局批准的抗病毒新药大约20多个,大部分是针对艾滋病、乙肝和丙肝病毒的慢病领域,主要原因是烈性传染病抗病毒药物研发投入高且存在高风险,一款新药的研发试验乃至审批上市,要经历十几年的漫长投入和时间。烈性传染病新型病毒具有高传染性、高暴发性、短周期等特点,等到研发一款有效药出来,很可能病毒疫情已经结束,即使等到下一次的疫情暴发,又有可能出现不同的病毒。
另外,一旦发生病毒暴发,如走政府采购,一般研发回报相对较低。因此高研发费用和不可控的市场前景,一般创新药企很难长期坚持做烈性传染病抗病毒药。这也是为何2003年“非典”的几个抗病毒研发项目在疫情结束后,由于缺乏病人和研发经费支持,药物研发停止。
2、政府亟待完善可持续的支持模式
与美国相比,在烈性抗病毒药研发创新方面,我国缺乏有效、可持续性的政府支持与鼓励制度,仅有重大新药创制等一次性的财政专项,未建立可持续性的多方合作研发机制。例如,美国国际开发署(USAID)通过与高校研究单位建立合作伙伴关系,资助企业开展围绕公共卫生领域里的新技术和新药的研发。目前,USAID已经储备有150个创新项目,也包括开发抗埃博拉病毒的抗病毒药物。2018年,美国食品药品监督管理局(FDA)批准了首款天花特效药物TPOXX,该药物后期研发由美国政府生物医学高级研究与发展局资助,并在获批上市后购买200万份作为国家战略储备。
3、基础研究配套不足
与美国相比,我国高级别生物安全实验室数量少。新发病原体的暴发在世界范围内越来越频繁, 从2003年的SARS-CoV、2009年的H1N1甲型流感病毒、2012年的MERS-CoV、2015年的埃博拉病毒、2016年的寨卡病毒、2017年的H5N7禽流感病毒到这次的新型冠状病毒, 除寨卡病毒外所有的病毒都是三级生物安全实验室(BSL-3)级别的病原体, 所有的相关研究都需要在BSL-3实验室及以上进行。
而截至目前,我国共有BSL-3实验室43家(包括兽医农业领域7家), 四级生物安全实验室(BSL-4)实验室1家。美国具备BSL-3资质的实验室已达1000多家,可运营或计划中的BSL-4实验室13家。在美国,所有高水平大学医学院和医院基本都配备BSL-3实验室, 其规模不一定很大, 但可以满足相关学校和医院的研究和检测需求,方便快速从临床上分离危险病原体以及展开后续基础研究。
四、发展建议
1、探索多元化的抗病毒药物研发模式
一是鼓励龙头企业牵头建立的抗病毒研发联盟。龙头企业联合高校、公共机构、CRO和基金会等,通过会费的形式建立共同研发基金,开展药物研发。二是探索政府-民营共同研发投入的 PPP模式。在PPP项目中,政府公共部门主要负责研发方案设计、组织病源、初期研发资金注入,研发项目成功后,民营企业低价为政府提供具有专利权的药品,同时可以获得临床试验数据、产品推广效应和政府相关试点项目。三是建立新药预储备模式。新冠病毒是新型病毒,对其临床和流行性病学的深入了解和掌握都可以对今后的药物研究打下基础。国内企业可充分利用“机会窗口”做好产品储备、临床储备和研究储备。四是建立国内外企业间合作模式。通过本土药企和国外药企联合攻关,寻找几个靶点合作开发多种新药。
2、创新政府支持药物研发的方式
一是将加强烈性传染病抗病毒药研发列入国家战略规划层面。2021年我国第十四个五年计划和药品专项计划将出台,建议将加强应对突发公共卫生病毒药物研发的建议纳入计划中。
二是将烈性传染病抗病毒药纳入各类国家专项扶持项目重点方向。在国家重大新药创制专项、传染病研发重大专项等专项中增加烈性传染病抗病毒药扶持方向,适当增加资金支持力度。
三是探索政府-民营共同研发投入的 PPP模式。PPP项目政府公共部门主要负责研发方案设计、组织病源、初期研发资金注入,研发项目成功后,民营企业低价为政府提供具有专利权的药品,同时可以获得用于产品更新的临床试验数据、产品推广效应和政府相关试点项目。
3、加强基础研发配套设施建设
我国烈性传染病抗病毒药物基础研发配套短板主要体现在高水平生物安全实验室数量较少,下一步,需加强高水平生物安全实验室建设,建议整体布局、加大投入,分批次建立各类高水平生物安全实验室。首先,建立重大传染病国家实验室, 并由国家实验室管理和实施“传染病重大专项科技计划”,在各省市建立国家实验室分部,全面开展传染病流行病学、预防、药物和疫苗研发。其次,在高水平医学院、研究机构布局建立若干BSL-3级实验室, 建立有效的管理制度,保证在疫情暴发时实验室可以有效为临床提供服务。
(作者孙会峰系赛迪顾问总裁)





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




