- +1
新冠病毒并非实验室产物!自然子刊发文:有两种自然选择假说
新冠肺炎疫情发生以来,“实验室病毒泄漏”、“人工合成新病毒”等流言一度在网络上传播。北京时间3月18日,顶级学术期刊《自然-医学》(Nature Medicine)在线发表了来自美国、英国、澳大利亚共6位科学家的一篇文章“The proximal origin of SARS-CoV-2 ”,对新冠病毒的起源进行了详细分析。
通过对基因组数据的比较分析,作者们对新冠病毒的起源进行了综述。他们提出一个关于SARS-CoV-2基因组显著特征的观点,并讨论了这些特点可能导致的情况。他们的分析清楚地表明:新冠病毒并非源自实验室,也不是一种故意制造的病毒,而是一种自然进化的产物。

这6位科学家分别为著名病毒进化学家美国斯克里普研究院免疫学和微生物学系Kristian G. Andersen副教授(一作及通讯作者)、英国爱丁堡大学进化生物学研究所Andrew Rambaut、美国哥伦比亚大学梅尔曼公共卫生学院感染与免疫中心主任W. Ian Lipkin、澳大利亚悉尼大学玛丽·巴希尔传染病和生物安全研究所教授Edward C. Holmes、美国杜兰大学医学院微生物与免疫学教授Robert F. Garry。
值得注意的是,作者当中来自哥伦比亚大学的Lipkin在国际流行病学领域声名显赫,被世界知名科普杂志《Discover》誉为“世界上最知名的病毒猎手”。 过去几十年来,Lipkin一直置身于世界疫情爆发的最前线,包括纽约西尼罗病毒(1999年)、中国SARS(2003年)、MERS(2012-2016 年)、美国寨卡(2016年)和印度脑炎(2017年)。2003年,Lipkin是首批应邀协助中国抗击SARS的国际知名专家。此后,他还协助建立了上海巴斯德研究所、广州生物医药研究所等研究机构。
新冠病毒基因组两个显著特征
论文提到,自中国湖北武汉首次报告新型肺炎(COVID-19)以来,关于其致病病毒新冠病毒的起源一直讨论颇多。新冠病毒是已知的第七种感染人类的冠状病毒。SARS-CoV、MERS-CoV和SARS-CoV-2可导致严重的疾病,而HKU1、NL63、OC43和229E引发的症状较轻。
通过比较α冠状病毒和β冠状病毒,作者们确定了新冠病毒具有2个显著的特征。
第一,在结构研究和生化实验的基础上,新冠病毒似乎更适合与人类受体ACE2结合。第二,新冠病毒的S蛋白通过插入12个核苷酸,在S1-S2边界处有一个多功能的多碱基酶切位点(弗林),同时导致了该位点周围出现3个O-linked 的聚糖结构。
S 蛋白全称为spike glycoprotein (刺突糖蛋白),是冠状病毒的一种表面蛋白。ACE2全称为血管紧张素转化酶2,是人体细胞与冠状病毒结合的关键部分。一种简单的比喻就是,在冠状病毒感染人体的过程中,S蛋白就像一把“钥匙”,而人体细胞上的ACE2受体则像一把“锁”。
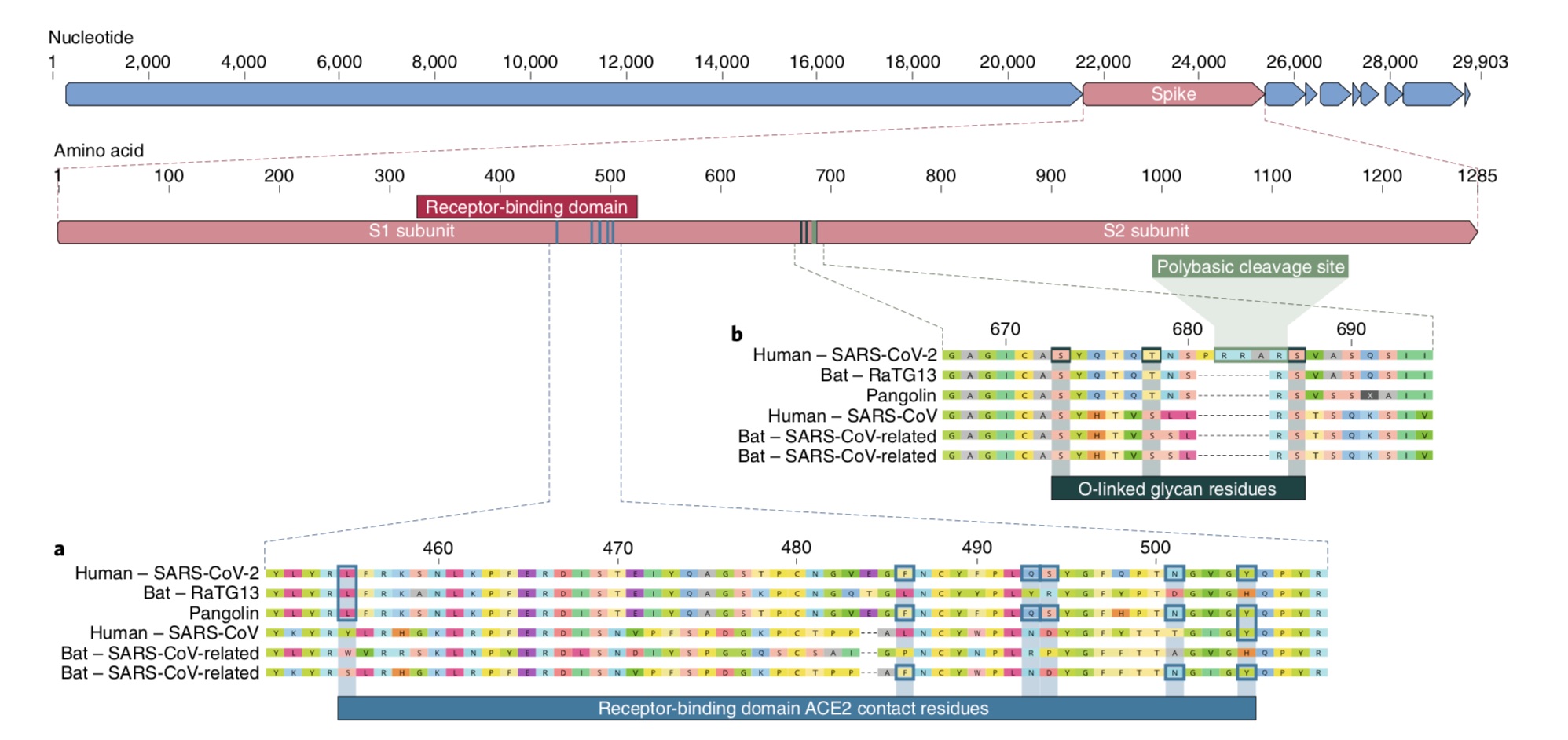
具体分析来看,首先是新冠病毒受体结合区域的突变。S蛋白的受体结合域(RBD)是冠状病毒基因组中最易变的部分。6种RBD氨基酸已被证明是与ACE2受体结合的关键,同时也是确定SARS-CoV样病毒宿主范围的关键。
使用SARS-CoV的基因组为参考,这6种相应氨基酸为Y442、L472、N479、D480、T487、Y4911,对应于新冠病毒中的L455、F486、Q493、S494、N501、Y505。这6种氨基酸中有五种在新冠病毒和SARS-CoV之间存在差异(图1a)。
基于结构模型模拟和早期生化实验发现,新冠病毒的RBD与人类、雪貂、猫等的ACE2受体具有高亲和性。
虽然上述分析表明,SARS-CoV-2可能与人类ACE2具有较高的亲和力,但计算分析预测,这种相互作用并不完美。此前的研究对ACE2受体蛋白进行结构生物学分析,并预测了与其匹配程度最高的配体氨基酸序列,这与在新冠病毒RBD中发现的并不同。
因此,作者们提到,新冠病毒S蛋白与人类ACE2的高亲和力结合,很可能是对人类ACE2的自然选择的结果,从而产生了另一个最佳结合方案。他们认为,这有力地证明了新冠病毒并不是故意制造的产物。
新冠病毒的第二个显著特征是,S蛋白S1和S2亚基交界处有一个多碱基酶切位点(RRAR)(图1b)。这使得弗林和其他蛋白酶的有效裂解成为可能,并在确定病毒感染性和宿主范围方面发挥作用。
此外,在新冠病毒中,该位点除了有2个精氨酸和1个丙氨酸,还有一个脯氨酸也插入其中,因此,插入的序列是PRRA(图1b)。由脯氨酸插入所产生的转变预计会导致在多碱基酶切位点侧面的S673、T678和S686上增加O-linked聚糖结构(图1b)。
值得注意的是,这是新冠病毒的一个独特特征。文章中提到,虽然在包括HKU1(A系)的β冠状病毒中存在这些酶切位点和O-linked聚糖结构,但在相关的B系β冠状病毒属中并未发现过类似特征。
作者们还认为,考虑到S蛋白的遗传变异水平,很可能会在其他物种中发现具有部分或全部多碱基酶切位点的新冠病毒样病毒。
不过,对于新冠病毒这两个显著特征的功能目前均尚不清楚。
作者们提到,通过动物模型确定新冠病毒多碱性酶切位点对病毒传播和发病机制的影响具有重要意义。但通过对SARS-CoV的实验发现,在S1/S2交界处设计多碱基酶切位点可以增强细胞间融合,但不影响病毒的进入。此外,MERS-CoV S蛋白的高效裂解也使得来自蝙蝠的MERS样冠状病毒可以感染人类细胞。
另外,禽流感病毒的血凝素蛋白(HA)的两个亚基的交界处也能产生多碱基酶切位点,条件是病毒处于高速复制和传播中(例如在高密度鸡群),多碱基酶切位点能被弗林蛋白酶和其他蛋白酶快速识别并切割。而HA与冠状病毒S蛋白在细胞-细胞融合和病毒进入过程中起着类似的作用。通过插入或重组获得HA中的多碱性酶切位点,可将低致病性禽流感病毒转化为高致病性病毒。流感病毒HA在细胞培养或通过动物反复传代后,也可观察到多碱基酶切位点的产生。
至于3个O-linked聚糖结构的潜在功能,目前也不清楚,但它们可以产生一个“粘蛋白样结构域”,以保护新冠病毒S蛋白上的某些潜在表位或关键氨基酸。目前已知的是,一些病毒会利用粘蛋白样结构域作为免疫逃避的糖链屏障。
作者们提到,需要进行生化分析或结构研究来确定O-linked聚糖结构位点是否在新冠病毒中被利用。
新冠病毒的起源:两种可能解释
作者们在论文中鲜明指出:新冠病毒不太可能是通过对现有SARS相关冠状病毒的实验室操作而出现。
如上所述,其RBD还不是最完美的结合构象,其有效的解决方案与之前预测的不同。此外,如果已经进行了基因操作,我们应该看到对β冠状病毒使用了反向遗传学系统,但情况并非如此,因为遗传数据显示,新冠病毒并非源自任何以前使用过的病毒骨架。
在这篇文章中,研究团队提出了两种可能解释新冠病毒起源的方案:第一,人畜共患病转移前非人类动物宿主中的自然选择;第二,人畜共患病转移在人类中的自然选择。
第一,在动物宿主中进行自然选择。鉴于新冠肺炎暴发早期的很多病例有武汉华南海鲜市场接触史,那么该市场可能存在动物来源。又考虑新冠病毒与蝙蝠SARS样冠状病毒(尤其是RaTG13)序列相似度极高,那么蝙蝠来源这一点也是可靠的。
但是,尽管来自中华菊头蝠的冠状病毒RaTG13和新冠病毒在全基因组层面上有大约96%的相似性,但两者的RBD有很大差异,这表明它可能无法有效地与人类ACE2结合(图1a)。
初步分析表明,非法进口到广东省的马来穿山甲中含有一种与新冠病毒相似的冠状病毒。虽然RaTG13在全基因组上最接近于新冠病毒,但马来穿山甲和新冠病毒在RBD上表现出高度相似,包括6个关键氨基酸一致 (图1)。
作者们指出,这清楚地表明,新冠病毒S蛋白优化ACE2受体结合是自然选择的结果。
鉴于目前采集到的蝙蝠和穿山甲冠状病毒都不含多碱基酶切位点,作者们提到,虽然目前还没有发现与新冠病毒的直接起源极其相似的动物冠状病毒,但蝙蝠和其他物种冠状病毒的多样性被大大低估了。
在冠状病毒S1-S2接点附近可以发生突变、插入和缺失,说明多碱基酶切位点是自然进化过程中形成的。这种突变需要病毒在较高种群密度、并且ACE2基因类似于人类同源蛋白的生物集群中大量复制才有可能产生。
第二,在人体内隐秘适应。作者们提出,新冠病毒的祖先也有可能从非人类动物跃迁到人类身上,上述的基因组特征是通过在随后的人与人之间的传播中进行适应而获得的。
他们推测,一旦病毒获得了这些适应,就将带来疫情的暴发,进而产生足够大且异常的肺炎病例群,医疗监控系统被触发,并发现了病毒。
到目前为止,所有进行测序过的新冠病毒基因组都具有很好的适应性RBD和多碱基酶切位点,因此它们是从一个共同祖先那里获得的这些特征。穿山甲中存在一种与新冠病毒非常相似的RBD,这意味着这些特征可能在传播到人类中以前已经存在于病毒中。这使得多碱基酶切位点插入发生在病毒人际传播过程中。
使用现有的基因组序列数据估算新冠病毒的最新共同祖先的时间,表明病毒在2019年11月下旬至12月上旬出现,这与最早的回顾性确诊病例研究的时间相符。
因此,这种情况下,作者们认为可以假定,在最初的病毒由动物转移到人身上与人际传播时多碱基酶切位点的获取之间,存在一段无法识别的病毒人际传播时期。如果在很长一段时间内,首先发生的很多人畜共患病事件(病毒由动物转移到人身上)能够产生人与人之间传播的短链,那病毒就会有足够的机会大暴发。
文章提到,这其实就像阿拉伯半岛上MERS-CoV传播的情况,所有人类病例都是病毒从单峰骆驼反复传播的结果,产生了单一感染或人与人之间的短链传播。迄今为止, MERS-CoV还尚未完全适应人类宿主。
新冠病毒是否发生了这种隐秘的传播?作者们认为,回顾性血清学研究可以提供有用信息。在中国的某些地区,已经进行了少数这类研究,显示了居民对SARS样冠状病毒有低水平暴露。
然而,关键的是,这些研究尚无法区分阳性血清反应是由于先前感染了SARS-CoV、新冠病毒或其他冠状病毒所致。作者们认为,应该进行进一步的回顾性血清学研究,以确定之前人类在不同地理区域接触过新冠病毒的程度。
实验室有意或无意泄露了新冠病毒的可能?
作者们还讨论了实验室里培养新冠病毒的可能性。
他们提到,多年来,世界各地的多个BSL-2(生物安全第二等级)实验室一直在进行涉及蝙蝠SARS样冠状病毒在细胞培养和/或动物模型中传代的基础研究。也有一些记录表明,曾发生或一些SARS-CoV实验室逃逸事件。因此,我们必须考虑实验室有意或无意泄露了新冠病毒的可能。
作者们认为,从理论上说,新冠病毒的RBD突变位点有可能是通过细胞培养传代过程中的适应取得的,这种情况已经在SARS-CoV的研究中被观察到。
然而,在穿山甲中发现了具有几乎相同RBDs的SARS-CoV样冠状病毒,这为解释新冠病毒是如何通过重组或突变获得这些RBDs提供了一个更有力、更简洁的解释。
同时,多碱基酶切位点或O-linked聚糖的存在也反对了基于实验室培养的假设。因为只有在细胞培养物或动物中长时间传播低致病性禽流感病毒的情况下,才能产生多碱基酶切位点。此外,如果真的通过细胞培养或动物传代产生新冠病毒,则需要事先分离具有非常高遗传相似性的祖病毒,在具有人类同源ACE2受体的动物中大量传代,但这些工作此前从未有报道。同时获得O-linked聚糖结构的可能性也不大,因为这种突变通常表明免疫系统的参与,这在体外是不存在的。
作者们在文章中写道,在全球新冠疾病的公共卫生紧急情况中,我们有理由去想为什么流行病的起因十分重要。对动物病毒如何跨越物种、如此迅速地感染了人类的详细了解将有助于预防未来的人畜共患病事件。
例如,如果新冠病毒已预先适应了另一种动物,那么即使目前的流行病得到控制,我们也仍有未来再发生此类事件的风险。相反地,如果我们描述的适应过程是发生在人类中,那么即使重复此前的人畜转移,病毒也不太可能暴发,除非发生了相同系列的突变。
此外,确定与新冠病毒最接近的动物亲缘将大大有助于病毒功能的研究。RaTG13 bat序列的可用性也的确促进了本研究进行的比较基因组分析,有助于揭示RBD中的关键突变以及多碱基酶切位点的插入。
他们认为,本文描述的基因组特征可以部分解释新冠病毒在人类中的传染性和传播性。目前的基因组证据不支持新冠病毒是实验室产物的观点,但目前尚无法证明或反驳本文所述的其他起源。
然而,由于作者们在相关的自然界冠状病毒中观察到新冠病毒的所有显著的特征,包括优化的RBD和多碱基酶切位点,他们认为任何基于实验室制造的假设都是不可信的。
文章提到,更多的科学数据可能会改变证据的平衡,使一种假说比另一种假说更可信。从动物来源获得相关的病毒序列将是揭示病毒来源的最确定的方法。例如,对来自动物的新冠病毒样样病毒的中间或完全形成的多碱基酶切位点的进一步观察将为自然选择假说提供进一步支持。这也将有助于获得更多关于新冠病毒的遗传和功能数据,包括动物研究。
识别新冠病毒的潜在中间宿主,以及对非常早期的患者的病毒进行测序,同样具有很高的信息价值。
作者们最后表示,无论新冠病毒通过什么样的确切机制自然选择,对人类肺炎疫情和其他动物进行持续监测显然是最重要的。
论文链接:https://www.nature.com/articles/s41591-020-0820-9





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




