- +1
漫长的等待:HPV疫苗在中国迟到的十年(上)
3月8日是“联合国妇女权益和国际和平日“,这一天是为纪念女性在社会各领域做出的重要贡献而设立的节日,也在这一天,越来越多的人呼吁正视女性在经济、政治和健康等领域中被忽视的权益。宫颈癌是全球女性中第四大常见癌症,因为HPV疫苗的研发,它成为唯一一个可以被疫苗预防的癌症。但它在中国的出现,整整晚了十年。
2019年12月31日,首个国产双价人乳头瘤病毒疫苗(以下简称为HPV疫苗)馨可宁的上市让HPV疫苗再次成为热点话题。
自2016年,HPV疫苗通过中国的上市申请后,公众对于其的关注从未减少。这与一直以来中国宫颈癌的高发病率有关。据财新新闻的报道,中国每年约有13万名妇女被诊断患有宫颈癌,占亚洲新发病例的一半。其中,每年约有2至3万中国妇女死于该疾病。2018年,发表在权威医学期刊《柳叶刀》(Lancet)上的论文
“2018年子宫颈癌的发病率和死亡率估计:全球分析”(Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis)指出,中国是2018年全球宫颈癌发病数最高的国家(106 000)。
但对抗宫颈癌不只是中国的斗争。
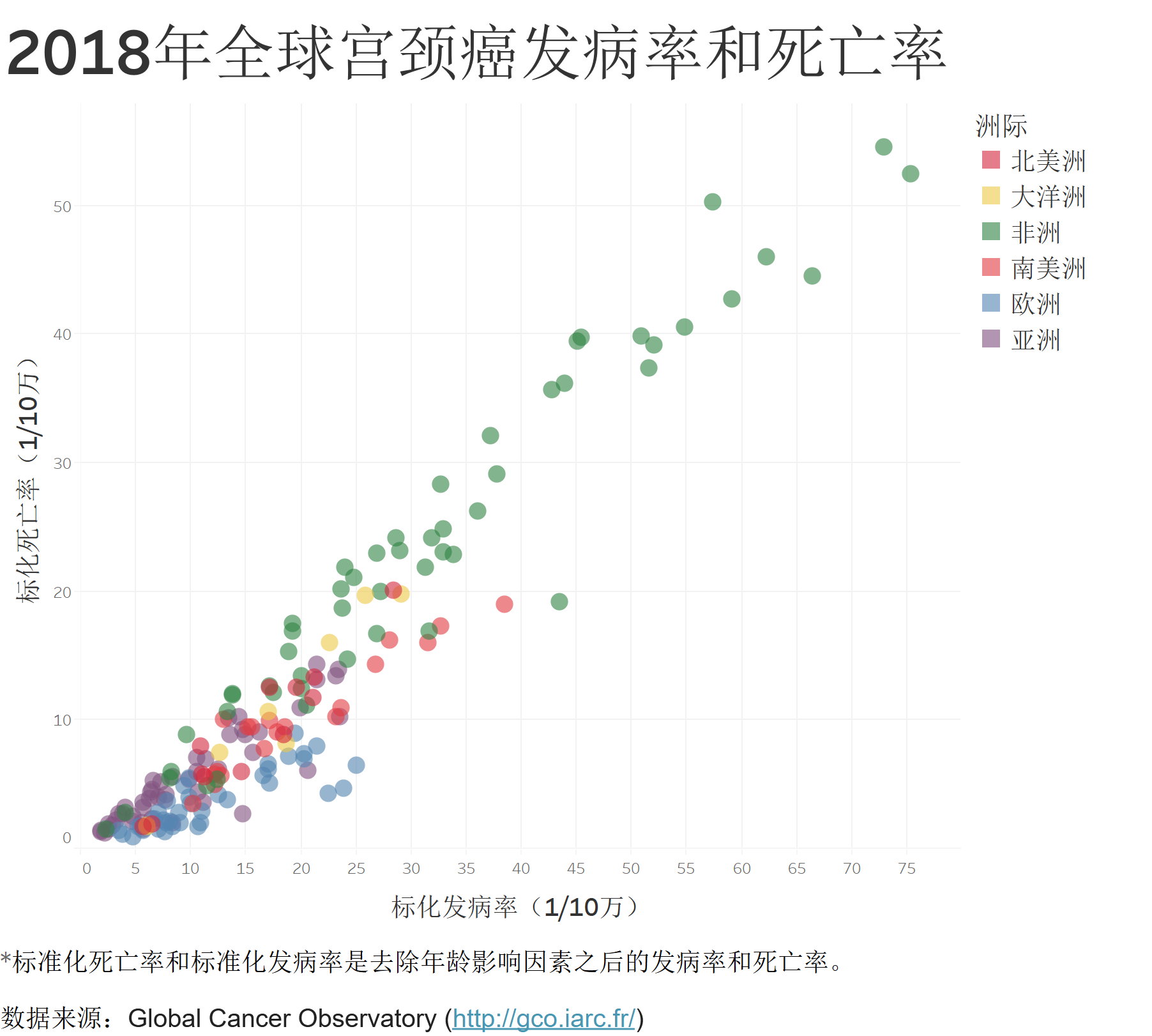
2018年全球宫颈癌发病率和死亡率
从2018年全球的宫颈癌发病率和死亡率来看,宫颈癌依旧是全球女性中第四大常见癌症,仅次于乳腺癌、肠癌和肺癌。宫颈癌也是不发达地区女性因癌症死亡的最主要原因之一,2018年,在非洲南部地区的部分国家,每十万女性中就有四十至八十人的宫颈癌新发病例,而这一数字在欧洲地区的一些国家不到六人。
自发现HPV(即人乳头状瘤病毒)是引发宫颈癌的主要因素以来,宫颈癌成为了唯一一个病因明确的癌症,这使它可以通过定期筛查得以预防,也让科学家离宫颈癌疫苗的研制更近一步。
▍澳大利亚研制,美国上市,HPV疫苗如何全球流动?
2009年1月,根据美国专利法,昆士兰大学的两位研究人员被授予HPV疫苗基础VLP(VLP是病毒样颗粒是,即与病毒非常相似的分子,但由于不包含病毒遗传物质,因此不具有传染性)发明的优先权,他们分别是伊恩·弗雷泽(Ian Frazer)教授和来自中国的周健教授。
1988年,周健受邀在剑桥大学病理学系肿瘤病毒实验室工作遇到了对HPV研究有共同兴趣的教授伊恩·弗雷泽(Ian Frazer)。在弗雷泽教授的邀请下,周健于1990年开始了在昆士兰大学的研究,并在同年和弗雷泽教授及同事一起成功地实现了用基因工程技术构建病毒复制品来生产疫苗的试验。在这一研究的基础上,澳大利亚医疗公司(CSL)和后来成功生产HPV疫苗的美国默克(Merck&Co)进行了大规模的动物和人类临床试验,最终验证了人乳头瘤病毒样颗粒对预防宫颈癌的效果。

伊恩·弗雷泽(左)和周健(右)
遗憾的是,1999年,当两人的研究成果佳达修(Gardasil)疫苗全面开始临床试验时,42岁的周健积劳成疾,突发肝病去世。
2006年,美国食品药品监督局(FDA)批准了默克公司生产的HPV疫苗佳达修上市。这只疫苗的诞生让宫颈癌,这个杀死数亿女性的癌症,成为了至今唯一可以被疫苗预防的癌症。
2006年7月,加拿大紧随其后,批准了针对9至26岁女性的HPV疫苗。澳大利亚和欧盟也迅速批准了该疫苗的上市许可。根据默克公司的报道,在2007年第二季度,HPV疫苗已在80个国家/地区获得批准。与此同时,许多其他国家都在接受快速审核或加急审查。
在2009年,已经有23个国家将HPV疫苗纳入国家免疫规划,这意味着在这23个国家特定年龄的女性可以免费接种HPV疫苗,而它们全部为中高收入水平或高收入水平国家。2011年,在全球疫苗与免疫联盟的帮助下,卢旺达成为了第一个将HPV疫苗引入全国免疫规划的低收入水平国家。
在亚洲,韩国于2007年6月批准四价HPV疫苗(Gardasil®–VPH 6/11/16/18)可以用于9至26岁的女性和9至15岁的男性,成为第一个引入HPV疫苗的亚洲国家。香港地区也在2007年引入了HPV疫苗,日本因需要本土实验数据推迟了两年的时间,在2009年批准了HPV疫苗的上市。除了日本和韩国之外,泰国和印度也分别在2007年和2008年批准了HPV疫苗的上市,随后,柬埔寨、越南和菲律宾等国家也相继批准引进该疫苗。
在中国内地,药审中心在2005年10月承办了葛兰素史克制药公司(GSK)提交的双价HPV疫苗临床申请。2016年该公司生产的双价HPV疫苗希瑞适(CERVARIX)才获批进入市场,但HPV疫苗并未纳入全国的免疫规划,仅有深圳市在2018年将其纳入了医保报销范围。
在中高收入水平和高收入国家的队列中,中日韩三国的宫颈癌发病率都处于中上游水平。但从数据来看,2006年至2015年各地区的粗发病率趋势不尽相同。相比中国和日本,韩国的宫颈癌粗发病率总体呈现向下的趋势。中国内地在十年中的粗发病率增速最快,从2006年四个地区中最低的粗发病率(10.3)增长为最高的粗发病率(16.56)。香港地区的宫颈癌粗发病率虽为上升趋势,但增速相比内地较缓。
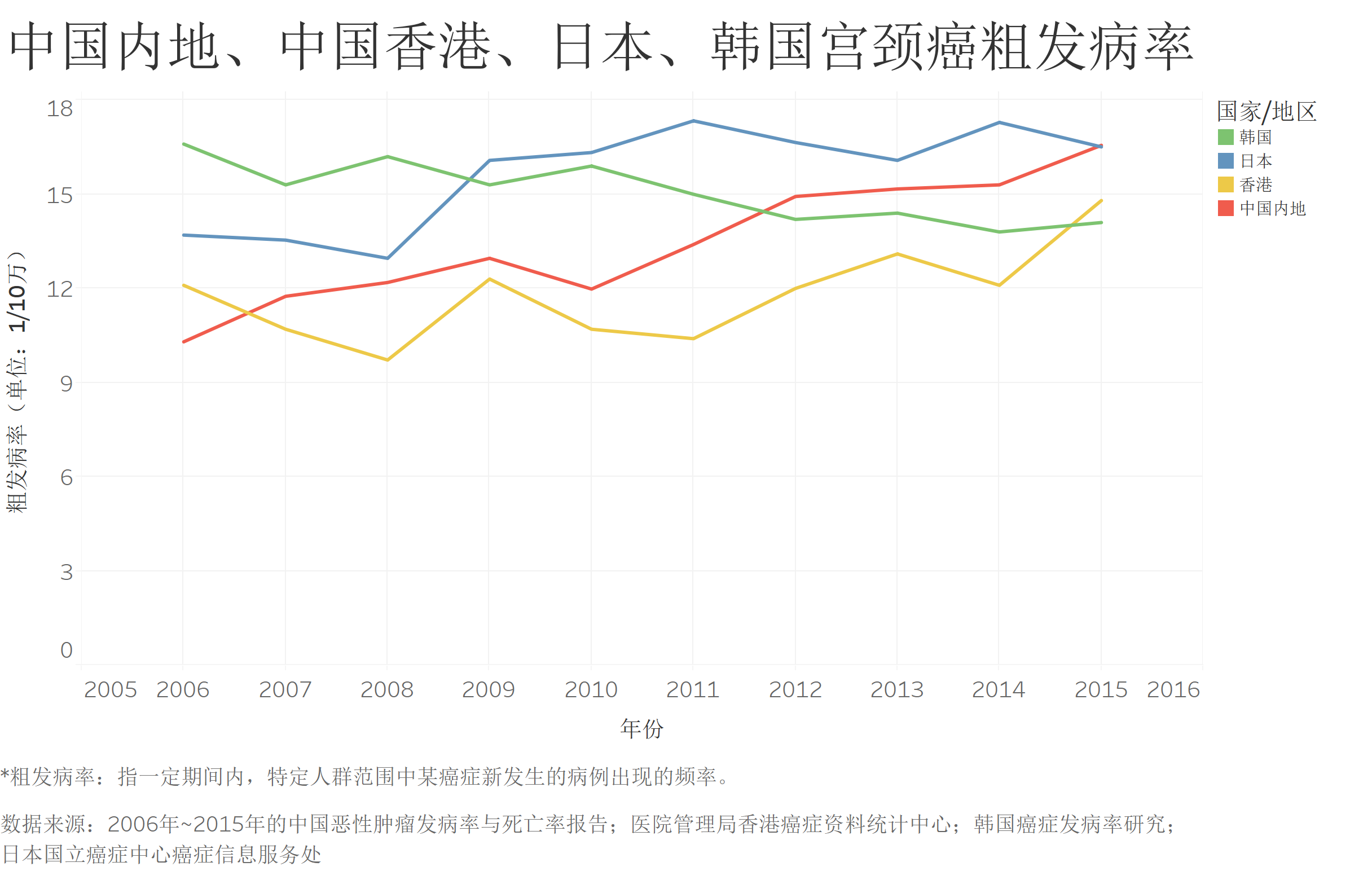
中国内地、中国香港、日本、韩国宫颈癌粗发病率
HPV疫苗并不是影响宫颈癌发病率的唯一因素,但据研究显示,从已报告的10个国家的数据显示,HPV疫苗的接种能有效地预防宫颈癌——即便只达到40%的较低接种覆盖率时也预测能形成群体免疫力。这意味着,当HPV疫苗达到40%的覆盖率时,未接种该疫苗的人也能得到保护。而在中国内地,HPV疫苗迟到了十年,这无疑严重影响了疫苗的覆盖率。
那么在中国HPV疫苗的入市为什么经历了十年之久的等待?迟到的十年又对中国的宫颈癌负担带来了怎样的影响?
▍漫长的审批与迟到的十年
据相关报道和研究显示,本土实验数据的收集是HPV疫苗迟到十年才被批准进入中国市场的关键原因。
根据《中华人民共和国疫苗管理法》第十九条规定,在中国境内上市的疫苗需要经国务院药品监督管理部门批准,取得药品注册证书。而申请疫苗注册,就需要提供疫苗实验的临床数据以及资料和样品。所以尽管双价HPV疫苗的临床试验已在2002年至2005年在其他亚洲国家/地区进行,但由于WHO最初的全球多中心临床试验中不包括中国,这一试验结果未被中国接受。在中国进行临床试验成为制药公司在中国寻求药品许可证的必经之路,而疫苗准入中国的时间长就成了普遍情况。

根据数据显示,包括HPV疫苗在内的所有在中国上市的进口疫苗与该疫苗在国际上首次上市的时间,平均相差约8年。
除了对本土临床试验数据的坚持外,2016年7月发表在国际医学顶级期刊《柳叶刀》的社论“HPV疫苗的接种:十年之后”(HPV vaccination: a decade on)指出,在中国,药物批准的滞后与药物临床试验注册时间长且没有优先级机制有关。与中国一样,许多国家规定在进行本土临床实验之前,不能在本国使用该药物。但HPV疫苗迟到十年的原因除了接受本土临床实验数据的要求之外,还有不同的审批标准。
HPV疫苗的发明者之一弗雷泽教授说:“宫颈癌在由感染引起的癌症中是独一无二的,因为每一种宫颈癌都与HPV感染有关。”他说:“这使之成为开发疫苗的理想之选,因为如果我们能够预防感染,该疾病就应该消失。” 依据多项研究的实验结果,世界卫生组织也呼吁以“持续感染”作为HPV疫苗的审批标准。
但是食品药品监督管理总局(CFDA)不认可”预防了HPV感染,就能预防宫颈癌“这一结论,坚持临床试验数据不能只表现出HPV疫苗能“消除HPV的持续感染”,还必须加上“降低癌症病变率”,因此,在中国内地进行的HPV疫苗临床试验必须花上更长的时间,收集到宫颈癌疫苗能够直接降低宫颈癌发病率的数据。
国内将「持续感染」和「二级以上瘤变」的复合指标作为终点指标并于2008年开始进行中国实验。而同样坚持本土临床实验数据的日本,选择接受将「持续感染」作为终点指标。2009年,日本批准了HPV疫苗的进口许可,比中国早了7年。
2013 年,双价HPV疫苗在中国为期五年的临床疫苗项目才结束,而等待这支疫苗的还有审批流程。
通过对丁香园insight数据库的分析,网易新闻发现,2014年我国的3.1类新药(指已在国外上市销售但未在国内销售的制剂及其原料药)申报临床的平均审评时间为27个月,申报生产的平均审评时间为34个月,两个阶段的审评时间就占据整个新药研发时间的64%。而假设开发的是同一款新药,美国FDA进行新药审评的平均时长为30个月,仅为新药研发时间的31%。
▍错过最佳接种时间的一代人
2013年,39岁的陈女士在单位组织的体检中查出了宫颈癌癌前病变,让她惊讶的是,她有五位同事都检查出了同样的问题。“我们单位那么小个地方,没想到会有那么多人都得了这个病,”她说:“当时第一反应就是害怕,后来我们五个人都去北京找了最好的妇科医院看病。”那时,陈女士还没有听说HPV疫苗,但这距离世界上第一支HPV疫苗上市已经过去了7年。
默克公司负责开发并销售HPV疫苗佳达修的马克·芬伯格(Mark Feinberg)指出,“从历史上看,在发达国家引进新疫苗与在发展中国家提供新疫苗之间有15年或更长的时间。”但对于HPV疫苗这样有最佳接种时间的疫苗来说,迟到的十年会导致一代女性错过接种的最佳时间,并为中国未来几十年的宫颈癌患病率带来负担。

中国医学科学院北京协和医学院肿瘤研究所的两位研究者在2013年发表的针对HPV疫苗在中国延期影响的研究论文显示,如果中国的HPV疫苗更早上市,并将9-15岁的女孩纳入免疫计划的接种范围,其在06年至12年年间可以预防197万例HPV感染,并避免38万人发展至宫颈癌,甚至可以在今后几十年中减少21万例相关疾病死亡人数。(注:计算方式)
这篇论文也在全国子宫颈癌协作组工作会议暨学术研讨会上被国家卫生健康委疾控局副局长雷正龙引用,以倡导HPV疫苗的全民覆盖。
2016年,双价HPV疫苗佳达修在中国获得上市批准。
隔年,陈女士因为宫颈癌前病变始终没有转阴而接受了手术治疗。“我是手术之后才知道有这个疫苗的,”陈女士说。尽管当时陈女士还未到达双价疫苗接种的最高限制年龄,但她说:”因为当时已经感染而且接受了手术,也就觉得没有再接种的必要了。”
2018年澳大利亚的研究人员发表在《柳叶刀》的论文显示,“如果继续维持高覆盖率的HPV疫苗接种和筛查,澳大利亚将成为全球第一个有效消除子宫颈癌的国家。” 依据论文中的数据计算,在澳大利亚,宫颈癌最早可在2022年被归类为“罕见疾病”及在每10万女性中仅有6名以下的发病率,到2034年,这一癌症的死亡率预计将下降至十万分之一。
如果这一预测准确,自1991年起开始宫颈癌筛查计划并在2007年成为最早将HPV疫苗引进国家免疫计划的澳大利亚也将成为世界上第一个实现消除子宫颈癌的国家。
2018年,国家药品监督管理局发布了关于调整药物临床试验审评审批程序的告示,这一年7个临床急需的防治高危疾病的境外新药被加速批准,其中包括预防宫颈癌的九价HPV疫苗。中国检疫局有条件地接受了国外针对东亚华裔人种的临床实验数据,九价HPV疫苗以破纪录的速度仅8天就得到了上市批准。
根据世界卫生组织发布的报告,如果要在2030年消除宫颈癌,至少要有70%的35岁至45岁的成人女性进行HPV筛查;HPV疫苗至少要覆盖90%以上的15岁女孩。中国医学科学院肿瘤医院流行病学室主任赵方辉表示:“看现在中国的数据,我们就会知道这是非常有挑战和困难的。”
HPV疫苗上市只是第一步,扩大疫苗的接种率则面临着新的问题。
参考文献
[1] 消除宫颈癌,中国还差8000万支疫苗和亿次筛查 财经.2019年3月12日
[2] Arbyn, M., Weiderpass, E., Bruni, L., de Sanjosé, S., Saraiya, M., Ferlay, J., & Bray, F. (2020). Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. The Lancet Global Health, 8(2), e191-e203.
[3]Zhao, K. N., Zhang, L., & Qu, J. (2017). Dr. Jian Zhou: The great inventor of cervical cancer vaccine. Protein & cell, 8(2), 79-82.
[4]周健:世界首个宫颈癌疫苗背后的中国科学家.科学网.2016年7月22日
[5] McNeil, C. (2006). Who invented the VLP cervical cancer vaccines?. Journal of the National Cancer Institute, 98(7), 433-433.
[6] HPV vaccine inventor Ian Frazer sees his idea become reality. The Gavi.2012
[7]Merck Reports Double-Digit Earnings-Per-Share Growth for Second Quarter 2007.October
12, 2007.
[8] Drolet, M., Bénard, É., Boily, M. C., Ali, H., Baandrup, L., Bauer, H., ... & Donovan, B. (2015). Population-level impact and herd effects following human papillomavirus vaccination programmes: a systematic review and meta-analysis. The Lancet infectious diseases, 15(5), 565-580.
[9] HPV vaccination: a decade on.(2016).The Lancet editional, 388(10043),438
[10] 中国疫苗乱象:审批策略保守必备疫苗供应断链. 财经. 2015年12月22日
[11] 我们为什么打不上进口疫苗?.浪潮实验室.2018年7月25日
[12]对十二届全国人大四次会议第3403号建议的答复(关于加快HPV疫苗内地上市进程的建议).国家药品监督管理局.2016年09月12日
[13]十年等候 HPV 疫苗登「陆」之路还有多远?.丁香调查.2015年10月21日
[14] Feinberg, M. (2010). HPV vaccine suspension in India. The Lancet, 376(9753), 1644-1645.、
[15] Colombara, D. V., & Wang, S. M. (2013). The impact of HPV vaccination delays in China: lessons from HBV control programs. Vaccine, 31(38), 4057.
[16] Hall, M. T., Simms, K. T., Lew, J. B., Smith, M. A., Brotherton, J. M., Saville, M., ... & Canfell, K. (2019). The projected timeframe until cervical cancer elimination in Australia: a modelling study. The Lancet Public Health, 4(1), e19-e27.
[17]我国药制度品审评审批制度改革再提速.光明日报.2018年4月8日
[18]国家药品监督管理局关于调整药物临床试验审评审批程序的公告.国家药品监督管理局.2018年7月31日
作者:暨南大学新闻与传播学院 樊晨 陈嘉璐 董紫薇 龚宥心
指导老师:黄雅兰
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




