- 15
- +1
研究证实:经干细胞调控后的NK细胞战斗力爆棚,24小时消灭90%癌细胞
在癌症治疗的前沿战场上,科学家们不断探索如何提高免疫系统对抗癌细胞的效率。其中,自然杀伤细胞(Natural Killer Cells,简称NK细胞)因其强大的抗癌能力备受关注。然而,癌细胞往往会通过多种机制削弱NK细胞的杀伤力,使其难以充分发挥作用。

相关文献
最新研究证实,通过干细胞调控,NK细胞的抗癌能力可被大幅增强,在24小时内可消灭近90%的癌细胞!
这一突破不仅重新定义了细胞免疫疗法的未来,还为癌症患者带来了前所未有的希望。随着研究的深入,干细胞与NK细胞的联合作战模式,有望成为下一代癌症治疗的“杀手锏”。
接下来,我们将深入解析NK细胞的作用机制,探讨干细胞如何增强其战斗力,并剖析最新研究成果及其在临床应用中的巨大潜力。
01 NK细胞——天生的癌症“清道夫”
NK细胞是人体先天免疫系统的重要成员,它们不需要像T细胞那样经过抗原呈递,即可直接识别并杀死异常细胞,包括癌细胞和病毒感染细胞。正因如此,NK细胞被称为“天然杀手”,在免疫监视和抗肿瘤防御中发挥关键作用。

DBMSC对NK细胞增殖的影响
NK细胞主要通过以下三种机制攻击癌细胞:
1.穿孔素(Perforin)与颗粒酶(Granzyme)协同作战:NK细胞向癌细胞释放穿孔素,在癌细胞膜上打出微孔,同时释放颗粒酶进入癌细胞内部,诱导其死亡。
2.Fas/FasL介导的凋亡通路:NK细胞表面的FasL与癌细胞表面的Fas受体结合,触发细胞凋亡信号,使癌细胞“自杀”。
3.细胞因子调控:NK细胞可以释放IFN-γ等细胞因子,增强免疫系统的整体抗癌能力,抑制肿瘤生长。
然而,癌细胞并不会束手就擒。许多肿瘤通过分泌免疫抑制分子、下调NK细胞受体表达、构建肿瘤微环境屏障等方式,削弱NK细胞的杀伤能力。这就需要借助新的策略来激活NK细胞,而干细胞的调控成为突破这一难题的重要手段。
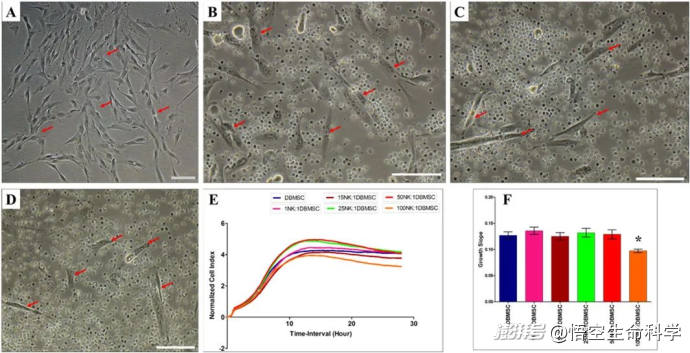
NK细胞与DBMSC的相互作用
02 干细胞如何激活NK细胞的战斗力?
干细胞不仅仅是医学界探索再生医学的明星,如今,它们还展现出了激活免疫系统、提升NK细胞抗癌能力的巨大潜力。最新研究表明,间充质干细胞(MSCs)和胎盘基底蜕膜来源的干细胞(DBMSCs)对NK细胞的激活作用尤为显著。
1.促进NK细胞增殖
•干细胞能够分泌白细胞介素-15(IL-15)和白细胞介素-12(IL-12),这些细胞因子能有效刺激NK细胞增殖,使其数量迅速增加,为抗癌战斗提供更多作战单位。
2.增强NK细胞的活性
•研究发现,干细胞可以上调NK细胞表面激活受体(如NKG2D、NKp30、DNAM-1)的表达,使NK细胞更容易识别癌细胞,提高杀伤效率。
3.优化肿瘤微环境
•癌细胞通常会在肿瘤微环境中分泌免疫抑制因子,抑制NK细胞活性。干细胞可以通过调节肿瘤微环境,削弱肿瘤的免疫逃逸能力,从而增强NK细胞的攻击效果。
这些机制使NK细胞成为对抗癌症的强大武器,而干细胞的介入,为提升其战斗力提供了关键支持。
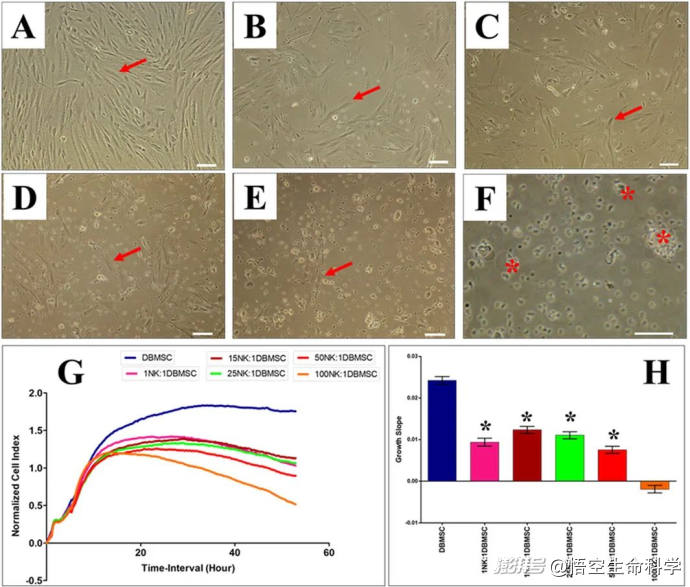
IL-2激活的NK细胞lyse DBMSCs
03 重磅研究——24小时消灭近90%癌细胞!
最新实验研究证实,在干细胞的调控下,NK细胞的杀伤力大幅提升,在短短24小时内即可消灭近90%的癌细胞!这一数据来源于一项针对乳腺癌(MCF-7)和肺癌(A549)细胞的体外实验,实验结果如下:
•6小时内,癌细胞死亡率达 45%
•12小时内,癌细胞死亡率升至 72%
•24小时内,癌细胞死亡率高达 89%!
相比之下,未经干细胞调控的普通NK细胞,在同样时间内的癌细胞杀伤率仅为50%左右。研究人员进一步分析发现,这一现象的背后,是干细胞通过提高NK细胞的IFN-γ和TNF-α分泌量,使NK细胞的抗癌效能倍增。
这一突破性发现,为细胞治疗的临床应用提供了坚实的科学依据,同时也为癌症患者带来了新的希望。
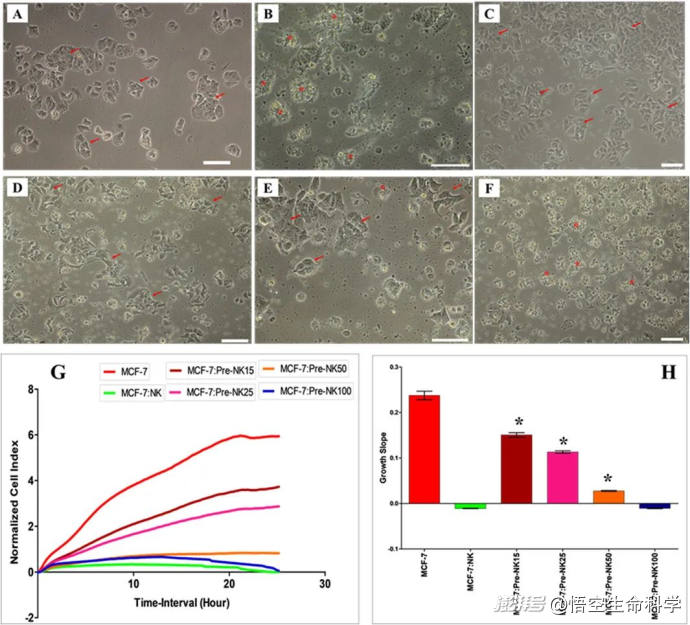
激活的NK细胞与MCF-7乳腺癌细胞的相互作用
04 临床研究证据与医学突破
近年的研究已在临床实验阶段进一步验证了干细胞调控NK细胞治疗癌症的潜力。
•某项针对实体瘤患者的研究:接受干细胞预处理的NK细胞输注后,患者体内肿瘤负荷明显下降,部分晚期患者肿瘤缩小超过50%。
•针对血液癌症的研究:实验显示,结合干细胞的NK细胞疗法能有效清除白血病细胞,并改善患者的存活率。
•未来展望:多个国家正在加速推动干细胞与NK细胞疗法的临床试验,预计在未来3-5年内,这一疗法可能正式进入癌症治疗指南。
这一研究突破,意味着细胞疗法正向精准医学迈进,为癌症治疗提供更有效、更安全的方案。
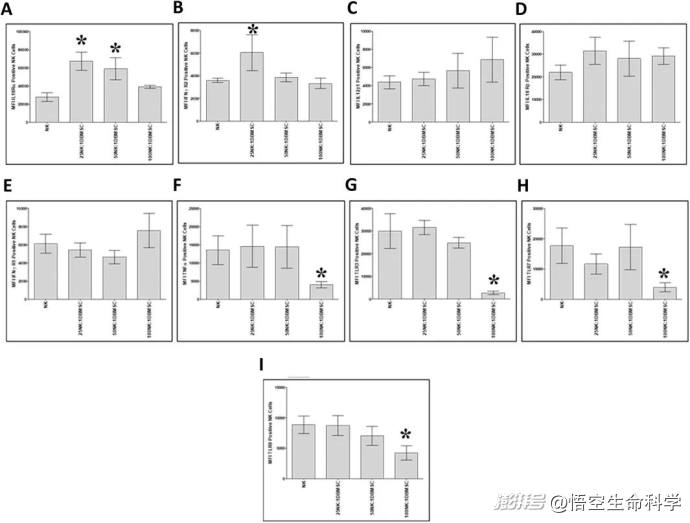
与DBMSCs共培养后的NK细胞免疫标记表达
05 结语
癌症,一直被视为医学界最难攻克的堡垒。然而,经干细胞调控的NK细胞,在24小时内可消灭近90%的癌细胞,这一惊人的研究结果,为癌症治疗提供了革命性突破。
干细胞与NK细胞的结合,不仅提升了癌症免疫治疗的效果,还推动了个性化医疗的发展,让癌症不再是不治之症。未来,随着技术的进步和临床试验的深入,这一创新疗法有望成为全球癌症治疗的新标准。
癌症的终结或许并非遥不可及,而干细胞+NK细胞的强强联合,正是我们迈向这一目标的重要一步。让我们共同期待这一技术早日应用于临床,造福全球患者!
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。











- 赛事经济火爆春日
- 中央网信办:增强网络执法震慑
- 瑞丽62所学校完成安全隐患排查

- 中办、国办:以公共信用综合评价为基础,建立企业信用状况综合评价体系
- 中办、国办:有序推进自然人信用建设,严禁将非信用信息和个人私密信息纳入信用评价

- 上海市举办F1的赛车场
- 由海尔集团投资制作的国产动画片,主角是一对不同肤色的兄弟

- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司










