- 31
- +1
涉783名患者、2200人年追踪:《Nature》子刊研究,证实了T细胞疗法的安全性

在医学这条不断追逐“可能性”的道路上,最珍贵的,莫过于一组稳定而清晰的数据。
2025年3月10日,《自然·医学》发布了一项里程碑式的研究:在覆盖783名患者、累计超过2200人年的跟踪观察中,科学家没有发现任何一例因T细胞基因编辑疗法导致的肿瘤发生。
▲加拿大CAR-T平台
这是一组接近“零风险”的结果,它的分量远超一纸报告,因为它回应了人们长期以来对细胞疗法“可能致癌”的质疑——而回答是明确的:“没有证据”。
在全球基因疗法安全性焦虑情绪高涨的当下,这一发现,如同一枚定心丸,砸向整个医疗圈与投资界的核心神经。
01 技术何以让细胞“懂得”杀死癌症
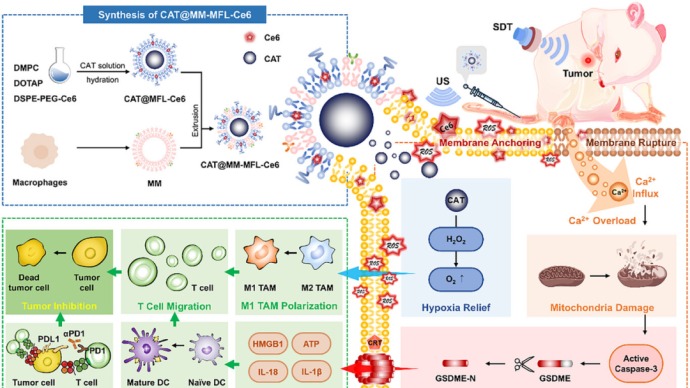
癌症的狡猾,恰恰在于它“伪装”得像正常细胞,逃避人体免疫系统的识别与清除。而基因编辑的T细胞疗法,正是破解这场伪装的精准武器。它的关键并不在于发明了什么新药,而在于教会人体自己的免疫细胞识别并消灭癌细胞。
过程是这样的:医生从患者体内提取T细胞,通过CRISPR/Cas9等技术,将一种叫做“嵌合抗原受体”(CAR)的人工设计分子植入细胞基因中。
这个CAR就像一把钥匙,精准对应癌细胞表面特有的“门锁”——肿瘤相关抗原。改造完毕的T细胞随后被扩增至数十亿个,再重新输入体内,开始执行清除癌细胞的“定点爆破任务”。
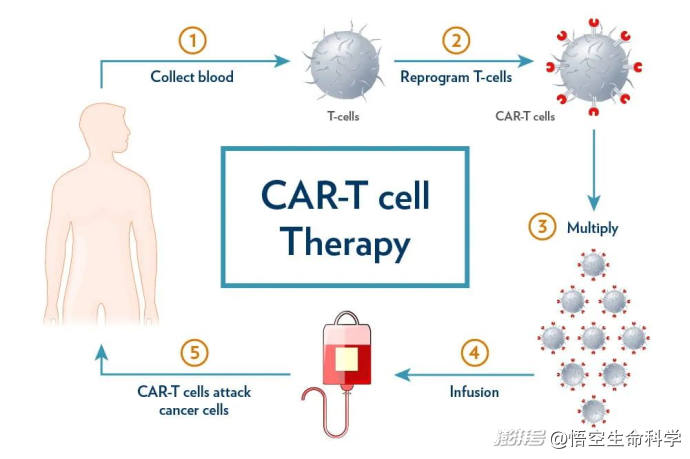
CAR-T细胞疗法
CAR-T疗法首次大规模应用于2017年。诺华的Kymriah和Kite Pharma的Yescarta相继获得FDA批准,分别用于儿童急性淋巴细胞白血病和成人大B细胞淋巴瘤,治愈率一度高达83%(2019年NEJM数据)。
它不仅打破了传统化疗“杀敌一千,自损八百”的逻辑,更以个性化、免疫记忆、靶向性强等特点,构建了肿瘤治疗的全新范式。
正因如此,全球已有超过30万人接受了此类免疫细胞疗法——而这组技术能否长期安全地存在于人体之中,是悬在头顶的一把达摩克利斯之剑,直到这项“2200人年”的研究落地。
02 黑框警告背后的误读与真相
就在2024年底,美国FDA对六款已经上市的CAR-T产品发布了“黑框警告”——这是药品监管中最严厉的安全提示。原因是有少数病例在接受CAR-T治疗后出现T细胞相关恶性肿瘤。这一消息一度在业内引发震动,一些自媒体甚至断言:“细胞疗法正在引发新的癌症”。
然而,冷静的数据,很快给出了不一样的答案。
截至2024年,全球接受CAR-T治疗的患者超过34,000人,而据FDA通报的可疑病例不足20例,其中很多还不能确定是否与治疗直接相关。也就是说,这类风险的发生率极低,远低于许多传统疗法的不良反应比例。
更重要的是,在这批报告病例中,几乎全部都发生在极为复杂的病情背景下——患者本身多次接受放化疗,免疫系统已经严重紊乱,发生次生癌变的可能性本就偏高。
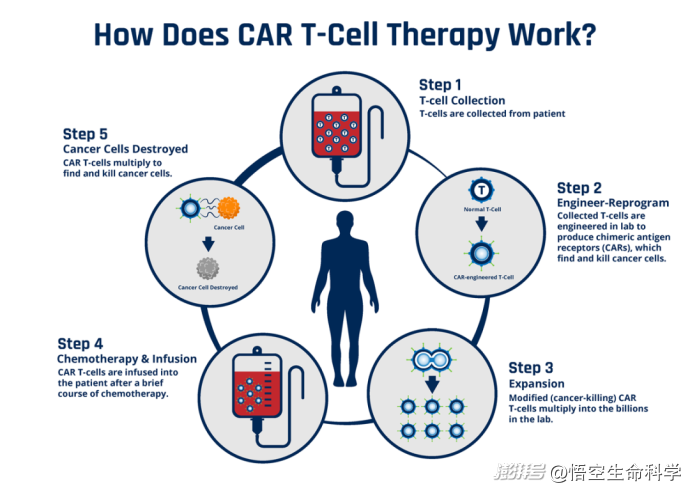
2025年3月,《Nature Medicine》这项涵盖783人、累计2200人年随访的大型分析,明确指出:在这组庞大的临床样本中,没有发现任何证据表明CAR-T等基因改造T细胞会导致肿瘤发生。
研究者来自宾夕法尼亚大学、纪念斯隆凯特琳癌症中心、MD安德森等多家顶级机构,具有极强的权威性。
事实再度说明:FDA的警告并非否定,而是制度下的风险提示。而临床数据才是疗法真实风险的根基。
03 2000人年无癌追踪,释放了什么信号?
2025年3月10日,《Nature Medicine》刊登了一项令人瞩目的多中心联合研究,研究者对接受基因编辑T细胞治疗的783名患者进行了长期随访,累计追踪时长超过2200人年——这是目前为止全球范围内对该疗法安全性最全面、最长期的随访数据之一。
研究覆盖多个癌种,包括B细胞白血病、淋巴瘤、多发性骨髓瘤等,治疗方式涵盖了主流CAR-T产品与多种临床研究型TCR-T产品。所有患者均在使用基因改造T细胞后接受了3年至6年的不间断医学观察。最终结果令人振奋:无一例因疗法本身导致的新发肿瘤。
这意味着什么?在2200人年的高强度监控中,如果插入性致癌是一种“普遍隐患”,它本应已现身。但事实是,它并没有发生。这种规模级别的“沉默”,本身就是一种最响亮的安全性证明。
研究联合第一作者、宾夕法尼亚大学免疫治疗中心的Bruce Levine教授指出:“我们不能说永远没有风险,但我们现在可以明确说,它非常稀有,非常非常低。”
这项研究不仅回应了FDA的黑框警告,更打破了细胞疗法长期以来背负的“致癌阴影”,为监管者、医生、投资人和患者提供了一个共同可依赖的安全基线,也成为下一阶段产业放量的信号弹。
04 技术革命,不只是“可选项”,而是“必需品”
在2023年发布的《全球癌症负担报告》中,中国新发癌症病例达到了482万人,死亡人数超过300万。
放眼全球,每年因癌症失去生命的人接近1000万。传统治疗手段——手术、放疗、化疗虽仍为主流,但在不少晚期或复发型患者身上效果有限,尤其在儿童白血病、多发性骨髓瘤、恶性淋巴瘤等领域,治疗困境仍广泛存在。
这并不是医疗手段的失败,而是敌人太狡猾。癌细胞复杂多变,有的具备高度耐药性,有的能够逃避免疫识别,有的甚至“利用”治疗反应促进自身扩散。在这种背景下,细胞疗法不是一个技术炫技的选项,而是一条不得不走的出路。
2017年,诺华的Kymriah成为首个被FDA批准的CAR-T疗法,用于治疗儿童及年轻成人复发性急性淋巴细胞白血病。
临床数据显示,该疗法的缓解率高达81%;同年批准的Yescarta,在某些成人淋巴瘤中缓解率超过70%,部分患者已存活超过5年。传奇生物与强生联合开发的Carvykti,用于治疗骨髓瘤的III期临床试验中,患者完全缓解率为73%(2023年ASCO年会数据)。
更重要的是,T细胞疗法具备“活性药物”的潜力:它在体内自我复制、自我更新、自主巡逻,从“打一枪换一个地方”,变成“驻扎下来的特种部队”。这意味着,癌症不再只是“被清除”,它还可能被长期“监视”和“控制”。
05 信心比治疗更稀缺,而数据正是信心的锚点
医学的进步从来都不是靠一时惊艳,而是靠持续验证和扎实证据。细胞疗法,尤其是基因编辑的T细胞技术,正走在这条路上。
此次《Nature Medicine》公布的2200人年、零肿瘤事件数据,无疑是这一疗法最具分量的“无声胜有声”的证明。
它不仅为监管部门提供了底气,为医生提供了选择,更为患者带来了真正的希望——一种可以安心选择、安心等待、安心依赖的未来。
科技不能保证奇迹,但足够好的数据,能保障信念不再动摇。这不是一项炫目的科学展示,而是一次对生命质量的切实承诺。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。



















- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司