- +1
在体内直接生成CAR-T细胞,安全有效治疗癌症,华南理工大学王均/许从飞团队带来新突破
撰文丨王聪
编辑丨王多鱼
排版丨水成文
嵌合抗原受体 T 细胞(CAR-T)疗法在血液系统恶性肿瘤的治疗中取得了显著成功,并在系统性红斑狼疮等自身免疫病中展现了巨大潜力。然而,传统的 CAR-T 细胞制备方法依赖于体外病毒感染,生产流程复杂,价格昂贵,并且存在细胞因子释放综合征(CRS)以及致瘤性等潜在风险。
近年来,mRNA 技术的成熟和广泛应用,带来了一种更安全、更快捷的 CAR-T 细胞构建方案——将 mRNA 注射到体内,直接在体内原位生成 CAR-T 细胞。然而,当前基于脂质纳米颗粒(LNP)的 mRNA 递送方法面临着 T 细胞摄取差和内体逃逸效率低的挑战。
因此,迫切需要开发一种能够在体内特异性且高效地将 mRNA 递送至 T 细胞的新型递送载体。
2025 年 3 月 10 日,华南理工大学王均教授、许从飞副教授等人在 Cell 子刊 Cell Biomaterials 上发表了题为:Leveraging T cell-specific fusogenicity of HIV for in vivo mRNA delivery to produce human CAR-T cells 的研究论文。
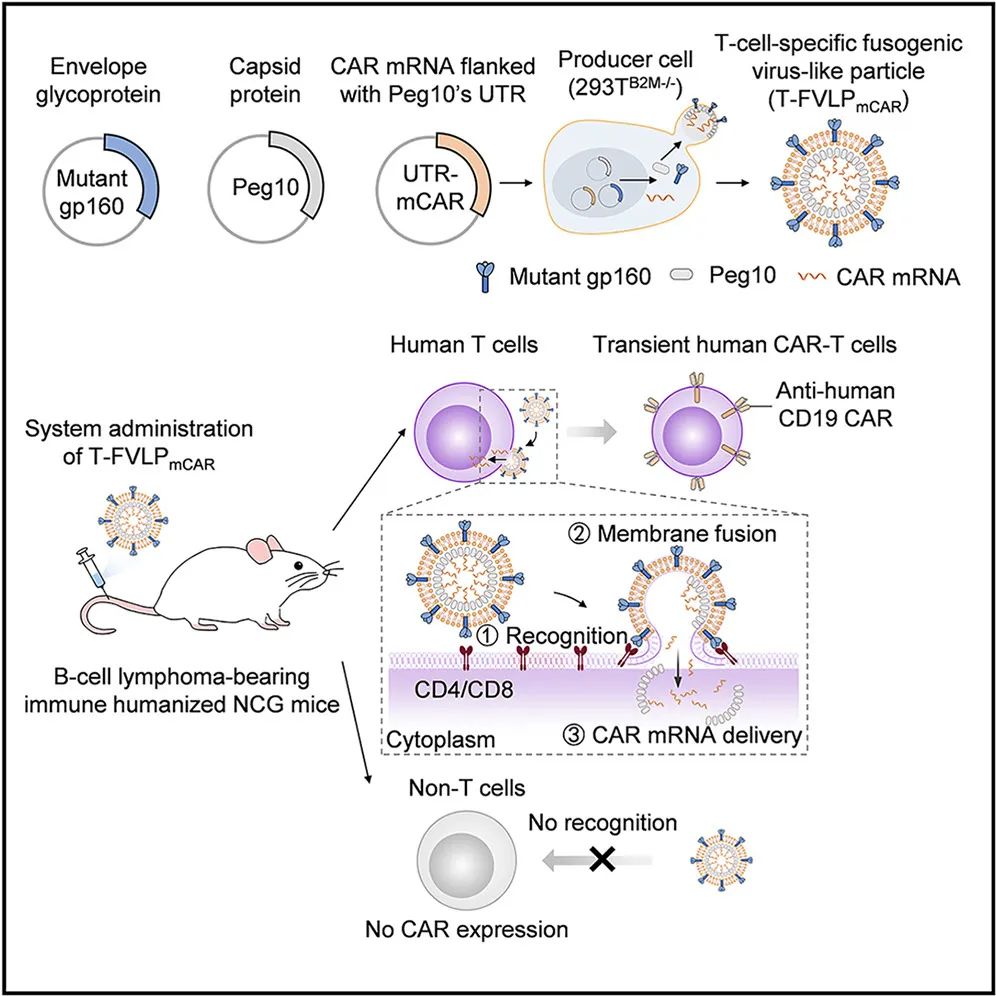
该研究利用 HIV 病毒的 T 细胞特异性融合,开发了一种 T 细胞特异性融合病毒样颗粒(T-FVLP),能够模拟 HIV 病毒,高效地将 CAR mRNA 递送到 T 细胞中,从而在体内产生人类 CAR-T 细胞。
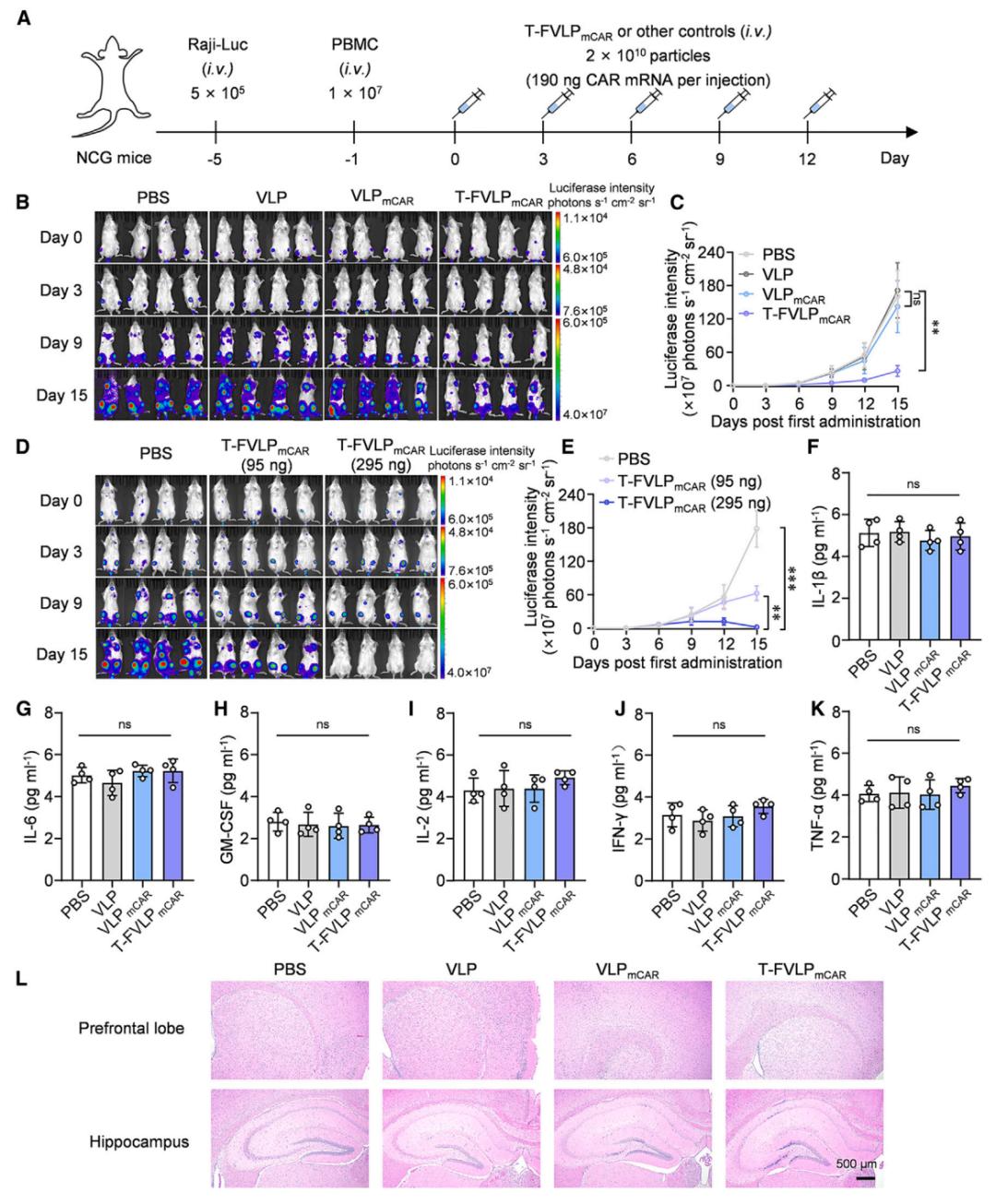
小鼠模型实验显示,T-FVLPmCAR 能够在体内生成足够的 CAR-T 细胞并有效治疗淋巴瘤,且不会引发细胞因子释放综合征及神经毒性等副作用,从而为传统的 CAR-T 生产提供了一种可扩展的、更安全的替代方案。

人类免疫缺陷病毒(HIV)是导致人类艾滋病的病毒,是一种由包膜、衣壳和 RNA 组成的 RNA 病毒,能够感染人类 CD4+ T 细胞。HIV 病毒上的包膜糖蛋白 gp160 能够识别 T 细胞上的 CD4 分子,从而促进病毒包膜与 T 细胞膜的融合。这一过程使得由衣壳蛋白 gag 装载的基因组 RNA 能够直接递送至 T 细胞的细胞质中,从而绕过了内吞作用途径。此外,还有研究证实,一种突变的 gp160 能够靶向 CD4+ 和 CD8+ T 细胞,这扩大了对不同 T 细胞亚群的靶向潜力。
因此,HIV 是一种天然的 RNA 药物载体,具有独特的递送方式,通过细胞靶向膜融合机制,能够特异且高效地将 RNA 递送至 T 细胞中。
在这项新研究中,研究团队利用 HIV 病毒的膜融合机制,设计了一种 T 细胞特异性融合病毒样颗粒(T-FVLP),能够模拟 HIV 病毒,高效地将 CAR mRNA 递送到 T 细胞中(T-FVLPmCAR),从而在体内产生人类 CAR-T 细胞。T-FVLP 呈球型囊泡状结构,直径为 97.2 纳米,生产效率为 1 × 107 个 293TB2M−/−细胞产生 1.5 × 109 个 T-FVLP 颗粒。
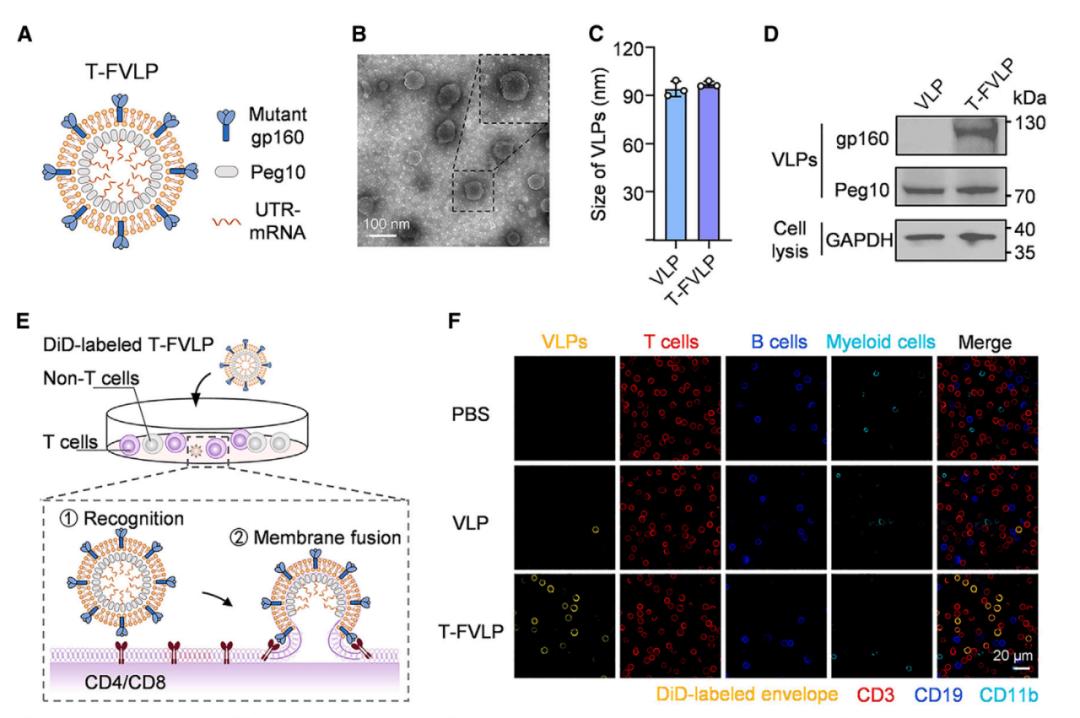
T-FVLPmCAR 在其表面展示一种突变型包膜糖蛋白 gp160,并通过衣壳蛋白 Peg10 装载 CAR mRNA。突变型 gp160 能够特异性识别人类 T 细胞,并启动 T-FVLPmCAR 与 T 细胞膜的融合,从而将 CAR mRNA 直接递送至 T 细胞的细胞质中,以生成人类 CAR-T 细胞。
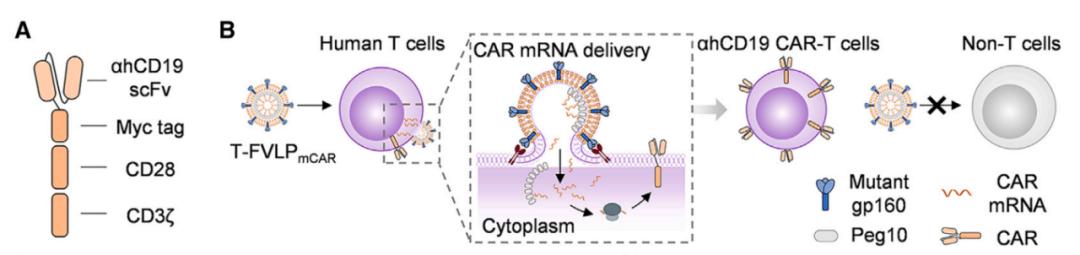
每只小鼠通过系统注射T-FVLPmCAR,只需低于 1 微克的 anti-CD19 CAR mRNA,即可在小鼠体内产生足够的 CAR-T 细胞来治疗 B 细胞淋巴瘤,且不会引发细胞因子释放综合征及神经毒性等副作用。
总的来说,该研究开发了一种 T-FVLPmCAR,它模拟了 HIV 的活性识别和膜融合机制,能够高效且特异性地将 CAR mRNA 递送至人类 T 细胞。这种策略能够实现体内瞬时人类 CAR-T 细胞的生成,从而提高 CAR-T 细胞疗法的效率和安全性。
论文链接:
https://www.cell.com/cell-biomaterials/fulltext/S3050-5623(25)00002-9
设置星标,不错过精彩推文
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




