- +1
突触强度的“分子密码”:跨突触纳米柱如何动态调控神经信号
原创 Cell Press CellPress细胞科学

生命科学
Life science
突触是大脑信息传递的“精密开关”,而跨突触纳米柱(trans-synaptic nanocolumn)则是这一开关的核心组件。它由突触前释放神经递质的蛋白机器与突触后接收信号的受体分子精准对齐形成,如同一座纳米尺度的“分子桥梁”。这种结构的动态变化,被认为是突触强度调节和大脑可塑性的物理基础。
近日,中国科学技术大学唐爱辉团队在Cell Press细胞出版社旗下期刊Trends in Neurosciences发表了题为“Tuning synapse strength by nanocolumn plasticity”的综述文章。该论文系统总结了近年来在突触纳米尺度结构研究中的突破性进展,聚焦于纳米柱(nanocolumn)的分子组织机制及其在突触传输、可塑性与神经病理中的核心作用,揭示了突触纳米柱如何通过动态重组优化神经信号传递效率,并为理解突触功能异常相关疾病提供了全新视角。
有兴趣在Trends in Neurosciences发表您的综述文章?请扫描提交论文提案 (presubmission inquiry)。
突触信号传递的“纳米车间”:跨突触纳米柱
突触是神经元间信息传递的核心结构,虽仅有病毒大小的空间(约400纳米),却是一个高度有序的“分子工厂”——聚集了超过1800种蛋白质,精密调控神经信号的传递效率。传统电子显微镜曾为突触形态描绘轮廓,但蛋白质的纳米级排布细节始终是未解之谜。直到超分辨率显微镜(如STORM、STED)和冷冻电镜技术的突破,科学家才得以窥见这一微观世界的精妙设计:突触蛋白并非杂乱分布,而是形成高密度的功能聚集体——亚突触域(subsynaptic domains, SSDs,或简称簇)。突触前活性区(active zone)中介导递质释放关键蛋白的SSD与突触后致密区(postsynaptic density, PSD)中的受体和支架蛋白SSD间在空间上相互对齐,形成跨突触 “纳米柱”结构,将神经递质释放位点精准对准受体簇,从而显著提升突触效能。以海马区谷氨酸突触为例,突触前膜的RIM蛋白簇与突触后膜的AMPA受体簇通过纳米柱精准对齐。这种“点对点”的设计,使得单个囊泡释放的神经递质能够高效激活大量受体,显著放大突触信号——如同用激光笔精准照射靶点,而非散射的光束。这种结构-功能的高度匹配为突触强度的精确调控提供了物理基础。
蛋白质的“相变魔法”:亚突触域形成的潜在机制
细胞内存在一种神奇的“分子分选”机制——液-液相分离(liquid-liquid phase separation, LLPS)。如同油滴在水中自发聚集,突触蛋白通过多价相互作用等机制形成动态的“蛋白质液滴”。例如,突触前活性区蛋白(如RIM、Munc13)与突触后支架蛋白(如PSD-95、Shank),通过这种“相变魔法”可以分别形成动态凝聚体(Chen et al., 2020; Shen et al., 2023)。最新的证据表明,液-液相分离也可能参与到亚突触域的形成中。首先, AMPAR和PSD-95的SSD均表现出与相分离液滴高度类似的动态性。其次,即使高度同源的蛋白,例如PSD-95与SAP102,也因为相互作用的不同形成大小不一且共定位较弱的SSD。同时,CaMKII自磷酸化后,蛋白相互作用的改变使得AMPAR从与NMDAR-CaMKII形成的蛋白质聚集体中分离出来。最后,使用脂肪醇急性破坏液-液相分离后,突触前RIM1/2和Munc13的SSD 受到很大影响。
纳米柱的“分子铆钉”:跨突触黏附分子
关于跨突触纳米柱的形成,一个合理的假设是,特定的跨突触分子通过蛋白质间的“锁-钥”结合,将突触前递质释放的“分子机器”(如囊泡释放蛋白)与突触后的受体支架精准铆合起来。突触细胞粘附分子(CAMs)已被确定参与纳米柱的精确调控。例如,神经连接蛋白(neuroligin, Nlgn)与富含亮氨酸重复跨膜蛋白(LRRTM)通过作为“分子手臂”的胞外域,与突触前Neurexin蛋白“握手”,架起一座跨突触的桥梁(图1)。
这种“铆钉”的作用并非一成不变。实验发现,若通过基因敲除或酶切破坏neuroligin或LRRTM2,突触后受体簇与突触前RIM蛋白簇的对齐会被打乱,导致神经递质的释放效率大幅下降(量子释放幅度降低)。此外,另一些分泌型分子(如Cbln1、LGI1-ADAM22复合物)则通过竞争性结合,动态调节突触前Neurexin的纳米簇分布,进而影响突触后GluD受体的定位——这类似于通过“分子开关”调整桥梁的铆接强度。
黏附分子的动态重组,为突触可塑性提供了关键机制。例如,在长时程增强(LTP)过程中,突触后PSD-95蛋白簇与突触前释放位点的对齐度会显著提升,仿佛通过“分子拉链”将突触前后结构紧密拉合,从而快速增强信号传递效率。值得注意的是,这些分子不仅是静态的“结构铆钉”,还能充当“信号放大器”:通过调控突触前钙通道的开放概率和突触后受体的磷酸化状态,它们进一步放大了纳米柱的功能可塑性。
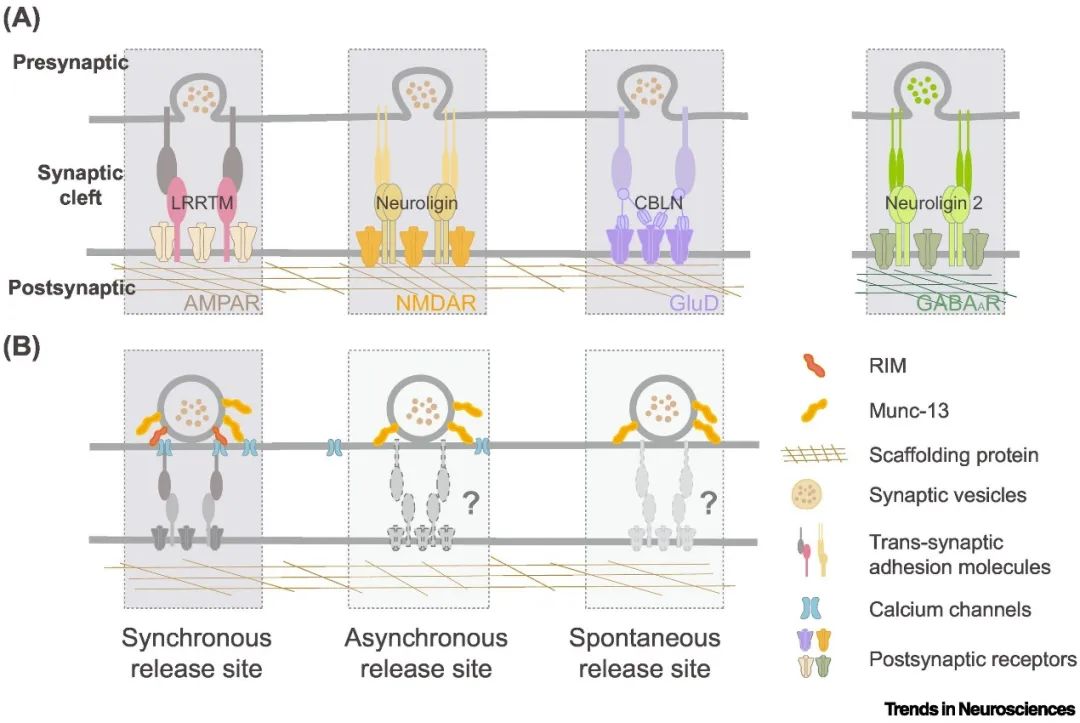
▲图1. 跨突触纳米柱概述
纳米柱:突触信号传递的“模块化电路”
大量的电生理数据很早就催生了一个突触的模块化模型,认为,1)突触由多个几乎独立的功能模块组成;2)每个模块可以根据是否含有AMPAR而处于活跃或沉默状态。这一模型可以解释很多看似矛盾的突触传递量子化反应和长时程增强的数据,但长久以来缺乏直接的实验证据。纳米柱为这一模型提供了强有力的结构基础。由于AMPA受体需要毫摩尔级谷氨酸浓度才能完全激活,而突触间隙内的递质浓度梯度极陡峭,仅距离释放位点100纳米内的受体能有效开放,而更远的受体在有机会打开之前就会失敏。因此,突触内的每个纳米柱在功能上具有较强的独立性,可能构成上述模型中的功能模块。
由此,突触信号传递可类比为一个“量子模块的并联电路”。每个纳米柱相当于电路中的一条独立支路,突触通过调节这些量子模块支路的数量(N)、导通概率(Pr)和电流强度(Q),实现对信号输出的精准控制。并联支路的数量N对应突触中独立的功能模块——当突触需要增强信号传递能力时(例如长时程增强),可通过激活原本“沉默”的纳米柱,如同在电路中新增一条支路,直接扩大信号通道的总容量。支路的导通概率Pr则由突触前递质释放的分子机器决定:例如RIM蛋白与钙通道在SSD的共定位,调控囊泡释放的同步性;而果蝇神经肌肉接头中ELKS/BRP纳米簇的扩增实验表明,这类分子组织的改变可直接提升Pr值,实现突触效能的稳态调节。支路的电流强度Q则取决于纳米柱内AMPAR的局部密度,证据显示,破坏Nlgn或LRRTM2可减少纳米柱内的受体密度,进而降低Q值。当然,这一类比仍需谨慎使用:突触传递的生化复杂性(如受体脱敏、非线性信号整合)远超简单电路模型,但纳米柱的发现无疑为理解突触的“量子化”调控提供了关键的结构蓝图。
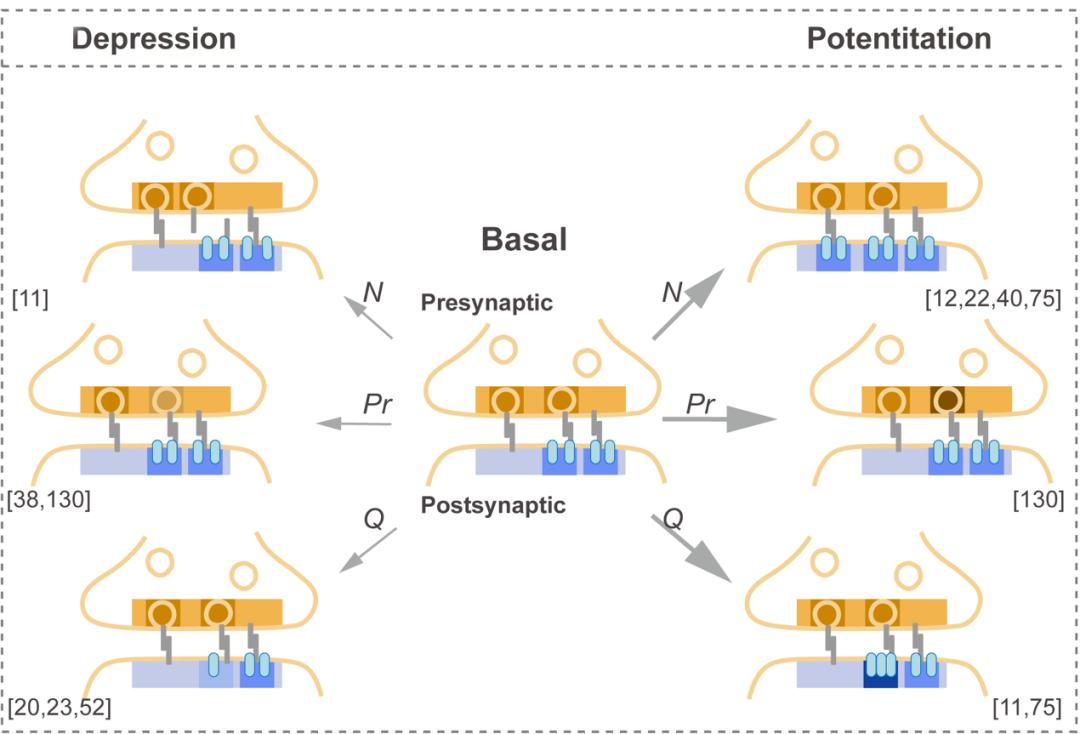
▲图2. 跨突触纳米柱重组对突触可塑性的影响
纳米柱重组与突触可塑性及病理
值得注意的是,这一“模块并联电路”并非静态——纳米柱的动态重组(如黏附分子介导的对齐度调整、相分离驱动的蛋白凝聚体形成)使突触能够像可编程电路一样,通过“参数重编程”灵活调节N、Pr、Q的组合,从而适应学习、记忆或病理状态下的功能需求(图2)。例如,化学诱导LTP可增强Bassoon与PSD-95 SSD的跨突触对齐,而长时程抑制(LTD)则导致纳米柱解离。在病理层面,阿尔茨海默病相关模型APP23小鼠的皮层中,PSD-95 SSD的均质化削弱纳米柱对齐,与认知衰退直接相关;癫痫模型中,神经元过度活动触发MMP-9依赖的Nlgn2切割,抑制性突触纳米柱解体,加剧兴奋-抑制失衡;缺血损伤后,GABAA受体纳米簇的快速分散导致抑制性突触功能削弱,促进兴奋毒性。这些发现提示,纳米柱的稳定性是维持脑功能正常运作的关键,而其动态失衡可能是多种神经疾病的共同通路。例如,亨廷顿病模型中,BDNF-TrkB信号通路缺陷导致AMPAR表面扩散增加,破坏其与PSD-95的纳米簇结合,进而损害海马依赖性记忆。这些研究为开发基于纳米柱稳定的治疗策略(如小分子增强黏附或相分离)提供了理论依据。
总结与未来展望
跨突触纳米柱的发现,如同为突触研究打开了一扇纳米级的全新“观察窗口”,仍有许多未解之谜有待进一步研究。未来,结合人工智能驱动的超分辨成像和活体动态追踪技术,科学家有望解析纳米柱在记忆形成或神经退行性疾病中的实时变化,为开发靶向纳米柱的新型疗法铺平道路。
本研究获科技部科技创新2030重大项目、中国科学院战略先导专项、国家自然科学基金等资助。中国科学技术大学博士后许娜与博士生陈思宇为共同第一作者,唐爱辉教授与许娜为共同通讯作者。

论文作者介绍

唐爱辉
教授
唐爱辉,中国科学技术大学生命科学与医学部、微尺度物质国家科学中心教授,合肥综合性国家科学中心人工智能研究院研究员,国家创新人才青年项目获得者。长期从事单分子超分辨显微成像技术的开发和在神经生物学领域的应用研究,目前实验主要有两大研究方向:1. 结合STORM、MINFLUX等单分子超分辨成像和遗传学、生理学及数字模拟等方法,解析突触精细结构和时空动态,研究突触传递和可塑性机制、及其异常导致病理的发生机理;2. 开发基于成像的高通量高分辨空间多组学技术,可在大组织切片上实现数千种基因转录本的亚细胞分辨率的精确解析。以通讯作者在包括Nature、Nature Methods、PNAS、Science Advances在内的著名期刊上发表论文多篇,承担国家自然科学基金委项目、科技部科技创新2030重大项目、科技部重大研究计划、中科院战略性先导科技专项等多项科研项目。实验室长期欢迎对前沿成像技术和神经生物学基本问题有兴趣和热情的研究生、博士后和副研加入!
相关论文信息
相关研究发表在Cell Press细胞出版社
旗下期刊Trends in Neurosciences
▌论文标题:
Tuning synapse strength by nanocolumn plasticity
▌论文网址:
https://www.sciencedirect.com/science/article/pii/S0166223624002534
▌DOI:
https://doi.org/10.1016/j.tins.2024.12.009
原标题:《中科大唐爱辉团队Trends in Neurosciences综述|突触强度的“分子密码”:跨突触纳米柱如何动态调控神经信号》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




