- +1
北京基因组研究所李玥莹:脂肪酸氧化对造血干细胞的影响因年龄和饮食而异
原创 Cell Press CellPress细胞科学

生命科学
Life science
作为世界领先的全科学领域学术出版社,细胞出版社特与“中国科学院青年创新促进会”合作开设“青促会述评”专栏,以期增进学术互动,促进国际交流。
2024年第二十期(总第178期)专栏文章,由中国科学院北京基因组研究所(国家生物信息中心)研究员李玥莹,就Cell Stem Cell中的论文发表述评。

长链脂肪酸氧化(fatty acid oxidation, FAO)在细胞代谢中发挥着至关重要的作用,尤其是在干细胞的维持、功能调控和分化过程中。其作用受到细胞类型和环境的显著影响。在造血干细胞(HSCs)中,FAO的作用呈现出双重性,具体表现为其依赖于氧化程度、细胞内代谢状态及外部环境因素。尽管已有实验表明脂肪酸氧化的丧失可能导致HSC的耗竭,但由于缺乏直接的代谢组学数据,脂肪酸氧化对HSC功能是否必需仍未能得出明确结论。
高脂饮食能够增加脂肪酸氧化,但同时也会引起激素调控和炎症反应的广泛变化。在某些组织中,高脂饮食能够增强干细胞的功能,而在其他组织中则可能抑制干细胞的功能。对于造血系统而言,高脂饮食对HSC功能和造血的影响与骨髓微环境、HSC转录调控、骨髓炎症反应以及HSC中的转化生长因子β(TGF-β)信号通路的变化密切相关。然而,高脂饮食对HSC代谢及功能的具体影响仍不完全明了。
2024年12月20日,来自美国德克萨斯大学西南医学中心(University of Texas Southwestern Medical Center)儿童医学研究所及儿科系(Children’s Research Institute and the Department of Pediatrics)的Sean J. Morrison 课题组在Cell Stem Cell杂志在线发表了题为“Different effects of fatty acid oxidation on hematopoietic stem cells based on age and diet”的研究论文。该研究结合了多种方法,包括:在造血谱系中特异性敲除FAO过程中的关键酶(CPT1a或HADHA),以及造血干细胞移植实验,并通过同位素追踪或代谢组学分析直接测量脂肪酸氧化,探讨FAO和高脂饮食对造血干细胞的影响。更为有趣的是,通过分别使用年轻和衰老小鼠,作者发现长链脂肪酸氧化对年轻小鼠和老年小鼠HSC的功能和影响存在显著差异:在年轻小鼠中,FAO对HSC功能并非必需,而在老年小鼠中,长链脂肪酸氧化则对正常的HSC功能和造血过程变得至关重要。此外,高脂饮食增加了脂肪酸氧化的水平进而损害了HSC功能。该研究证实,长链脂肪酸氧化对造血干细胞的作用不仅依赖于环境和饮食状态,而且HSC的代谢可塑性随着衰老过程的推进而下降。
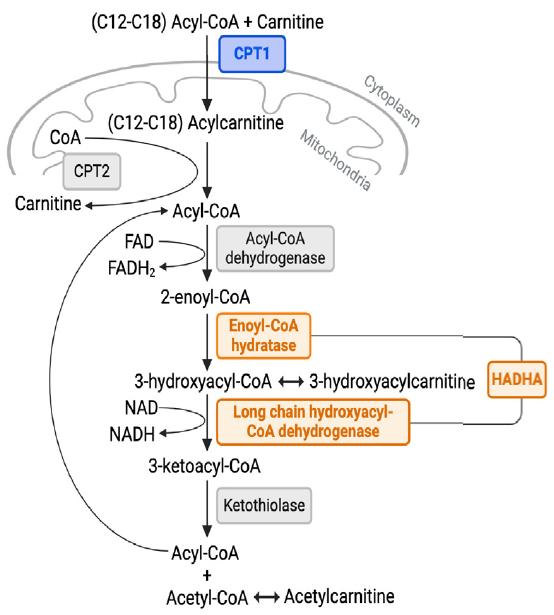
▲图1. 造血干细胞(HSC)和多能祖细胞(MPP)中存在活跃的长链脂肪酸氧化。
作者首先通过转录组分析发现,造血干细胞(HSC)和多能祖细胞(MPP)中广泛表达参与线粒体β-氧化的酶,且脂肪酸氧化在这些细胞中活跃。通过同位素追踪实验,发现脂肪酸氧化主要依赖于CPT1a和HADHA,缺失CPT1a或HADHA会显著降低HSCs/MPPs的脂肪酸氧化水平。代谢组学分析进一步证实了肉毒碱棕榈酰转移酶1a(CPT1a)和HADHA酶在脂肪酸氧化中的关键作用,同时表明HSC/MPP能够通过其他代谢途径弥补脂肪酸氧化减少对能量代谢的影响。此外,HSC/MPP具有较强的代谢可塑性,能够通过增加丙酮酸转化为乙酰辅酶A的生成来补偿因脂肪酸氧化减少而导致的乙酰辅酶A损失。
接着,作者通过使用造血特异性Cpt1a敲除小鼠模型的研究发现,CPT1a缺失并未显著影响年轻小鼠的造血干细胞功能和造血过程。然而,在老年小鼠中,长链脂肪酸氧化对于维持造血干细胞功能及正常造血至关重要。此外,高脂饮食通过增加骨髓造血干祖细胞的脂肪酸氧化水平,抑制了造血干细胞的重建潜力。然而,CPT1a或HADHA的缺失通过减少脂肪酸氧化,能够保护造血干细胞免受高脂饮食损害,并增强其重建潜力。
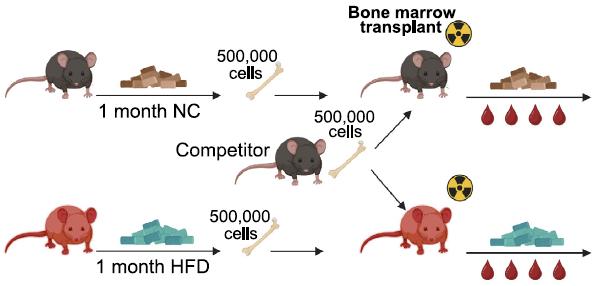
▲图2. 示意图:研究使用了正常饲料(NC)和高脂饲料(HFD)喂养的小鼠作为实验对象,进一步揭示了高脂饮食对HSC功能的影响。

▲图3. 图解总结:在幼年小鼠中,长链脂肪酸氧化对HSC功能(主要是自我更新和造血重建能力)并非必需;而在老年小鼠中,长链脂肪酸氧化对于维持正常的HSC功能和造血过程至关重要。此外,高脂饮食通过促进脂肪酸氧化,进一步损害了HSC的功能。
论文摘要
脂肪酸氧化在大多数干细胞中的作用尚不明确。本文通过14C-棕榈酸追踪和代谢组学分析发现,造血干/祖细胞(HSPCs)依赖CPT1a和HADHA酶进行长链脂肪酸的氧化。CPT1a或HADHA缺失对年轻小鼠HSPCs或造血功能的影响较小,这是因为年轻HSPCs具有较强的代谢可塑性,可以通过氧化其他底物(如谷氨酰胺)来弥补脂肪酸氧化的缺失,并通过降低丙酮酸脱氢酶的磷酸化来增强其功能。然而,随着衰老进程的推进,HSC的代谢可塑性下降,CPT1a或HADHA缺失会显著削弱老年HSC的造血功能。此外,高脂饮食通过增加脂肪酸氧化损害HSC功能,但CPT1a或HADHA缺失能够逆转这一效应,提示过度的脂肪酸氧化会破坏HSC功能。综上所述,本文揭示长链脂肪酸氧化对年轻HSCs并非必需,但对衰老HSCs至关重要,而高脂饮食通过增加脂肪酸氧化损伤HSC功能。
Fatty acid oxidation is of uncertain importance in most stem cells. We show by 14C-palmitate tracing and metabolomic analysis that hematopoietic stem/progenitor cells (HSPCs) engage in long-chain fatty acid oxidation that depends upon carnitine palmitoyltransferase 1a (CPT1a) and HADHA enzymes. CPT1a or HADHA deficiency had little or no effect on HSPCs or hematopoiesis in young adult mice. Young HSPCs had the plasticity to oxidize other substrates, including glutamine, and compensated for loss of fatty acid oxidation by decreasing pyruvate dehydrogenase phosphorylation, which should increase function. This metabolic plasticity declined as mice aged, when CPT1a or HADHA deficiency altered hematopoiesis and impaired hematopoietic stem cell (HSC) function upon serial transplantation. A high-fat diet increased fatty acid oxidation and reduced HSC function. This was rescued by CPT1a or HADHA deficiency, demonstrating that increased fatty acid oxidation can undermine HSC function. Long-chain fatty acid oxidation is thus dispensable in young HSCs but necessary during aging and deleterious with a high-fat diet.
向下滑动阅览摘要原文
中文内容仅供参考,请以英文原文为准
述评人简介

李玥莹
中国科学院北京基因组研究所(国家生物信息中心)研究员
中国科学院青年创新促进会优秀会员
liyy@big.ac.cn
李玥莹,医学博士,中国科学院北京基因组研究所(国家生物信息中心)研究员,博士生导师。中国科学院青年创新促进会优秀会员。主要从事造血系统巨核谱系发育及血小板疾病的研究,以第一/共同通讯作者发表文章于Immunity,Blood (2018,2021),Cell Research,J Thromb Haemost 等血液及干细胞国际权威杂志发表文章20篇以上,并授权/受理专利3项,成果获2019年度国际血液最佳研究成果奖;2021年度中国血液学十大研究进展;2023年北京市科学技术奖等。现担任Genomics, Proteomics & Bioinformatics杂志青年编委。
Li Yueying, M.D., is a professor at the Beijing Institute of Genomics, Chinese Academy of Sciences (National Center for Bioinformation), and a doctoral supervisor. She is an excellent member of the Youth Innovation Promotion Association of CAS. Her research primarily focuses on hematopoietic megakaryocyte lineage development and platelet-related diseases. Dr. Li and her team has published high-impact publications in journals such as Immunity, Blood (2018, 2021), Cell Research, and Journal of Thrombosis and Haemostasis. She holds one authorized invention patent and has applied for two additional patents. Her team's work has been recognized with prestigious awards, including the 2019 Best of ASH (American Society of Hematology), the 2021 Top Ten Research Advances in Chinese Hematology, and the 2023 Beijing Science and Technology Award. She also serves as a youth editor for Genomics, Proteomics & Bioinformatics.
向下滑动阅览英文简历
相关论文信息
原文刊载于CellPress细胞出版社
旗下期刊Cell Stem Cell上


中国科学院青年创新促进会(Youth Innovation Promotion Association,Chinese Academy of Sciences)于2011年6月成立,是中科院对青年科技人才进行综合培养的创新举措,旨在通过有效组织和支持,团结、凝聚全院的青年科技工作者,拓宽学术视野,促进相互交流和学科交叉,提升科研活动组织能力,培养造就新一代学术技术带头人。
Youth Innovation Promotion Association (YIPA) was founded in 2011 by the Chinese Academy of Science (CAS). It aims to provide support for excellent young scientists by promoting their academic vision and interdisciplinary research. YIPA has currently more than 4000 members from 109 institutions and across multiple disciplines, including Life Sciences, Earth Science, Chemistry& Material, Mathematics & Physics, and Engineering. They are organized in 6 discipline branches and 13 local branches.
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




