- +1
潜在分子靶点,浙江大学合作发文:发现恶性肿瘤靶向治疗新途径
原创 转网 转化医学网
【导读】原发性心脏血管肉瘤(PCAS)是一种罕见且具有侵袭性的心脏肿瘤,治疗选择有限,预后不佳。
12月10日,浙江大学与中国医科大学研究人员合作共同在期刊《Clinical and Translational Medicine》上发表了研究论文,题为“Investigating intra-tumoural heterogeneity and microenvironment diversity in primary cardiac angiosarcoma through single-cell RNA sequencing”,该研究揭示了PCAS肿瘤内异质性显著,这是由蛋白质合成、降解和RIG-I信号通路抑制等多种生物学过程驱动的。T细胞亚群分析显示,肿瘤微环境中存在耗竭的特异性抗原T细胞,这会降低免疫检查点阻断的疗效。此外,研究人员观察到抑制性巨噬细胞(SPP1+和OLR1+)和TME浸润细胞中线粒体基因MT-RNR2(MTRNR2L12)表达降低,这表明线粒体功能受损。本研究阐明了PCAS复杂的细胞学景观和免疫微环境,阐述了开发新型疗法的潜在分子靶点。

https://onlinelibrary.wiley.com/doi/full/10.1002/ctm2.70113
背景信息
01
原发性心脏血管肉瘤(PCAS)是一种快速进展的原发性心脏恶性肿瘤。它经常发生在心房,影响20-50岁之间的个体。PCAS占所有心脏肉瘤的约40%,是最常见和分化程度最高的心脏肉瘤形式。其预后不佳,在诊断后的总体生存期中位数为5-13个月。这种不良结果归因于肿瘤的侵袭性生物学行为、实现完全手术切除的复杂性,以及其对放疗和化疗的耐药。PCAS的治疗受到缺乏靶向疗法的限制。此外,它很少见,其病因和遗传学特征尚未充分阐明,这阻碍了有效治疗方法的开发。
之前的转录组测序和全基因组单核苷酸多态性分析已经揭示了PCAS驱动突变、调控异常和疾病亚型的关键信息。研究人员还观察到了KRAS、TP53和PLCG1等基因的体细胞突变。然而,传统的大规模分析方法无法区分不同类型的细胞,从而掩盖了肿瘤内和肿瘤间异质性的细微差别。
单细胞RNA测序(scRNA-seq)通过揭示单个细胞的基因表达谱,克服了这些限制,从而促进了新型细胞亚型的识别。它可以精细地绘制细胞组分及其在免疫微环境中的分布,分析外源性因素对肿瘤微环境的影响,阐明免疫细胞在微环境中的进化动态,揭示肿瘤抑制环境的分子基础,并揭示新的治疗靶点和预后指标。
心脏血管肉瘤微环境中的T细胞会耗竭其分化能力
02
为了系统地探索肿瘤组织中T细胞的状态,研究人员使用UMAP降维分析将T细胞重新分为七个亚群。由于正常心脏组织中存在较高的基础干扰素(IFN)-I表达水平,除了富集在正常组中的IFN-I激活的T细胞(IFN-I T亚群)外,其他类型的T细胞亚群和未成熟T细胞,都富集在肿瘤组中,这表明复杂的微环境导致T细胞的多样性。由于不同患者的微环境存在显著差异,每个患者特异性富集的T细胞亚群导致大多数T细胞亚群在两组之间没有明显的差异,这表明不同的肿瘤微环境导致特定的T细胞亚群分化。
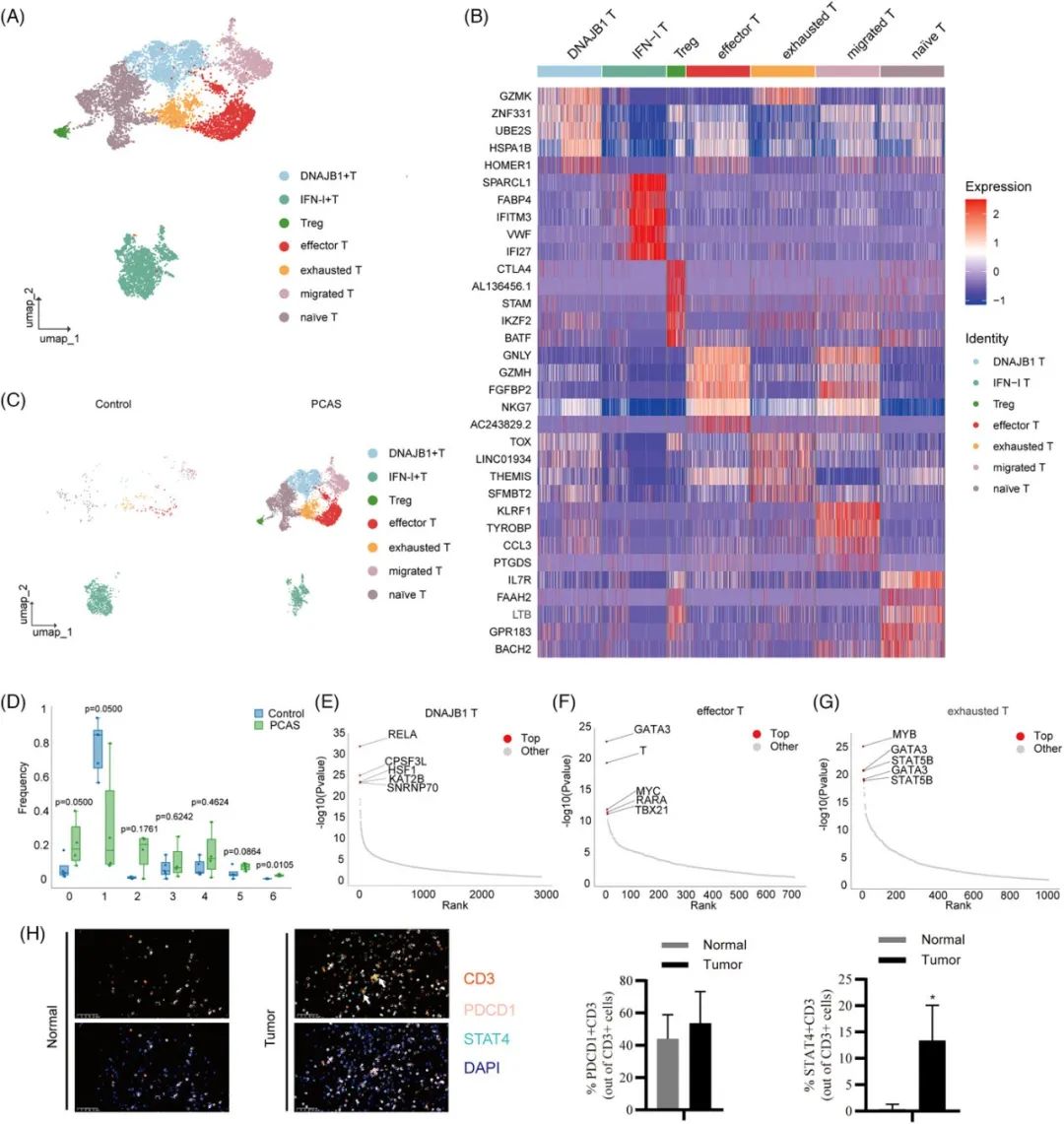
T细胞的景观
此外,研究人员对DNAJB1 T细胞、效应T细胞和耗竭T细胞进行了SCENIC分析。RELA、HSF1和KAT2B在DNAJB1 T细胞中被激活。GATA3、TBX21和MYC在效应T细胞中被激活。免疫荧光染色也显示,肿瘤浸润T细胞中的JAK-STAT1通路被激活(高STAT4+),而PDCD1+比例差异无统计学意义。MYB、GATA3和STAT5B也在耗竭T细胞中被激活。此外,包括凋亡和TCR途径在内的耗竭T细胞途径被富集,这表明这种类型的T细胞存在慢性持续的TCR激活。最后,研究人员比较了肿瘤和正常组织中T细胞亚群的差异表达。
心脏肉瘤微环境的髓系亚群分析
03
由于在肉瘤组中,髓源细胞构成了免疫细胞的大部分,因此研究人员使用UMAP降维分析对髓系细胞亚群进行了进一步的聚类分析。研究人员识别出10个亚群:C1Q+巨噬细胞、SPP1+巨噬细胞、IFN-I +巨噬细胞、OLR1+巨噬细胞、CD1c+树突状细胞(DC)、CLEC9A+树突状细胞(DC)和pDC。正如预期的那样,PCAS组中这两种细胞类型和数量均增加。SPP1+和OLR1巨噬细胞是促进肿瘤进展的抑制性免疫细胞。
分析显示,SPP1+巨噬细胞是分化程度较低的细胞亚群,而OLR1+巨噬细胞是分化程度较高的细胞亚群,这表明肿瘤微环境也会诱导成熟的巨噬细胞表型转移。值得注意的是,三种类型的巨噬细胞都高度激活了促炎转录因子(SPI1、CEBPB和GATA3)。
差异表达分析显示,RPLs、S100As、CDC42EP3、CXCL8和FCGR3B表达增加。然而,许多转录因子和酶,包括SMYD3、RREB1、RBPJ、BMP2K、CBLB、TMEM51和RNF150,表达下调。尤其是,在分化后,包括RASA1、RASAL2、NCKAP5、MACF1和ARHGAP24在内的细胞骨架蛋白减少。最后,研究人员通过免疫组织化学染色证明,在血管肉瘤组织中,OLR1+和SPP1+巨噬细胞增多。此外,研究人员计算了在接受帕唑帕尼治疗的肉瘤中,耗竭T细胞(ex_T)、OLR1+巨噬细胞(OLR1 + MC)和SPP1+巨噬细胞(SPP1 + MC)的浸润分数(infiltration score)。令人意外的是,这三个细胞簇在响应组和非响应组之间的差异并不显著。然而,这三个簇在响应组中呈现下降趋势。相关性分析表明,SPP1+巨噬细胞与耗竭T细胞(ex_T)之间存在强相关性。这些基于公开的血管肉瘤数据的分析,在一定程度上验证了研究人员对心脏血管肉瘤的研究分析。
结论
04
本研究结果显示,PCAS的免疫微环境与其他实体瘤相似,其特征是T细胞耗竭和免疫抑制的髓系细胞的高发生率。尤其是,研究人员在PCAS环境中观察到免疫细胞中MTRNR2L12表达显著下调,这表明存在独特的线粒体功能障碍。这种线粒体功能障碍可能是心脏肉瘤微环境的独特特征,强调了这一恶性肿瘤特异性治疗靶点的潜力。
【参考资料】
https://onlinelibrary.wiley.com/doi/full/10.1002/ctm2.70113

本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




