- +1
Cancer Cell:曹雪涛团队利用CRISPR筛选,发现克服乳腺癌免疫治疗耐药新靶点
原创 生物世界 生物世界
撰文丨王聪
编辑丨王多鱼
排版丨水成文
免疫检查点阻断(ICB)疗法显著改善了恶性肿瘤患者的预后。然而,大多数癌症患者却几乎不能从ICB治疗中获益。破译ICB耐药机制,特别是肿瘤细胞内在因子介导的免疫逃逸,将有助于提高ICB疗效。
ICB治疗耐药是由多种因素导致的,包括特定肿瘤基因突变、肿瘤抗原下调、免疫抑制分子以及肿瘤微环境(TME)等。许多研究人员致力于探索肿瘤免疫逃逸机制,克服对现有免疫疗法的耐药,以及开发新的肿瘤免疫疗法。
三阴性乳腺癌(TNBC)是最具侵袭性的乳腺癌亚型,复发率高,预后差。此外,TNBC是一种异质性疾病,对免疫治疗通常无反应。TNBC对免疫治疗耐药的机制复杂,包括抗原呈递受损导致的低免疫原性和免疫抑制分子升高(例如PD-L1)。
靶向肿瘤内在因子增强肿瘤免疫原性,重编程肿瘤微环境(TME),尤其是CD8+T细胞,使“冷”肿瘤变为“热”肿瘤,是克服TNBC免疫治疗耐药的理想策略。但关于提高TNBC肿瘤细胞免疫原性的研究仍然有限,为了协同免疫治疗,有必要揭示增加肿瘤免疫原性的新的肿瘤内在因素。
2024年12月12日,曹雪涛院士团队在 Cancer Cell 期刊发表了题为:Inhibiting intracellular CD28 in cancer cells enhances antitumor immunity and overcomes anti-PD-1 resistance via targeting PD-L1 的研究论文。
该研究通过在三阴性乳腺癌(TNBC)小鼠模型中进行的体内全基因组CRISPR筛选,发现癌细胞内CD28可直接与Cd274 mRNA结合,招募剪接因子SNRPB2以增强Cd274 mRNA稳定性,促进肿瘤细胞PD-L1表达,进而实现肿瘤免疫逃逸,靶向抑制瘤细胞内CD28能够克服对PD-1抗体治疗的耐药性。
这些结果表明,抑制肿瘤细胞胞内CD28,能够通过靶向PD-L1增强抗肿瘤免疫并克服抗PD-1耐药,为改善乳腺癌免疫治疗提供了一条潜在新途径。

体内全基因组CRISPR筛选已经发现了多种癌症中调节耐药性或免疫治疗敏感性的靶点。例如,体内基因筛选揭示了黑色素瘤细胞中的Ptpn2基因缺失可通过增强抗原呈递使肿瘤对PD-1抑制剂敏感。因此,体内全基因组CRISPR筛选可以识别新靶点,以提高免疫治疗效率。
T细胞活化需要两个信号:T细胞受体(TCR)识别抗原呈递细胞(APC)上负载多肽的MHC分子,以及共刺激信号。
CD28是一种经典的共刺激分子,组成性表达于小鼠T细胞、约80%的人CD4+T细胞和50%的人CD8+T细胞表面。CD28的常规功能是启动与B7配体结合后T细胞内的共刺激信号级联。CD28通常被认为维持T细胞的存活、增殖和向特定T细胞亚群分化。值得注意的是,CD28还通过翻译后修饰和表观遗传改变调节T细胞的分化和功能。
然而,CD28在非T细胞免疫细胞、间质细胞甚至肿瘤细胞中的潜在作用尚不清楚。
在这项最新研究中,研究团队在三阴性乳腺癌(TNBC)小鼠模型中进行了体内全基因组CRISPR筛选,发现癌细胞内的CD28通过招募SNRPB2来促进Cd274 mRNA的稳定性,从而上调PD-L1的表达。敲低肿瘤细胞中Cd28可激活抗肿瘤CD8+T细胞,抑制肿瘤生长,并克服抗PD-1耐药。
具体来说,该研究在三阴性乳腺癌(TNBC)小鼠模型中进行了体内全基因组CRISPR功能缺失筛选,发现了Cd28在肿瘤细胞中促进免疫逃逸的非经典功能。在肿瘤细胞中敲除Cd28增加了I型常规树突状细胞(cDC1)和活化的肿瘤特异性CD8+T细胞的浸润,在体内,药理学诱导的Cd28敲低抑制了预先建立的肿瘤生长,克服了抗PD-1的耐药性。此外,TNBC组织中CD28高表达与PD-L1表达升高、CD8+T细胞浸润减少及不良预后相关。
从机制上来说,肿瘤细胞内的CD28可以直接与Cd274 mRNA结合,招募剪接因子SNRPB2进入细胞核以稳定Cd274 mRNA,进而促进肿瘤细胞的PD-L1表达并实现肿瘤免疫逃逸。
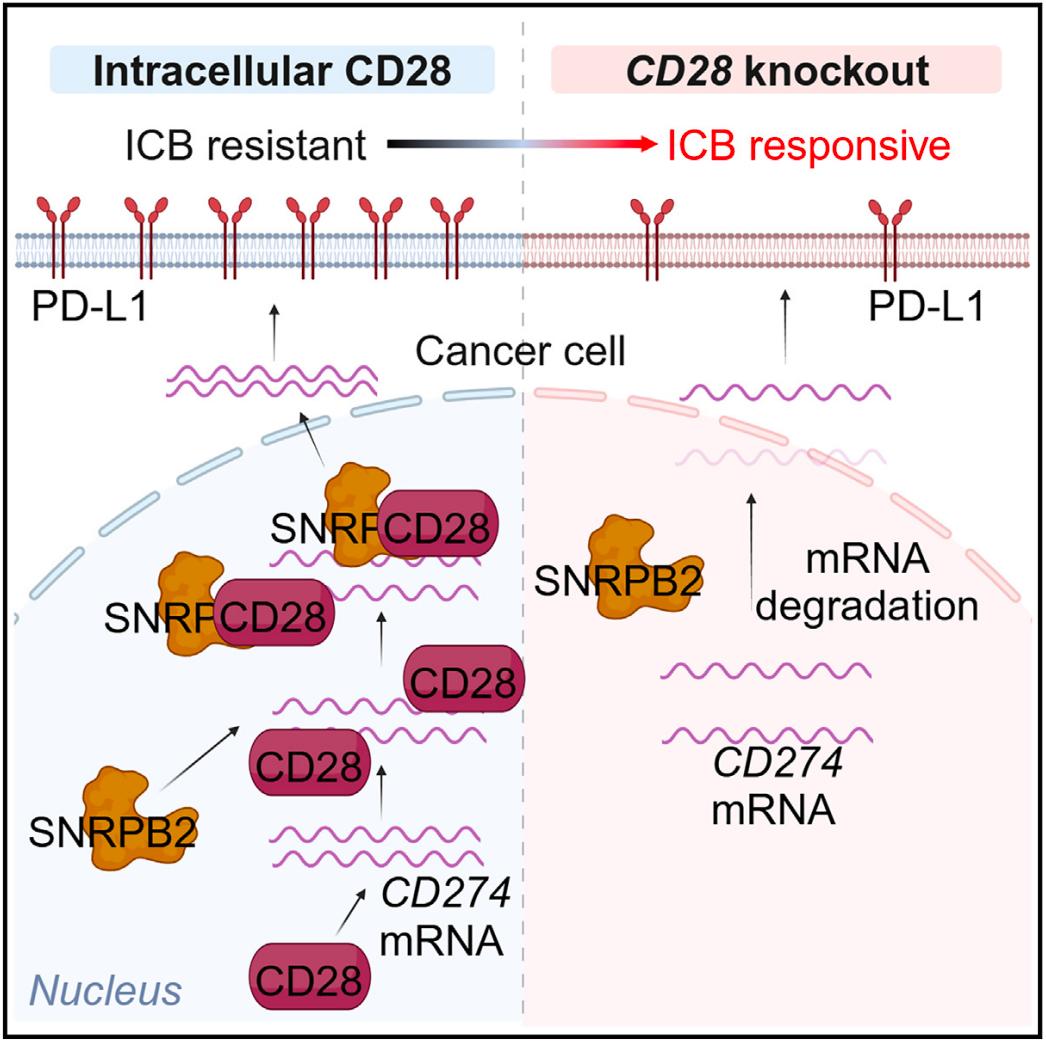
因此,干扰肿瘤细胞CD28介导的免疫逃逸,为改善乳腺癌免疫治疗提供了一条潜在新途径。
论文链接:
https://www.cell.com/cancer-cell/abstract/S1535-6108(24)00443-4

本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




