- +1
中国药科大学最新Science:揭开脱氨酶介导的CRISPR-Cas核酸免疫新机制
编辑丨王多鱼
排版丨水成文
CRISPR-Cas系统是原核生物中广泛存在的一种由RNA引导靶向外源遗传物质的核酸免疫系统。基于II型CRISPR-Cas9的基因编辑技术,获得2020年诺贝尔化学奖,并在生物医药等诸多领域产生了革命性的影响。而III型CRISPR-Cas系统是目前发现的所有CRISPR-Cas系统中最复杂的一类系统,阐明其作用机制具有重要的科学意义和潜在的应用价值。
2024年12月12日,中国药科大学肖易倍/陈美容/陆美玲团队在 Science 期刊发表了题为:Antiviral signaling of a type III CRISPR-associated deaminase 的研究论文【1】。
该研究阐明了III型CRISPR系统通过生成环化腺苷第二信使激活下游效应脱氨酶来耗竭ATP,从而实现免疫的分子机制。该团队前期通过生物信息学分析挖掘到一类III型CRISPR-Cas下游缺失了广泛分布的核酸酶模块,取而代之的是一个融合了第二信使识别结构域的脱氨酶CAAD(CRISPR-Cas-associated adenosine deaminase),以及一个可能降解核苷的水解酶NH(Nudix Hydrolase)。表明该类系统的作用机制可能完全不同于已知的通过切割核酸实现免疫的CRISPR-Cas系统。鉴于合成环化核苷酸第二信使和腺苷脱氨分别在人源核酸免疫系统cGAS-STING和ADAR中存在,研究团队大胆推测这类系统很可能是通过核苷酸代谢来实现其免疫效应。
通过体外重组,团队首先成功纯化得到了该系统中负责识别外源核酸的Cmr复合物。接下来利用MALDI-TOF技术证明该效应复合物通过互补配对识别外源核酸后,会利用ATP生成cA3/cA4/cA6三种环化腺苷,这三种环化腺苷也可能作为第二信使激活下游的效应蛋白。为了确认第二信使,该团队测定了不同环化腺苷对CAAD脱氨酶的亲和力,发现cA4和cA6均与CAAD有着极高的亲和力,而cA3几乎不会和CAAD结合。虽然之前报道过某些III型CRISPR-Cas的下游效应蛋白可以结合两种不同的环化腺苷,但往往只有一种特定的环化腺苷能激动其活性。出乎意料的是,生化分析表明在该系统中,cA4和cA6均能高效激活CAAD的脱氨酶活性,并特异性地将ATP转化成ITP。ITP的蓄积往往会导致较强的细胞毒性,进一步的生化实验证明CAAD下游的NH酶可特异性地将ITP降解成IMP,发挥解毒功能。该团队接下来通过体内实验验证了该类III型CRISPR-Cas系统在Cmr复合物以及CAAD-NH的协同作用下,可以抑制被外源核酸侵扰细菌的生长,达到群体免疫的作用。
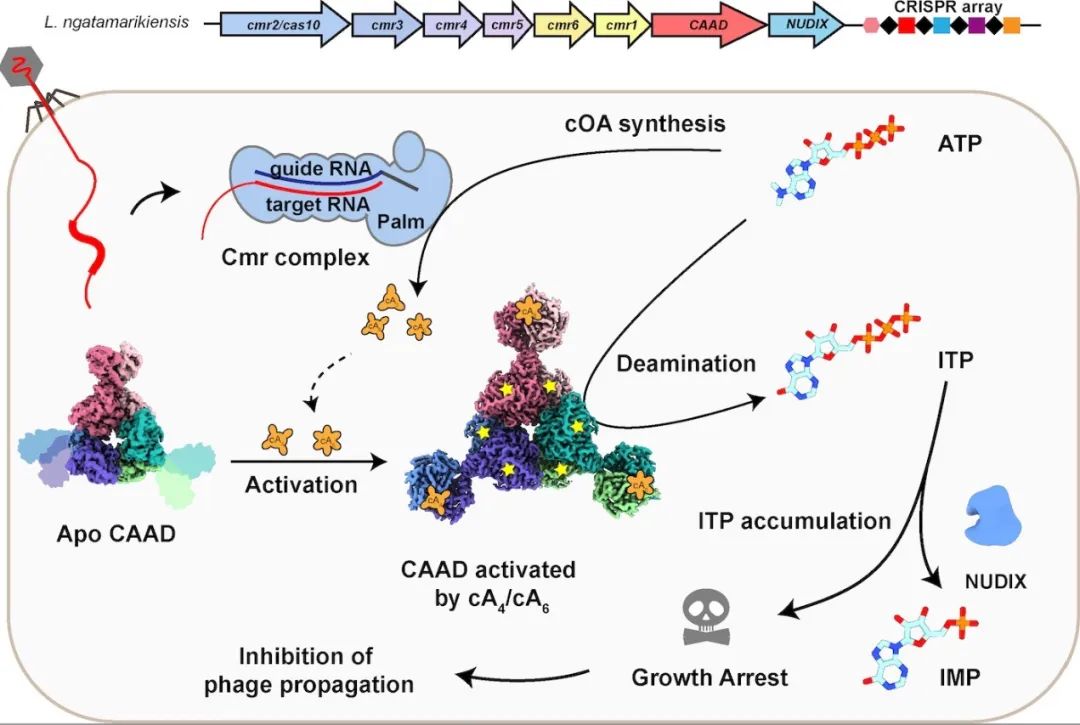
为了进一步解释CAAD被第二信使的激活机制,研究团队利用冷冻电镜技术捕捉到了CAAD从无活性到被激活过程中一系列的高分辨率三维结构,直接观察到并证实了其激活过程中存在协同效应。CAAD由N端的CARF结构域和C端的脱氨酶结构域组成,依靠其互作界面形成一个由三个CAAD二聚体组成的六聚体复合物。当CARF未结合第二信使时,该结构域呈现出高度柔性可变状态。一旦CARF结合环化腺苷后,会发生60°旋转,让整个六聚体结构更紧凑的同时带动脱氨酶结构域产生一系列构象变化,最终激活脱氨酶活性中心。
近期,美国洛克菲勒大学 Luciano A. Marraffini 和纪念斯隆·凯特琳癌症中心 Dinshaw J. Patel 团队合作在 Cell 期刊发表的题为:The CRISPR-associated adenosine deaminase Cad1 converts ATP to ITP to provide antiviral immunity 的论文中也发现了cA4和cA6均会激活腺苷脱氨酶活性,通过耗竭ATP并诱导ITP的蓄积来抑制细菌生长【2】。但该研究并未捕获到cA6识别的状态,也未能解释ATP脱氨酶活性激活的分子机制以及ITP如何被进一步代谢。

但上述问题均在这篇 Science 论文中得到了详细阐明。
总体而言,该研究发现了CRISPR核酸免疫系统中一条全新的核苷代谢-免疫调控-抗病毒通路,拓展了对III型CRISPR系统抗病毒免疫的机制的理解和认识。对效应蛋白CAAD脱氨酶作用机制的阐明为改造利用该免疫机制奠定了理论基础。
中国药科大学肖易倍、陈美容、陆美玲为该论文的通讯作者。中国药科大学博士研究生李钰涛、博士后李兆星、硕士研究生闫朴睿、华晨扬、孔健平为该论文的共同第一作者。新加坡国立大学胡纯一教授、中国药科大学陈依军教授、杨鹏教授、纪顺利教授、赵玉成教授、湖南中医药大学李顺祥教授、南京财经大学李光磊博士对本课题做出重要贡献。中国药科大学硕士研究生吴宛倩和崔钰瑢,湖南中医药大学博士研究生段彦亦参与了该研究。
论文链接:
1. https://www.science.org/doi/10.1126/science.adr0393
2. https://www.cell.com/cell/fulltext/S0092-8674(24)01150-4
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




