- +1
前沿透视 | Cell: 卵巢癌细胞来源的IL-4促进免疫抑制和免疫治疗抵抗
编者按
“前沿透视”栏目聚焦新近最具影响力的医学科研成果,解读前沿突破,分享核心观点,旨在为广大科研工作者洞悉学术新知,激发创新思维提供新视角。
卵巢癌是致死率最高的癌症之一,其5年生存率小于50%。尽管免疫疗法,特别是靶向PD-1/PD-L1信号传导的免疫检查点阻断(ICB),已经在许多癌症发现有效,但在卵巢癌中,ICB临床获益有限,客观缓解率小于10%。卵巢癌对免疫治疗的抗性一方面是由于受到巨噬细胞主导的免疫抑制性肿瘤微环境(TME)的影响;另一方面可能是由于存在肿瘤内异质性(ITH),而关于肿瘤内异质性人们还知之甚少。2024年10月30日,来自美国西奈山伊坎医学院的Brian D. Brown和Alessia Baccarini研究团队在Cell上发表题为“Ovarian cancer-derived IL-4 promotes immunotherapy resistance”的文章,用空间功能基因组筛选技术(Perturb-map)重现了肿瘤内异质性,揭示了卵巢癌中存在可产生IL-4的克隆,通过调控巨噬细胞促进免疫抑制性从而产生对抗PD-1治疗的抵抗,并证明了靶向IL-4信号传导可增强卵巢癌对免疫治疗的疗效。
01
Perturb-map重现了肿瘤内异质性克隆环境并筛选出影响肿瘤生长的关键基因
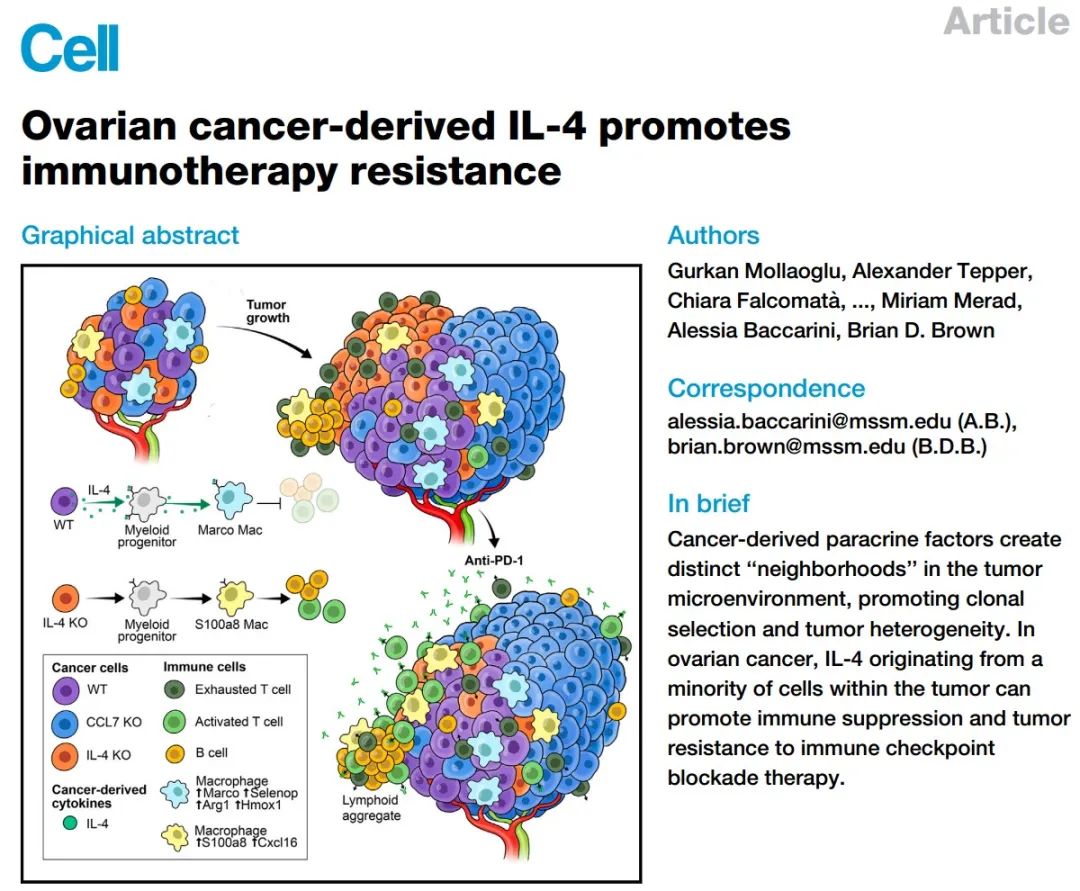
Perturb-map技术首见于该团队2022年3月14日发表在Cell上题为“Spatial CRISPR genomics identifies regulators of the tumor microenvironment”的文章,该技术结合了单载玻片上的多重免疫组织化学连续染色(MICSSS)或多重离子束成像仪(MIBI)成像,可筛选调控免疫编辑和肿瘤架构的关键基因。在这篇文章中,研究人员重点关注癌细胞和巨噬细胞之间34个主要通讯分子,利用该技术构建靶向这34个基因的Pro-Code/CRISPR文库,将文库导入小鼠卵巢癌ID8细胞中,然后通过腹腔注射将这些细胞移植到小鼠体内构建播散性人类卵巢癌模型,30天后从腹腔收集带有肿瘤的组织进行多重成像。DepMap数据显示靶向这些基因并不影响细胞的内在活性,而通过比较不同基因敲除相对于对照组的肿瘤细胞和病灶数量,发现Plaur、Mif和Serpine1的缺失导致了肿瘤细胞在体内活性的大幅下降,且主要以散发的细胞形式存在,无法形成结构良好、紧密结合的肿瘤结节。与此相反,Ccl3、Calr和Ccl7敲除组细胞和肿瘤显著富集。Mif、Ccl3和Ccl7缺失对肿瘤生长的影响显著是因为这三个基因都是分泌的并在细胞外发挥作用,但异质性克隆环境并不能弥补这些因子的缺失。
Plaur编码尿激酶型纤溶酶原激活剂受体(uPAR),是一个糖脂锚定的细胞表面蛋白,与尿激酶型纤溶酶原激活物(uPA)结合后激活纤溶酶原,产生纤溶酶,参与细胞外基质降解、细胞迁移粘附侵袭,血管生成等通路,因此对肿瘤细胞体内生长至关重要。Plaur敲除后不影响ID8细胞体外生长活性,但将等量Plaur敲除和对照敲除的ID8细胞混合后腹腔注射或皮下注射到免疫功能正常或缺陷的小鼠进行实验,都使得混合肿瘤中Plaur敲除的细胞都很少,仅散在分布不形成瘤体。
控制卵巢癌生长的受体-配体基因的扰动图筛选
02
CCL7的缺失通过构建免疫排斥和内皮细胞减少的TME促进卵巢癌的生长
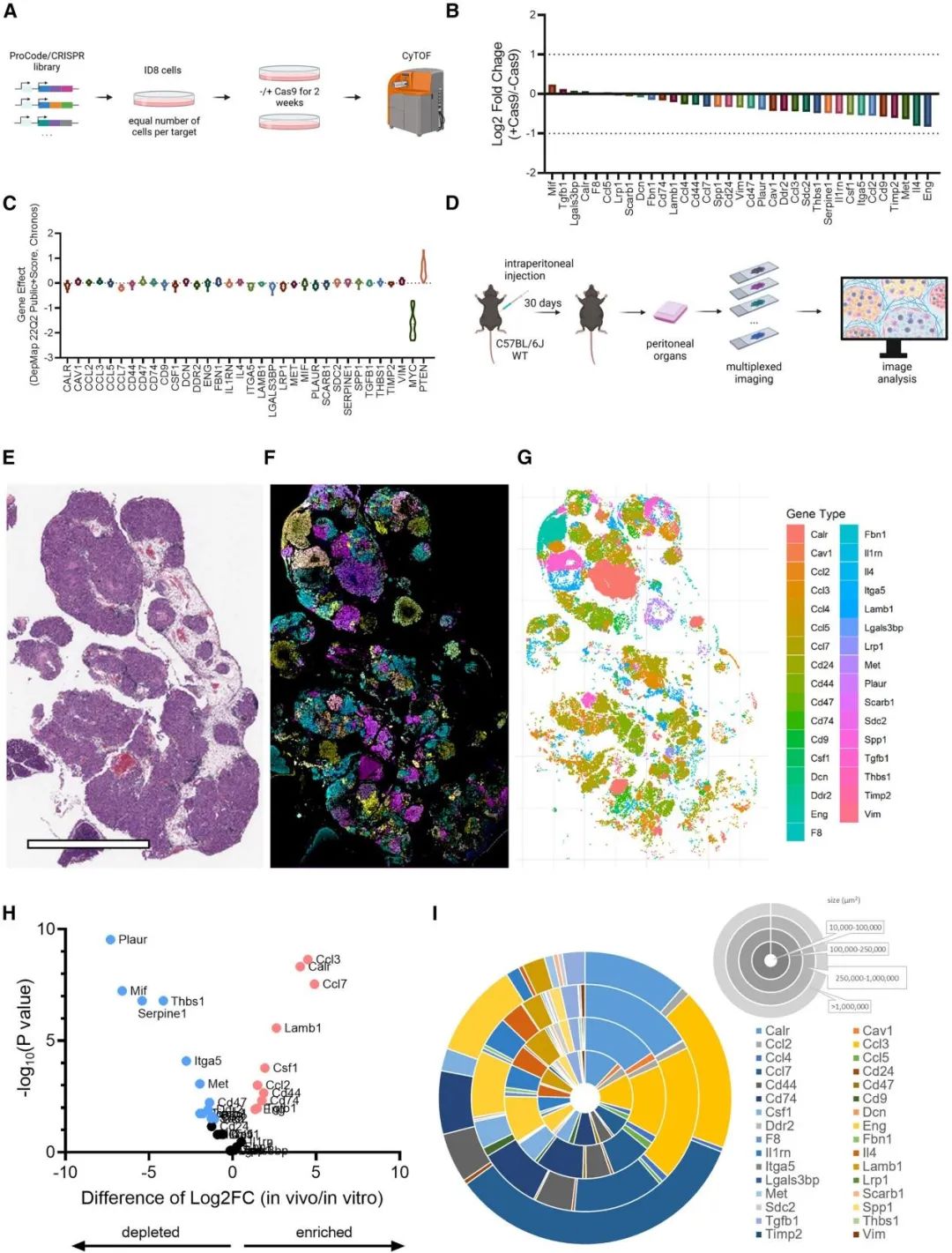
该研究发现ID8细胞中Ccl7敲除组是Perturb-map分析中富集程度最高的克隆,这表明趋化因子 CCL7促进了肿瘤的生长。TCGA数据显示,CCL7在正常卵巢组织很少表达,而在大多数人类卵巢癌样本中有表达。然而,随着肿瘤分期的增加CCL7的表达降低;根据CCL7表达水平对患者进行分组,较低的CCL7也预示着更差的预后,与小鼠实验中Ccl7敲除ID8细胞更具侵袭性一致。循环免疫荧光 (CyCIF)多重蛋白质成像和MICSSS均显示Ccl7敲除组和对照敲除组肿瘤之间的TME存在显著差异,Ccl7敲除组的肿瘤表现出免疫浸润的大幅减少。Ccl7敲除组中的CD4和CD8 T细胞总数显著减少,特别是颗粒酶B+穿孔素+细胞毒性T细胞(GZMB+PRF+CD8+ CTL);此外,树突状细胞(DC)也减少。Ccl7敲除组肿瘤中的巨噬细胞Ccl7和Ccl2的表达水平也下调,表明肿瘤衍生的Ccl7促进了巨噬细胞Ccl7和Ccl2扩增的前馈机制。此外,发现Ccl7敲除组的肿瘤中,肿瘤细胞与T细胞、B细胞以及DC细胞之间的距离显著增加。TCGA人类卵巢癌数据显示,CCL7水平与T细胞(包括CTL)、巨噬细胞以及内皮细胞的浸润呈正相关。
癌细胞产生的CCL7控制免疫和基质细胞向肿瘤的募集
03
CCL7的缺失在异质性肿瘤中形成空间上不同的免疫邻域且不被补偿
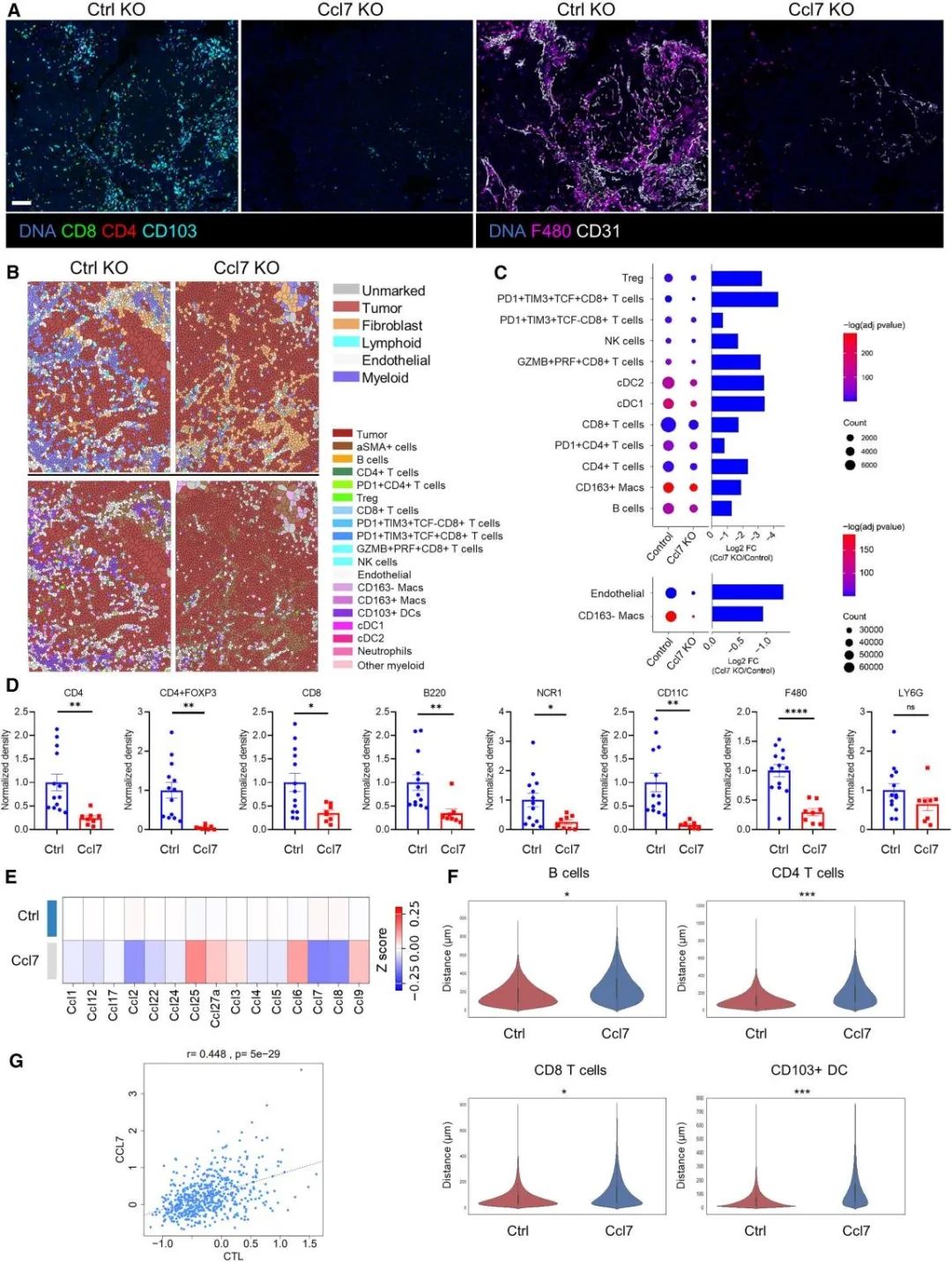
不同基因敲除的卵巢癌细胞形成克隆距离很近,那附近的Ccl7野生型克隆是否会产生足够的CCL7通过旁分泌募集免疫细胞进入Ccl7敲除的肿瘤呢?通过给小鼠注射了50%:50%或80%:20%比例的对照敲除:Ccl7敲除的ID8混合细胞,4周后评估两种肿瘤细胞相对瘤荷,该研究发现Ccl7敲除ID8细胞均获得绝对生长优势,而不会受到附近对照肿瘤克隆产生的Ccl7的抑制,而且其中浸润的巨噬细胞、内皮细胞、CD4和CD8 T细胞、B细胞和CD11c+细胞都显著减少。
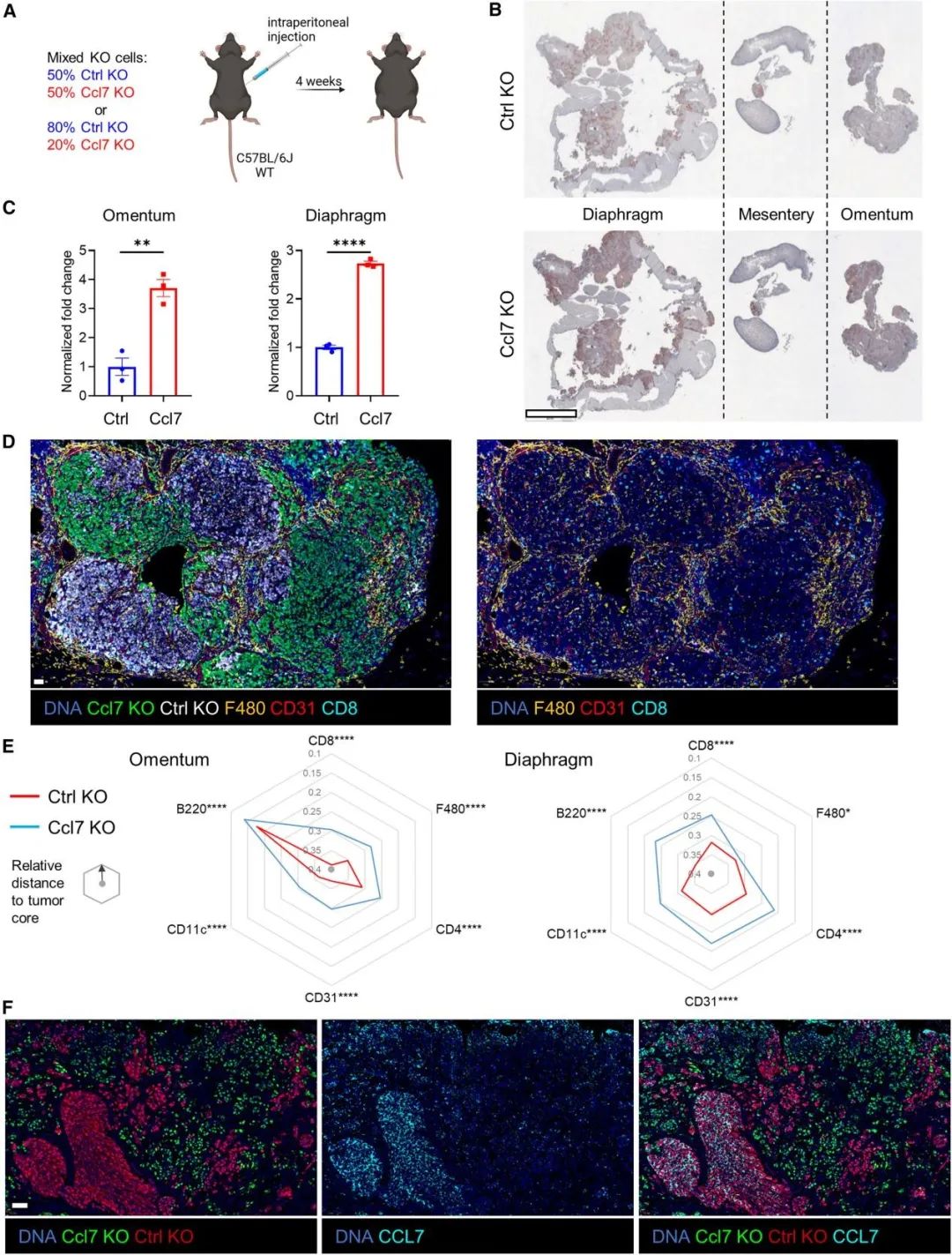
Ccl7缺失促肿瘤生长且不被周围表达Ccl7的肿瘤细胞所补偿
04
促进卵巢癌对抗PD-1疗法抵抗的IL-4来源于卵巢癌细胞
为了确定所选受体/配体基因是否可能与较差的ICB反应有关,同前构建小鼠多种基因敲除ID8细胞腹腔荷瘤模型,并在17天后开始用抗PD-1 治疗,30天后收集肿瘤组织进行检测,发现Ccl7敲除克隆仍最富集,表明Ccl7缺失促进了对抗PD-1的耐药性,这与该克隆中T细胞减少相一致。其他基因敲除在未治疗和抗PD-1治疗的小鼠之间没有显著变化,但Il-4敲除细胞显著减少,表明Il-4的缺失虽然本身不影响肿瘤生长,但会增加肿瘤对抗PD-1治疗的敏感性,具有治疗靶向潜力。小鼠实验进一步证明抗PD-1治疗可降低Il4敲除肿瘤的生长,延长小鼠生存时间,同时也证明肿瘤细胞产生的Il-4促进了卵巢癌对抗PD-1疗法的抵抗。
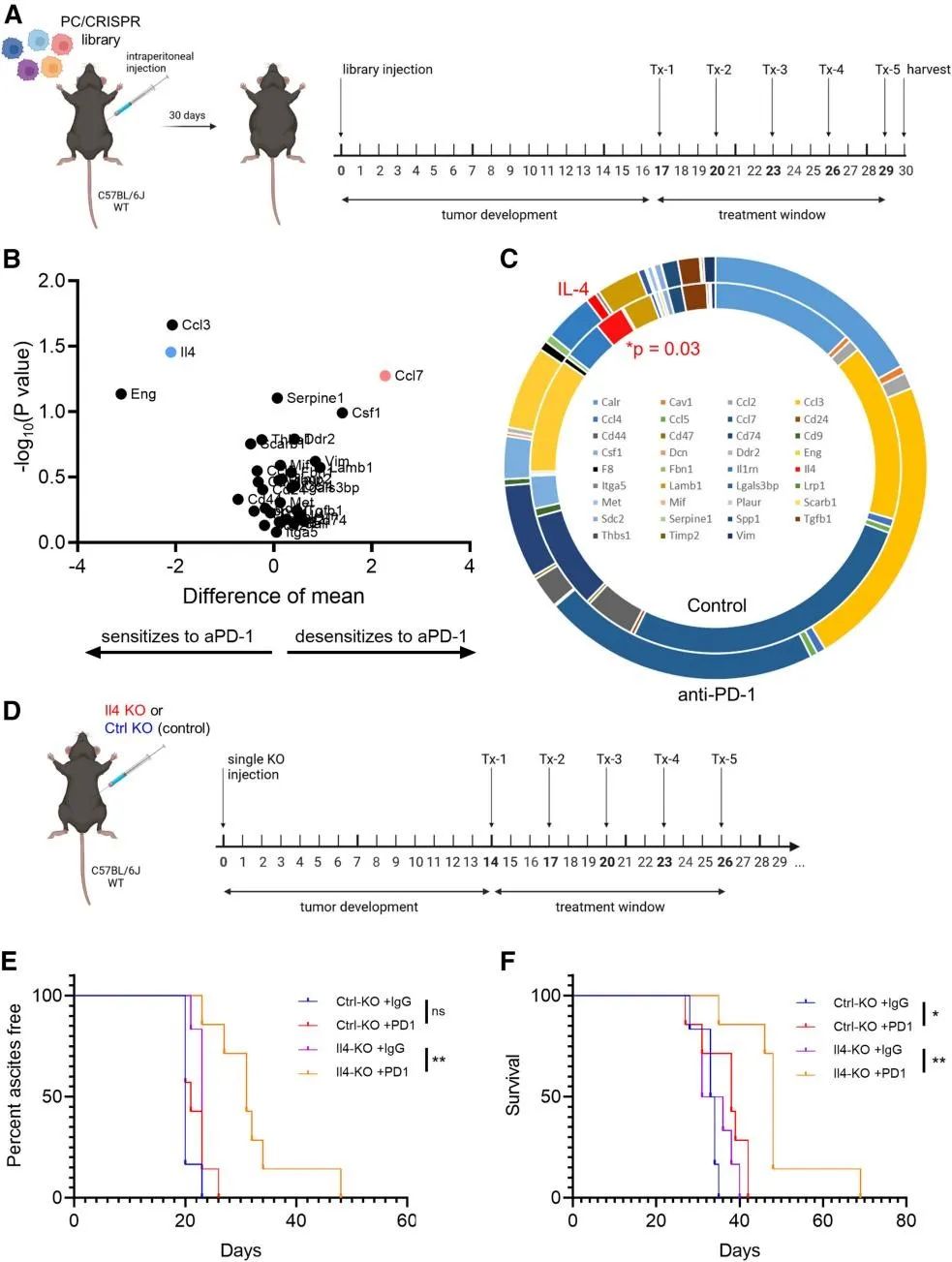
在克隆异质性肿瘤中IL-4促进对抗PD-1治疗的耐药性
既往通常认为IL-4 主要由非肿瘤细胞,如Th2 细胞、嗜碱性粒细胞、嗜酸性粒细胞和肥大细胞产生。以往研究发现卵巢癌患者腹水中IL-4水平越高,临床预后越差,但由于测序无法有效检测Il4的转录本,肿瘤中IL-4的细胞来源尚不明确。本文通过多种定量方法确认Il-4基因在ID8细胞表达,且肿瘤内癌细胞的IL-4产生并不均匀,只局限于一小部分癌细胞。此外,因为ID8肿瘤病灶主要以同型克隆的形式生长,所以IL-4的表达可能受到动态调节,在高局部浓度下可能对自身产生负反馈。进一步通过人类卵巢癌切片和人类卵巢癌空间转录组学数据等分析也发现大多数 IL-4来源于癌细胞。最后,研究者又通过研究表达IL-4的人类卵巢细胞OV90,找到了上游调控IL4表达的转录因子GATA6。
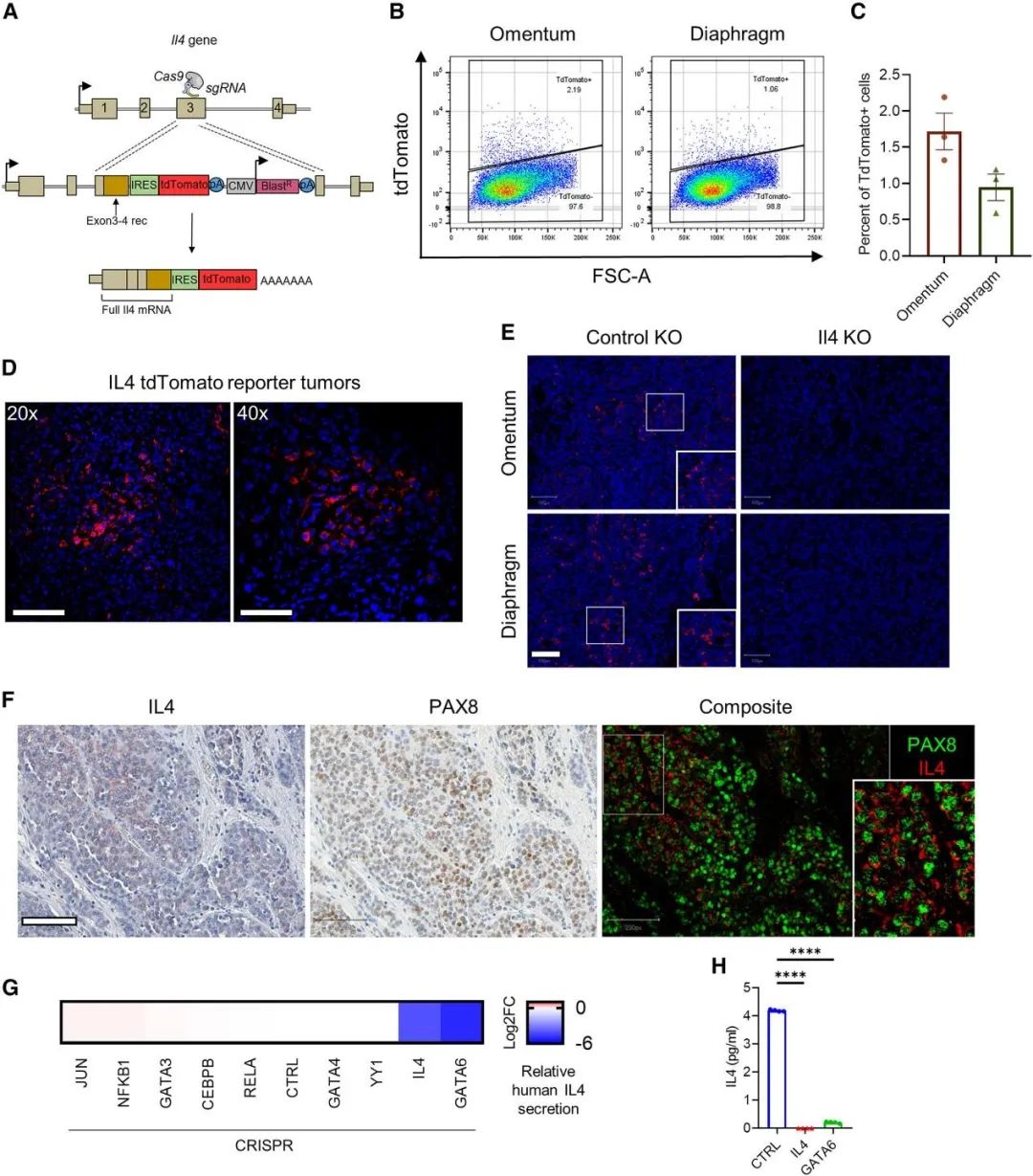
癌细胞是卵巢肿瘤中主要的IL-4产生者
05
肿瘤细胞产生的IL-4促进免疫抑制,而降低IL-4后淋巴细胞聚集使肿瘤对抗PD-1治疗更敏感
为了确定卵巢癌细胞衍生的IL-4的缺失如何影响局部TME,他们给小鼠注射了Il4敲除或对照敲除的ID8细胞,并用同种型抗体或抗PD-1治疗,收集肿瘤组织CyCIF成像显示两者TME显著不同。例如,Il4敲除组表现巨噬细胞的密度降低(包括CD163-和CD163+),但耗竭T细胞(PD-1+TIM3+CD8+ T细胞和PD1+CD4+ T 细胞)富集。单细胞转录组测序后发现Il4敲除肿瘤中免疫抑制巨噬细胞(Marco、Selenop高表达)减少。此外,IL-4诱导的基因也下调,例如Fcgr2b和Hmox1,它们已被证明有助于执行肿瘤巨噬细胞的免疫抑制活性。而大多数T细胞亚群,包括耗竭的CD8 T细胞,在Il4敲除肿瘤中富集,并出现富含B细胞和T细胞的淋巴细胞聚集,类似三级淋巴结构。IL-4的缺失导致总CD8 T细胞、PD1+CD4+T细胞和DC细胞的增加。在抗PD-1治疗后,Il4敲除肿瘤中的淋巴细胞聚集显示出所有CD8 T细胞亚群的显著富集,包括GZMB+PRF+CTLs。所以,尽管IL-4仅由一小部分卵巢癌细胞产生,但这种IL-4仍可以促进免疫抑制TME的形成,从而降低抗PD-1的有效性。
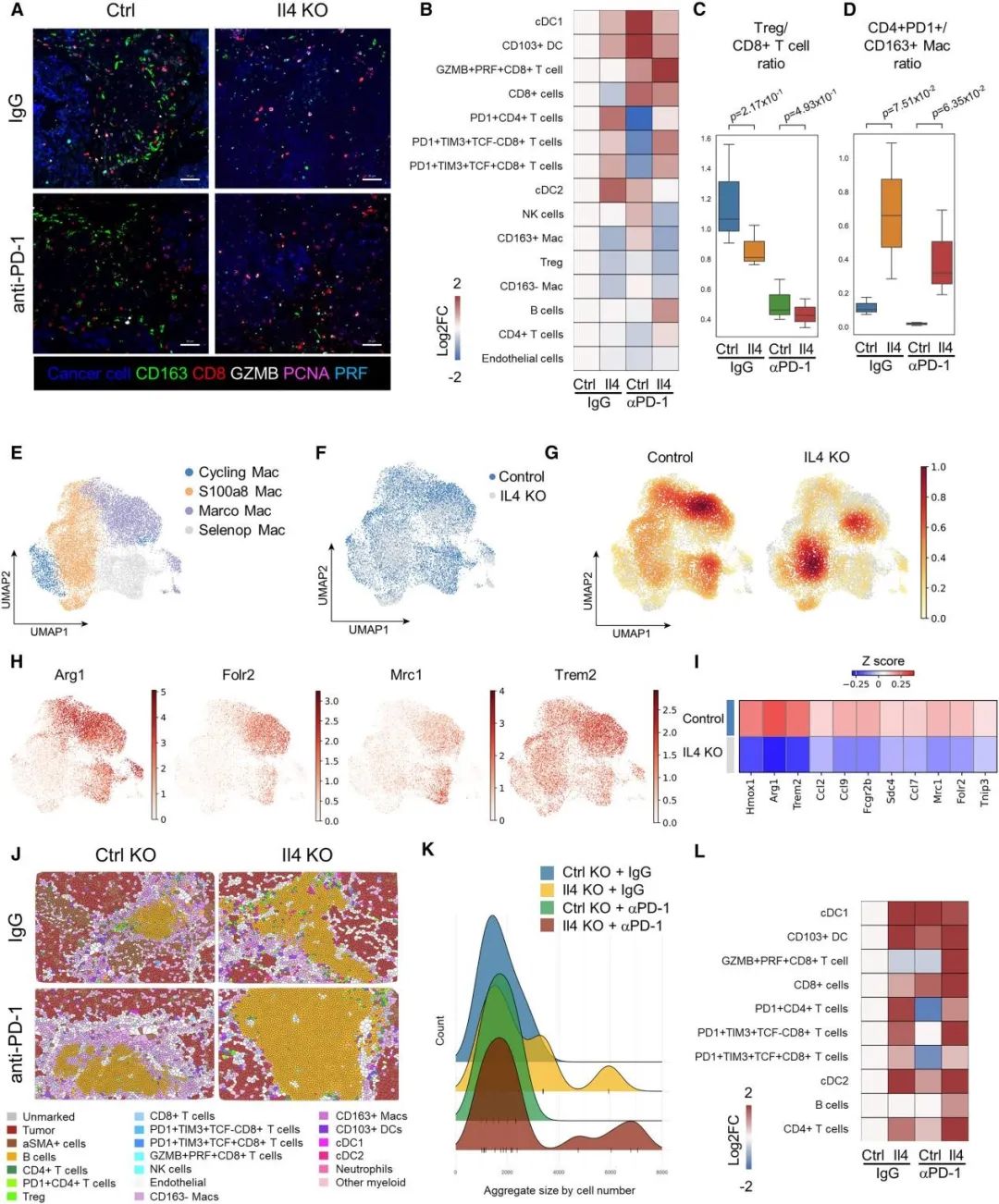
肿瘤来源的IL-4促进卵巢肿瘤的免疫抑制环境
06
卵巢肿瘤巨噬细胞中IL-4信号传导促进ICB抵抗
将IL-4反应特征投射到人类卵巢癌scRNA-seq数据中发现IL-4诱导的基因在卵巢癌的髓系细胞中高度显性表达,尤其在MARCO和SELENOP巨噬细胞亚群中占主导地位。为了确定IL-4在抗PD-1耐药性中的作用是否通过巨噬细胞控制,他们给在粒细胞单核细胞祖细胞和所有下游细胞(ID8卵巢癌中的主要巨噬细胞类型)中缺失IL4Rα基因的小鼠(Il4raΔMs4a3),或同窝对照小鼠注射ID8细胞,14天后进行抗PD-1或同型抗体治疗。研究发现单纯抗PD-1没有减缓腹水进展,然而在Il4raΔMs4a3小鼠中抗PD-1显著延缓了腹水的形成,甚至有几只小鼠没有肿瘤发生。单细胞测序确认Il4raΔMs4a3小鼠抑制性巨噬细胞减少,IL-4诱导的基因表达也减少,T细胞募集和激活中重要基因表达的增加,包括 H2-Ab1、H2-Aa、CD74 和 Cxcl16。这些结果表明IL-4通过对骨髓细胞的作用促进卵巢癌对抗PD-1治疗的抗性。抗IL4R单克隆抗体(达必妥)已获得FDA批准。他们用抗PD-1和同种型抗体或抗IL4R治疗后,发现双药联用可明显抑制小鼠肿瘤的生长,提示抗IL4R治疗可以提高抗PD-1在卵巢癌中的疗效。
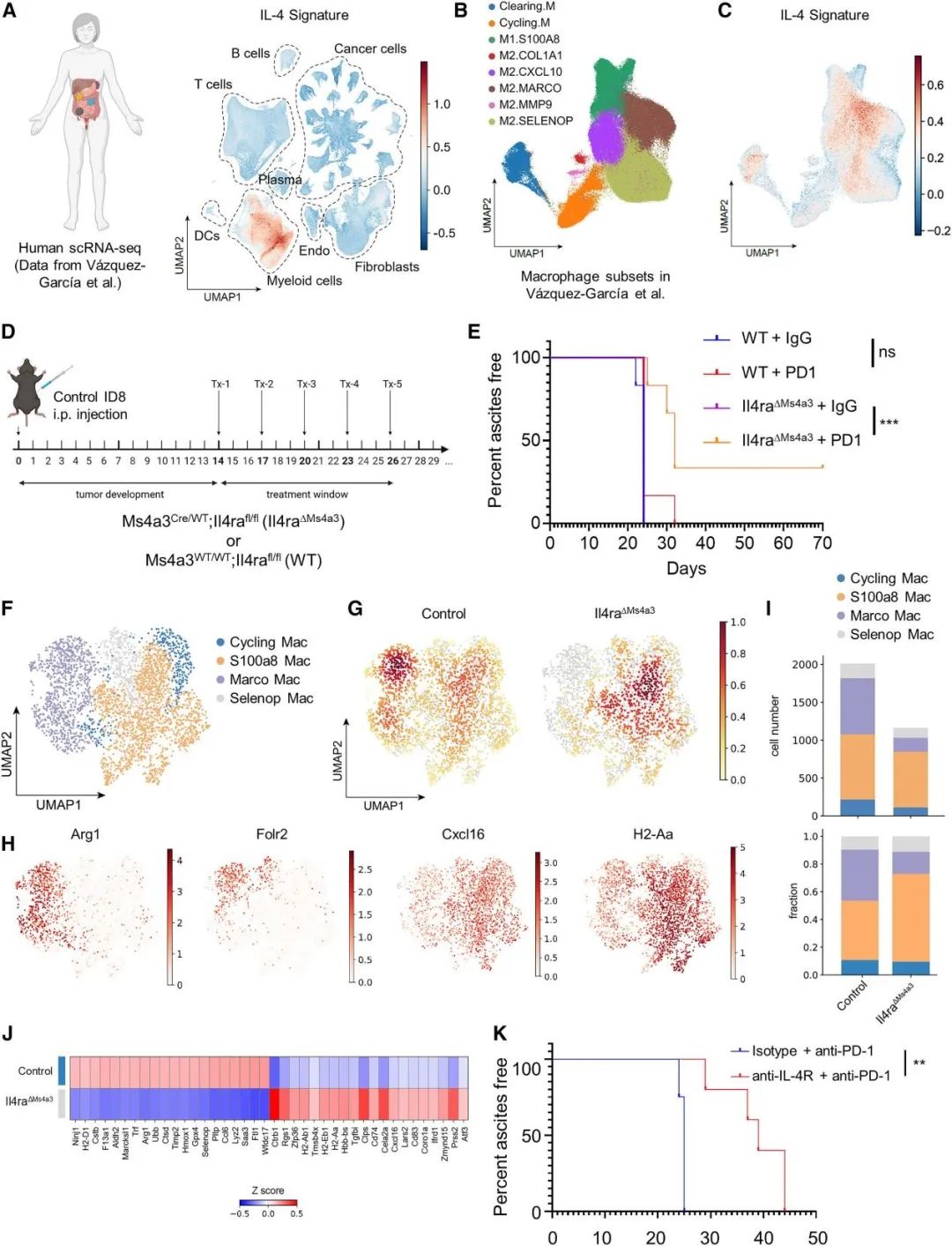
IL-4R介导的巨噬细胞控制了卵巢癌对抗PD-1的抵抗
研究结语
这篇文章使用Perturb-map技术直观地展现了肿瘤内异质性,这种异质性不仅存在于肿瘤克隆间的差异,也表现在不同克隆衍生的旁分泌因子在肿瘤微环境中形成独特的“邻域”,它们相互影响,彼此交融,竞争选择,有的善远交近攻,有的只画地为牢,形成了空间、时间叫错的复杂景观,让人惊叹。好在现在越来越多的先进技术可以让我们面对这些复杂性不再束手无策。正如此研究发现来自卵巢癌中少数细胞的IL-4也可以促进免疫抑制和对免疫检查点阻断治疗的抵抗,从而提出靶向IL-4信号传导增强卵巢癌免疫治疗效果的策略,为卵巢癌的综合治疗指明了新的方向。
参考文献:
1.Mollaoglu, G. et al. Ovarian cancer-derived IL-4 promotes immunotherapy resistance. Cell S0092-8674(24)01154–1 (2024).
2. Dhainaut, M. et al. Spatial CRISPR genomics identifies regulators of the tumor microenvironment. Cell 185, 1223-1239.e20 (2022).
3. LaMarche, N. M. et al. An IL-4 signalling axis in bone marrow drives pro-tumorigenic myelopoiesis. Nature 625, 166–174 (2024).
来源 | 科研办
附属妇产科医院
编译 | 钱俊斌
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




