- +1
【前沿进展】Nat Commun丨蒋卫课题组揭示非编码变异rs6048205影响胰岛分化以及导致糖…
糖尿病是一种以高血糖为主要症状的综合性代谢疾病,通常由胰岛β细胞的丧失或功能障碍引起,其发病机制复杂,受遗传易感性和环境因素的共同影响。研究表明,单基因突变可引发某些类型的糖尿病,如新生儿糖尿病、成年早发型糖尿病(Maturity-onset diabetes of the young, MODY)及糖尿病综合征等[1]。这些糖尿病类型主要由于调控β细胞发育或胰岛素分泌的关键转录因子发生突变而引起。例如,MODY3的致病基因HNF1A突变导致β细胞对葡萄糖响应能力降低[2];NEUROG3双等位基因突变会导致永久性新生儿糖尿病[3]。
人类和小鼠在胰腺发育及β细胞功能方面存在显著差异,使得小鼠模型的研究结果难以直接应用于人类疾病的研究。例如,GATA6的杂合失活突变在人类胰腺谱系分化中表现出显著的功能缺陷[4, 5],但在小鼠模型中未见明显表型[6]。这些差异促使科学家转向使用人类胚胎干细胞(Embryonic stem cells, ESCs)及诱导多能干细胞(Induced pluripotent stem cells, iPSCs)等体外模型,以研究人类胰腺发育及其相关疾病的潜在机制。近年来,利用这些多能干细胞,科学家已经成功分化出能够对葡萄糖刺激产生反应的胰岛β细胞,并在糖尿病小鼠模型中及糖尿病患者中实现血糖水平的改善[7-10]。
使用人类多能干细胞衍生的胰腺内分泌谱系分化方案,多项研究已深入探究单基因突变引发糖尿病的机制。然而,临床上大多数基于外显子测序的方法主要用于检测已知的编码区变异,从而忽略了非编码区域的潜在变异。全基因组关联研究(Genome-Wide Association Studies, GWAS)鉴定的与糖尿病症状关联的单核苷酸多态性(Single-Nucleotide Polymorphism, SNP)位点中,90%左右位于非编码区域,包括内含子和基因间区域[11]。这些非编码SNP的潜在功能及其在糖尿病发生中的作用仍需进一步探索。
为了深入研究非编码区SNP对胰岛分化及糖尿病的调控机制,2024年11月12日,武汉大学中南医院医学研究院、免疫与代谢前沿科学中心蒋卫教授课题组在Nature Communications发表题为“A noncoding variant confers pancreatic differentiation defect and contributes to diabetes susceptibility by recruiting RXRA”的研究论文。该研究揭示了非编码SNP rs6048205通过阶段特异性调控FOXA2的高表达进而抑制胰岛分化的机制,为糖尿病易感性的遗传调控提供了新的见解。这一发现不仅加深了我们对胰腺分化及其遗传调控网络的理解,还为糖尿病的预防和治疗提供了潜在的新靶点。

这项研究重点关注了一个非编码SNP rs6048205(NC_000020.11:22578963:A>G),该变异与较高的空腹血糖水平和受损的β细胞功能相关。根据Allele Frequency Aggregator (ALFA)项目的数据,rs6048205的风险等位基因G在东亚人群中的出现频率较高。为了探究这一变异在胰腺分化中的功能及其潜在的病理作用,该研究分别使用了多能干细胞胰岛β细胞分化模型和小鼠模型,分析了该非编码SNP在胰岛细胞分化及糖尿病易感性中的病理作用。并系统性探究了其作为一个获得性变异(Gain-of-function variant)阶段特异性调节下游基因表达的分子机制。
1. 细胞模型:体外胰岛β细胞分化证明rs6048205-G抑制胰腺谱系分化
为了探讨非编码SNP rs6048205在胰腺谱系分化中的功能,研究团队通过CRISPR/Cas9技术建立了携带非风险等位基因A和风险等位基因G的同源人类多能干细胞系。通过体外胰岛β细胞分化实验,研究人员发现携带风险等位基因G的细胞在定型内胚层及PDX1阳性的早期胰腺祖细胞阶段没有功能。但在晚期胰腺祖细胞分化过程中表现出显著缺陷,具体表现在,风险等位基因G细胞生成PDX1+/NKX6-1+胰腺祖细胞的效率显著降低,并影响胰腺谱系转录组表达。进一步在终末胰岛β细胞阶段,rs6048205风险变异降低胰岛素单阳性的β细胞比例减少、多激素细胞及其他胰腺内分泌谱系细胞比例的升高。此外,非编码SNP rs6048205的风险变异导致胰腺β细胞功能降低,在高浓度葡萄糖刺激后,胰岛素和C肽的分泌量减少。这些结果证明了非编码SNP rs6048205的风险变异会导致胰腺谱系分化缺陷。
2.下游作用机制:rs6048205-G通过阶段特异性激活FOXA2表达发挥功能
通过查看胰腺祖细胞阶段rs6048205附近基因的表达变化及差异基因关联,研究人员发现非编码SNP rs6048205风险变异导致临近基因FOXA2表达水平升高而不影响该位点2 Mb内其他基因的表达水平。并且rs6048205风险变异仅在胰腺祖细胞阶段提高FOXA2的表达水平,而不影响其他分化阶段细胞的FOXA2表达水平,证明非编码SNP rs6048205具有阶段性作用。
FOXA2作为先锋因子,在胰腺谱系发育中具有重要功能[12],然而其高表达如何抑制胰腺谱系分化是未知的。因此研究人员构建了条件性过表达FOXA2的多能干细胞系,发现胰腺祖细胞阶段特异性过表达FOXA2可以模拟SNP rs6048205风险变异的分化表型,即抑制胰腺祖细胞阶段NKX6-1的阳性率。通过ChIP-seq数据的挖掘及实验验证,研究人员发现FOXA2可以直接结合到NKX6-1的基因座附近抑制NKX6-1表达。这不仅证明非编码SNP rs6048205风险变异通过阶段特异性激活FOXA2表达导致胰腺祖细胞发育缺陷,还为FOXA2在胰腺发育中的功能提供了新的见解。
3. 上游调控因子:rs6048205-G增强上游转录因子RXRA结合
通过组蛋白修饰及ATAC-seq数据分析,研究人员证明rs6048205位于类增强子调控区,并且该调控区具有细胞特异性调控功能。通过结合Motif分析及生化实验验证,研究人员发现非编码SNP rs6048205风险变异G导致上游转录因子RXRA的结合增强。同时该SNP的阶段特异性调控作用归因于上游因子RXRA只在胰腺祖细胞中定位于细胞核发挥核受体功能。
此外研究人员发现在胰腺祖细胞分化阶段添加RXR激活剂可以提高靶基因FOXA2的表达水平并抑制NKX6-1表达及阳性率,表明该SNP位于FOXA2的调控区域。反之胰腺祖细胞阶段引入RXR抑制剂可以部分恢复NKX6-1的表达水平,缓解分化缺陷。有趣的在A/A细胞中RXR抑制剂不影响祖细胞阶段FOXA2及NKX6-1的表达水平,表明SNP rs6048205-G以RXRA依赖的方式调节FOXA2的表达。
4. 生理功能:非编码SNP rs6048205小鼠易感糖尿病
研究人员发现非编码SNP rs6048205附近的序列在人与小鼠中相对保守,这为研究该SNP的体内功能提供了机会。研究人员构建了rs6048205原位突变的小鼠模型,发现A > G变异导致小鼠胚胎期胰腺组织中NKX6-1阳性细胞比例减少,成年小鼠胰岛中β细胞比例降低以及胰岛结构受损。通过体内相关血糖稳态检测,研究人员表明非编码SNP rs6048205风险变异导致小鼠空腹血糖升高以及葡萄糖轻度耐受不良。在受到糖尿病诱导因素(如链脲佐菌素或高脂饮食)刺激时,SNP rs6048205风险变异会造成小鼠血糖升高及削弱的糖耐量,引起糖尿病症状,证明该非编码变异风险变异增加小鼠糖尿病易感性。
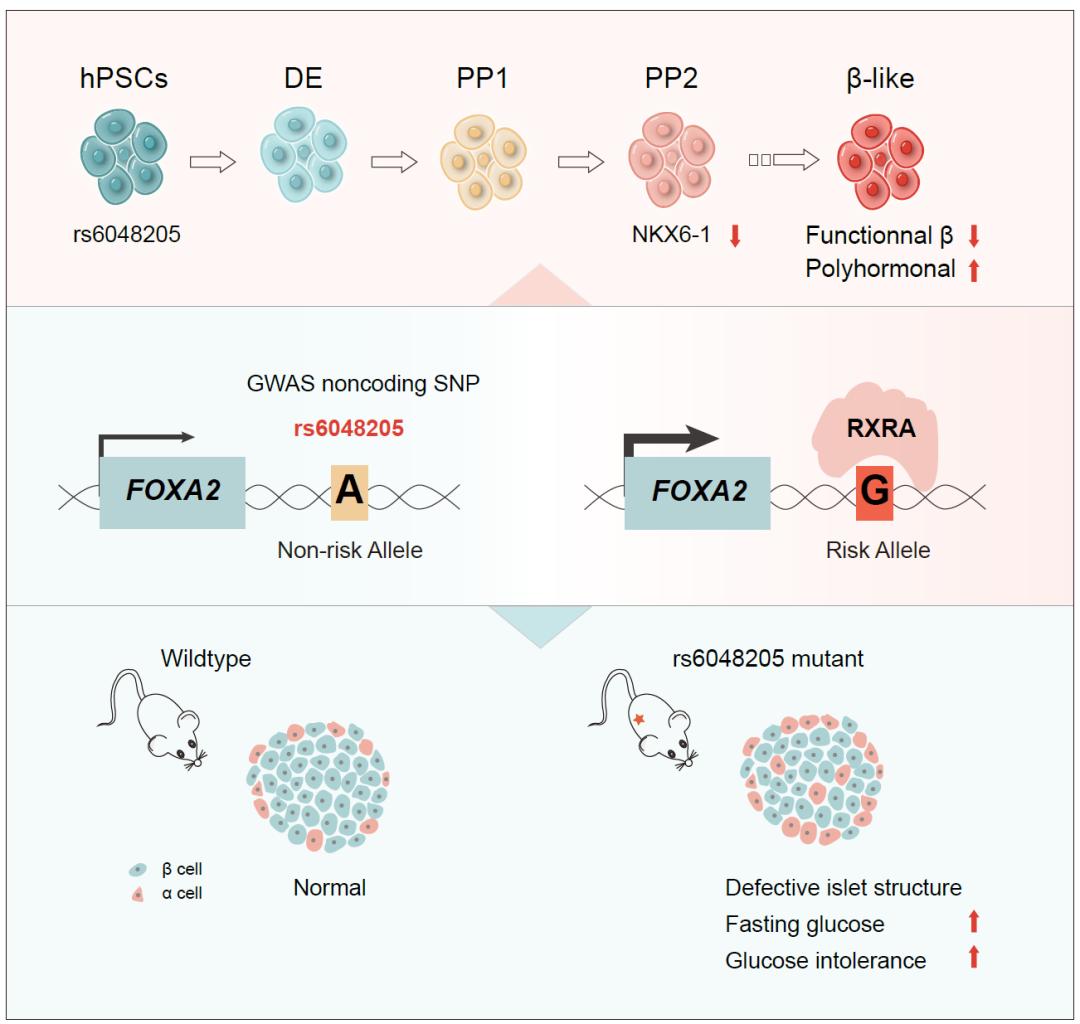
非编码 SNP rs6048205风险等位基因G在胰腺祖细胞阶段特异性增强RXRA结合并激活FOXA2表达。rs6048205-G降低了NKX6-1+胰腺祖细胞的分化效率,导致功能性β细胞的减少和体外多激素内分泌细胞的异常增加。携带风险等位基因G的小鼠空腹血糖水平更高,存在葡萄糖耐受不良,并增加了糖尿病的易感性。
综上所述,该研究详细探讨了非编码SNP rs6048205以RXR-FOXA2-NKX6-1调控轴的方式调控胰腺发育的机制,并且验证了GWAS来源的非编码变异对胰腺β细胞发育和功能以及糖尿病易感性的关联性。该研究表明SNP rs6048205突变小鼠更易受外界刺激患糖尿病,结合GWAS数据的关联分析,提示SNP rs6048205风险变异携带者易患糖尿病。因此非编码SNP rs6048205位点可以作为糖尿病临床诊断及预防的标志,用来开发筛查或辅助筛查糖尿病易感个体或非易感个体的产品。另外SNP rs6048205风险变异在东亚人群中高发,提示该SNP对于中国人群可能有更重要的意义。
武汉大学医学研究院博士研究生李迎雷为论文第一作者。武汉大学中南医院医学研究院、免疫与代谢前沿科学中心蒋卫教授为论文的通讯作者。武汉大学医学研究院研究生郑冉、姜来、闫晨超等以及武汉大学中南医院代喆主任等也做出了重要贡献。该研究得到了国家自然科学基金、湖北省自然科学基金、中央高校基本科研业务费专项资金、武汉市知识创新专项项目、武汉大学中外联合科研平台种子基金等项目的支持。医学研究院仪器设备共享中心以及动物实验中心为本研究提供了有力的硬件平台支持。
原文链接:
https://www.nature.com/articles/s41467-024-54151-y
参考文献:
1. Zhang, H., et al., Monogenic diabetes: a gateway to precision medicine in diabetes. J Clin Invest, 2021. 131(3).
2. Colclough, K. and K. Patel, How do I diagnose Maturity Onset Diabetes of the Young in my patients? Clin Endocrinol (Oxf), 2022. 97(4): p. 436-447.
3. Rubio-Cabezas, O., et al., Permanent Neonatal Diabetes and Enteric Anendocrinosis Associated With Biallelic Mutations in NEUROG3. Diabetes, 2011. 60(4): p. 1349-53.
4. Chia, C.Y., et al., GATA6 Cooperates with EOMES/SMAD2/3 to Deploy the Gene Regulatory Network Governing Human Definitive Endoderm and Pancreas Formation. Stem Cell Reports, 2019. 12(1): p. 57-70.
5. Shi, Z.D., et al., Genome Editing in hPSCs Reveals GATA6 Haploinsufficiency and a Genetic Interaction with GATA4 in Human Pancreatic Development. Cell Stem Cell, 2017. 20(5): p. 675-688 e6.
6. Morrisey, E.E., et al., GATA6 regulates HNF4 and is required for differentiation of visceral endoderm in the mouse embryo. Genes Dev, 1998. 12(22): p. 3579-90.
7. Hogrebe, N.J., et al., Generation of insulin-producing pancreatic beta cells from multiple human stem cell lines. Nat Protoc, 2021. 16(9): p. 4109-4143.
8. Pagliuca, F.W., et al., Generation of functional human pancreatic beta cells in vitro. Cell, 2014. 159(2): p. 428-39.
9. Rezania, A., et al., Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat Biotechnol, 2014. 32(11): p. 1121-33.
10. Wang, S., et al., Transplantation of chemically induced pluripotent stem-cell-derived islets under abdominal anterior rectus sheath in a type 1 diabetes patient.Cell, 2024. 187(22): p. 6152-6164 e18.
11. Lappalainen, T. and D.G. MacArthur, From variant to function in human disease genetics. Science, 2021. 373(6562): p. 1464-1468.
12. Li, J., et al., Structure of the Forkhead Domain of FOXA2 Bound to a Complete DNA Consensus Site. Biochemistry, 2017. 56(29): p. 3745-3753.
蒋卫课题组长期从事干细胞命运决定的分子调控机制和转化研究。实验室主要利用人多能干细胞维持和分化体系,聚焦于早期胚层分化的表观和代谢调控机制,同时也研究如何结合细胞分化、组织工程等制备功能胰岛细胞用于细胞治疗和建立糖尿病疾病模型。近五年主要研究成果包括:阐明长非编码RNA和内源性逆转录病毒元件在人多能性调控以及胚层分化中的作用及机制(Genome Biol 2023;Nucleic Acids Res 2022;Stem Cell Rep 2020);解析细胞代谢及生物物理刺激调控细胞干性和分化的机制(Dev Cell 2023;Stem Cell Rep 2024;Redox Biol 2022);揭示多个表观遗传因子调控早期胚层分化的机制(Nat Commun 2022;Cell Death Dis 2021;Development 2023)。同时,课题组在人新型多能干细胞及干细胞相关转化应用方面也做了一些探索性工作(Stem Cell Rep 2021;Cell Discov 2022;Theranostics 2022;多项国家发明专利)。
原标题:《【前沿进展】Nat Commun丨蒋卫课题组揭示非编码变异rs6048205影响胰岛分化以及导致糖尿病易感的分子机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




