- +1
再发Nature:同济大学王平团队揭示缬氨酸感应新机制及其在肿瘤治疗中的应用

编辑丨王多鱼
排版丨水成文
氨基酸是维持机体正常生理活动的重要营养物质,其调控异常可导致癌症、衰老及代谢相关性疾病等。因此,氨基酸饮食疗法和药物靶向氨基酸代谢/感应已成为延长生命、治疗癌症等多种疾病的潜在手段。一般而言,氨基酸可通过代谢和感应两种方式调控细胞的正常生命活动。在氨基酸感应调控中,氨基酸直接与特定感应器结合是进化过程中一种更为简单、直接的调控方式。因此,探寻氨基酸感应机制、鉴定氨基酸感应器有利于解析细胞生命活动和疾病演变规律,为疾病治疗提供潜在靶点。
缬氨酸是一种必需的支链氨基酸,其在蛋白质合成、神经行为、白血病进展中发挥着重要的作用。缬氨酸饮食限制疗法也被认为有利于急性淋巴细胞白血病等非实体肿瘤和脂肪肝等代谢性疾病的治疗。然而,缬氨酸是否存在特异性的感应器及其调控癌症、代谢性疾病的机制尚不清楚。此外,如何避免缬氨酸饮食限制所引起的副反应也是临床应用该疗法所需关注的重要问题。
2024年11月20日24时,同济大学医学院/附属第十人民医院王平团队在 Nature 期刊发表了题为:Human HDAC6 senses valine abundancy to regulate DNA damage 的研究论文【1】。
该研究发现了一个全新的缬氨酸特异性感应器——人源去乙酰化酶HDAC6。机制方面,缬氨酸限制可导致HDAC6核转位,进而增强TET活性,诱导DNA损伤。值得注意的是,该感应机制是灵长类所特有的,灵长类HDAC6含有一段特有的富含丝氨酸-谷氨酸十四肽(SE14)重复结构域,并通过该结构域感应缬氨酸丰度。在肿瘤的治疗方面,适宜剂量的缬氨酸限制单独或联合PARP抑制剂,可有效抑制肿瘤的生长。
综上所述,该研究揭示了营养应激通过表观遗传修饰调控DNA损伤的全新机制,并提出缬氨酸限制性饮食联合PARP抑制剂的肿瘤治疗新策略。

氨基酸感应器通常需结合氨基酸,从而识别并响应细胞内外的氨基酸浓度变化,发挥其感应功能。为系统性鉴定缬氨酸结合蛋白,研究团队利用生物素化修饰的缬氨酸探针进行免疫共沉淀实验并结合质谱分析,利用化学生物学无偏差筛选缬氨酸结合蛋白。研究团队发现,除已知的缬氨酰tRNA合成酶(VARS)外,去乙酰化酶HDAC6相较于VARS,显示出更强的缬氨酸结合能力。进一步利用同位素结合实验、等温滴定量热(ITC)实验及热漂移等实验,研究团队确定了HDAC6能够直接结合缬氨酸,其亲和力为Kd≈2μM。解析感应蛋白识别氨基酸的结构特征,有助于深入理解细胞感应氨基酸丰度变化的分子机制。研究团队通过分析缬氨酸类似物的结合实验发现,HDAC6识别缬氨酸的羧基端和侧链,能够容忍氨基端修饰。此外,在HDAC6敲除细胞中,限制缬氨酸对mTOR信号通路的调控较对照组无明显差异,提示这一结合区别于传统的氨基酸感应信号通路。
为了探究HDAC6感应缬氨酸的重要结构域及其功能。研究团队通过HDAC6截断体结合实验,确定HDAC6通过其SE14结构域与缬氨酸发生结合。令人惊讶的是,通过同源性比对发现,SE14结构域仅存在于灵长类的HDAC6中。有别于灵长类(人和猴子)的HDAC6,鼠的HDAC6并不能与缬氨酸发生结合。这一发现揭示了不同物种在缬氨酸感应中的差异性,提示了物种进化在氨基酸感应中的重要作用。
基于HDAC6通过其SE14结构域直接结合缬氨酸这一结果,作者推测当细胞内缬氨酸丰度发生变化时,HDAC6与缬氨酸的结合强弱可能影响其结构及功能。通过一系列的实验探究及SE14结构域在HDAC6胞质滞留中作用的相关报道,研究团队发现,细胞内缬氨酸的匮乏能够诱导HDAC6转位至细胞核,其酶活区域(DAC1和DAC2)与DNA羟甲基化酶TET2的活性区域(CD结构域)发生结合,促进TET2发生去乙酰化,激活其酶活性。作者通过WGBS、ACE-Seq和MAB-Seq等甲基化组学技术,进一步证实了细胞内缬氨酸饥饿,能够通过HDAC6-TET2信号轴,促进DNA主动去甲基化。之前有研究发现神经元中 DNA单链损伤来源于TDG依赖的DNA主动去甲基化。该研究通过TET2 ChIP-Seq结合检测DNA损伤的高通量测序技术END-Seq和ddC S1 END-Seq等实验方法,确定缬氨酸匮乏促进DNA损伤。缬氨酸匮乏诱导的DNA损伤同样也依赖于胸腺嘧啶DNA糖基化酶(TDG)的氧化甲基胞嘧啶(5fC/5caC)所产生的单链损伤。
综上所述,该研究发现了全新的缬氨酸感应器,并首次阐明了缬氨酸限制通过HDAC6-TET2-TDG信号轴诱导DNA损伤的分子机制,为理解氨基酸应激决定细胞命运的功能增加了一个新的维度。
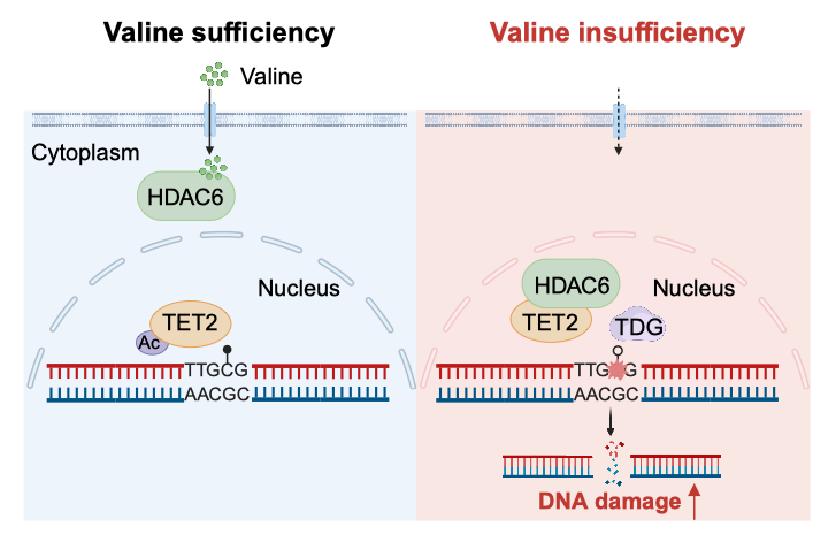
饮食限制或者靶向氨基酸代谢和感应已成为延长寿命和癌症等多种疾病治疗的辅助策略。前期关于缬氨酸剥夺疗法虽然在非实体肿瘤和脂肪肝等疾病中起到了一定的治疗效果,但是由于必需氨基酸确实所引起的副作用也引起了关注。
鉴于缬氨酸剥夺能够促进DNA损伤,研究团队进一步研究了缬氨酸限制在实体肿瘤癌症中的效果。在结直肠癌异种移植瘤模型中,研究团队选择了不同缬氨酸限制饮食的方案,该浓度的缬氨酸限制(0.41%缬氨酸,w/w)可显著抑制肿瘤生长,同时副作用较小。在预防组和治疗组中,研究团队利用结直肠癌PDX模型进一步证实了限制缬氨酸饮食可抑制肿瘤的发生与发展。在肿瘤样本中,缬氨酸水平的降低与HDAC6核易位、5hmC水平和DNA损伤程度的增加呈正相关。由于诱导DNA损伤是一种抗癌疗法,在临床上可以通过使用PARP抑制剂阻断DNA修复。研究团队发现缬氨酸限制性饮食和PARP抑制剂(talazoparib)联合治疗显著增强抗肿瘤效果,这为该疗法通过诱导DNA损伤治疗癌症提供了有力的证据。
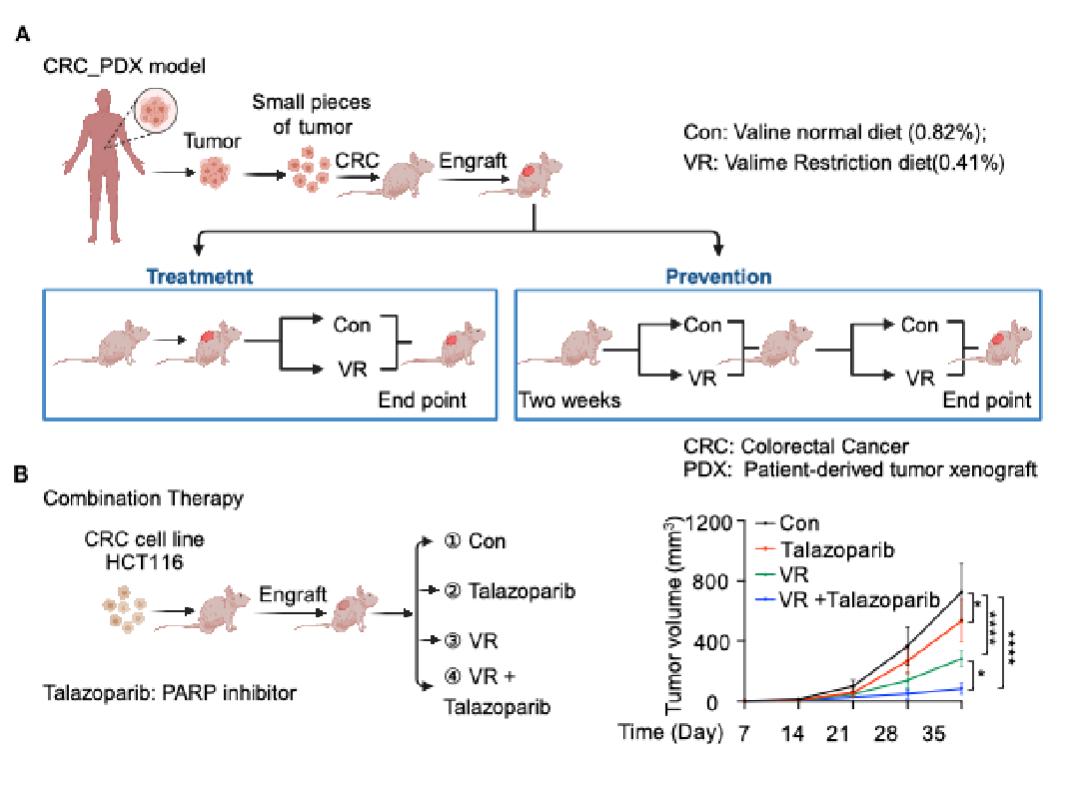
总的来说,该研究发现,灵长类动物的HDAC6是一种不依赖于传统感应器的全新缬氨酸感应蛋白,揭示不同物种在缬氨酸感应中的差异性,表明生物进化在氨基酸感应中的重要作用。此外,该研究还阐明了营养代谢应激、表观遗传调控与DNA损伤交互调控的新机制,拓宽了营养代谢应激在应激生物学中的重要性,并发现缬氨酸限制性饮食与PARP抑制剂联合应用可作为癌症治疗的新策略。
相关阅读:
2024年1月31日,同济大学医学院/附属第十人民医院王平教授团队(李亚旭、冉巧、段秋慧、金佳丽为共同第一作者)在 Nature 期刊发表了题为:7-Dehydrocholesterol dictates ferroptosis sensitivity 的研究论文【2】。
该研究发现并揭示了远端胆固醇合成通路关键酶通过调控7-脱氢胆固醇(7-DHC)的水平来调控铁死亡敏感性的机制,表明了通过药物调控7-DHC水平,是一种有前途的治疗癌症和缺血再灌注损伤的新策略。
详细介绍:

同济大学医学院/附属第十人民医院王平教授为论文通讯作者,同济大学医学院/附属第十人民医院金佳丽研究员、上海市第一人民医院孟通副主任医师、同济大学生命科学学院博士生俞媛媛和中国科学院分子细胞科学卓越创新中心博士后吴树恒为该论文共同第一作者。
该研究得到了同济大学生命科学学院江赐忠教授、中国科学院分子细胞科学卓越创新中心吴薇研究员、耶鲁大学吴殿青教授、同济大学医学院袁健教授、同济大学生命科学学院薛剑煌教授/王子昕、华东师范大学陈益华教授和沈阳药科大学曹昊教授等团队的合作和支持。此外,中国科学院分子细胞科学卓越创新中心徐国良教授、裴钢教授和周小龙研究员、美国国立卫生院癌症研究中心(NIH/NCI)André Nussenzweig教授、斯隆凯特琳癌症中心姜学军教授、同济大学戈宝学教授、刘海鹏教授、章小清教授、徐艳萍教授、中山大学岳家兴副研究员、复旦大学附属肿瘤医院单泽志博士及中科院药物所周虎教授/高婧老师等为本研究提供了指导,上海国家蛋白质科学研究中心(NFPS)提供平台支持。该研究获得了国家自然科学基金委国际合作项目、重点项目以及科技部国家重点研发计划等项目的资助。
王平教授长期致力于肿瘤微环境基础与转化研究,围绕肿瘤代谢和免疫微环境的调控机制寻找新靶点,开发肿瘤干预新策略,以通讯作者在Nature (2024a, 2024b),Cancer Cell(2023,2018),Immunity,Molecular Cell,Cell Research,Developmental Cell,J Clin Invest等国际主流杂志发表论著50余篇。课题组长期招聘博士后、副/助理研究员等各类工作人员,欢迎有志者加盟!
论文链接:
1. https://www.nature.com/articles/s41586-024-08248-5
2. https://www.nature.com/articles/s41586-023-06983-9
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




