- +1
Cancer Cell:中山大学邝栋明/魏瑗团队揭示癌周交叉呈递削弱了肝癌免疫治疗效果
原创 生物世界 生物世界
撰文丨王聪
编辑丨王多鱼
排版丨水成文
细胞毒性T淋巴细胞(CTL)是抗肿瘤免疫的关键效应细胞,它们的浸润通常是有效的免疫检查点阻断(ICB)治疗的预测性生物标志物。然而,只有一小部分肿瘤内富集CTL的患者能从ICB疗法中获益,而且在接受ICB疗法后,一些患者甚至会出现疾病的超进展,这表明CTL在人类癌症进展中存在未被识别的致病作用。
到目前为止,CTL在人类癌症中是否以及如何发挥促癌作用尚不明确。更重要的是,必须解决的一个相关问题是:肿瘤微环境中的CTL的致病性是否取决于它们的克隆反应性。如果这样的话,我们如何能够开发出更加合理的免疫疗法策略呢?
2024年11月15日,中山大学生命科学院邝栋明教授、魏瑗副教授等在 Cancer Cell 期刊发表了题为:Pericancerous cross-presentation to cytotoxic T lymphocytes impairs immunotherapeutic efficacy in hepatocellular carcinoma 的研究论文。
该研究揭示了肝细胞癌(HCC)中,癌周巨噬细胞通过内质网(ER)相关的降解机制介导的胞质途径途径将抗原交叉呈递给肿瘤反应性细胞毒性T淋巴细胞(CD103+CTL),这一过程导致CD103+CTL滞留在癌周区域,从而激活巨噬细胞中的NLRP3炎症小体,促进肝癌进展和免疫治疗抵抗。
对HCC患者的单细胞RNA测序(scRNA-seq)和空间转录组学分析表明,尽管存在组织驻留效应细胞表型,但CD103+CTL的聚集预示着接受多种治疗的HCC患者的不良临床结局。相应地,靶向肿瘤微环境中CD103+CTL重新分布的治疗策略,不仅能促进肿瘤内CD103+CTL的浸润,还能削弱癌周巨噬细胞的促肿瘤炎症反应,从而增强免疫检查点阻断(ICB)疗法对HCC的治疗效果。

CTL的克隆扩增和反应性通常是由MHC I分子呈递来自癌细胞和病毒感染细胞的外源性抗原所启动的。有趣的是,树突状细胞(DC)作为淋巴器官中的专业抗原呈递细胞,可以通过两种途径交叉呈递直接激活CTL的克隆扩增和效应功能:胞质途径利用新合成的MHC I分子呈递由蛋白酶体降解的内化的外源性抗原,而液泡途径利用内化的MHC I分子呈递由溶酶体降解的抗原。然而,在肿瘤微环境中,树突状细胞的发育和成熟往往受到阻碍,而促肿瘤生成的巨噬细胞构成了主要的专业抗原呈递细胞。因此,评估肿瘤微环境中促肿瘤巨噬细胞与CTL之间的双向相互作用,包括交叉呈递,对于理解它们在肿瘤发生中的作用和潜在机制至关重要。
基于肿瘤微环境中免疫细胞的绝对数量和空间分布,实体肿瘤的免疫特征可以分为三种亚型:免疫富集型、免疫排斥型和免疫荒漠型。这些亚型中,免疫排斥型指的是CTL聚集在肿瘤周围的癌周间质而不是肿瘤巢内。
截至目前,在癌症患者中,尤其是接受免疫疗法的癌症患者中,癌周CTL的特性、聚集机制和生物学功能仍不明确。
肝细胞癌(HCC)通常发生在有炎症的肝脏中,因此肿瘤部位的炎症环境会对恶性肿瘤的行为和治疗效果产生显著影响。
在这项最新研究中,研究团队发现,尽管癌周CTL表现出具有克隆扩增和高反应性的CD103+组织驻留效应表型,但这些细胞的聚集预示着接受手术切除、ICB疗法、手术切除+ICB疗法,以及ICB疗法+经动脉灌注化疗的患者的不良治疗结局。
从机制上来说,癌周巨噬细胞的交叉呈递导致了CD103+CTL在肝细胞癌肿瘤的癌旁区域的保留。重要的是,交叉呈递后,癌周CD103+CTL诱导巨噬细胞中NLRP3的活化和随后的炎症反应,从而为肝癌进展和减弱免疫治疗效力创造有利条件。
该研究的核心发现:
癌周CD103+克隆扩增的CTL预示着较差的免疫治疗效果;
癌周巨噬细胞的交叉呈递导致了肝细胞癌(HCC)中CD103+CTL的滞留;
反应性CTL通过激活NLRP3炎症小体启动巨噬细胞的致病性;
CD103+CTL的重新分布可增强免疫治疗效果;
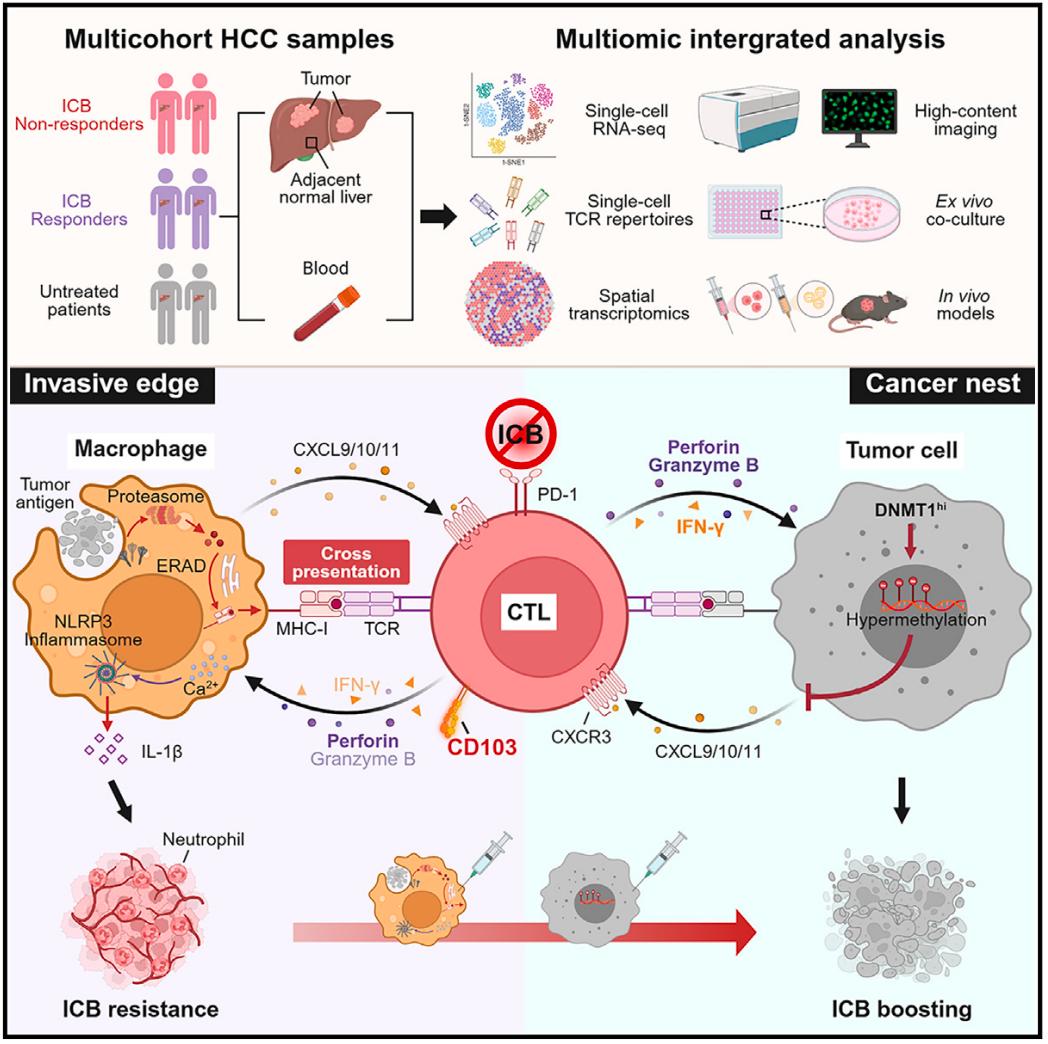
鉴于这些发现,研究团队认为,研究选择性调节效应CTL空间定向的机制可能带来癌症治疗新策略。研究团队建议,将抗PD-1/PD-L1等免疫检查点阻断(ICB)疗法与重新分布CD103+CTL的药物联合,可能有助于肝细胞癌(HCC)的治疗。
论文链接:
https://www.cell.com/cancer-cell/abstract/S1535-6108(24)00400-8

原标题:《Cancer Cell:中山大学邝栋明/魏瑗团队揭示癌周交叉呈递削弱了肝癌免疫治疗效果》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




