- +1
Nature:曹云龙团队揭示新冠病毒流行谱系转变下的抗体免疫响应演化

编辑丨王多鱼
排版丨水成文
尽管世界卫生组织(WHO)宣布了COVID-19全球性疫情的结束,新冠病毒(SARS-CoV-2)仍在世界范围内持续流行,并长期处于不断突变和进化的过程中,继续作为世界公共卫生的主要威胁之一。2023年以来,新冠流行突变株的交替继续在全世界显示出趋同和一致性。自从2023年9月开始,BA.2.86特别是其支系JN.1出现,并在多个地区取得显著的增长优势,世界主流毒株从XBB谱系过渡到了BA.2.86/JN.1。
新冠病毒S蛋白上的受体结合域(RBD)是病毒侵染细胞过程中发挥关键功能的重要结构域,也是疫苗接种与感染所产生中和抗体的主要靶点。作为一个“跳跃式”毒株,BA.2.86的RBD相比BA.2有14处氨基酸突变,与此前流行的XBB.1.5相比也有12处不同,而JN.1与其他子毒株则差距更大,说明BA.2.86/JN.1谱系很可能与此前毒株显示出迥异的免疫原性与抗原性。同时在流行过程中,JN.1谱系也不断在RBD区域积累更多逃逸突变,形成KP.2、KP.3等子突变株,这些突变株也在出现后快速取得优势,对已有的基于XBB.1.5突变株为主的疫苗加强针有效性形成严峻挑战。
因此,在分子层面解析JN.1谱系的抗原性与免疫原性,确定现有疫苗与感染背景下人群对新型免疫逃逸突变株的保护效力并厘清XBB.1.5与JN.1感染所激活抗体的异同,对于理解病毒未来进化轨迹并确定未来疫苗开发策略至关重要。
2024年11月7日,北京大学生物医学前沿创新中心、北大-清华生命科学联合中心、昌平实验室曹云龙课题组在 Nature 期刊发表了题为:Evolving antibody response to SARS-CoV-2 antigenic shift from XBB to JN.1 的研究论文。
该研究通过对不同免疫背景的XBB与JN.1突变株感染者产生抗体的系统性分析,首次描述了XBB和JN.1谱系免疫原性的区别,细致描绘了XBB与JN.1谱系感染者的体液免疫图景,强调了KP.2、KP.3,特别是KP.3.1.1等JN.1谱系突变株的强烈免疫逃逸能力,并从表位角度详细说明了原始株交叉结合抗体与奥密克戎特异性抗体对于JN.1谱系中和作用的不同特点。

该研究发现,在交叉结合抗体中发挥主要中和作用的IGHV3-53/3-66来源Class 1广谱抗体能够与所有奥密克戎特异性中和表位竞争,从而有可能屏蔽奥密克戎突破感染中特异性初始B细胞的激活,特别是对于接种过免疫原性较强的mRNA疫苗的人群。这一模型能够解释mRNA疫苗接种仅在人类而非小鼠中导致反常强烈免疫印记的原因,提示了由于疫苗历史与免疫印记的不同,世界范围内人群免疫背景具有潜在的“东西方差异”。
该研究认为,为了高效富集真正广谱的Class 1(或A1类)中和抗体,并争取免疫印记的减弱甚至消除,基于包含多个A1抗体特异性逃逸突变的新型JN.1谱系突变株,特别是KP.2和KP.3等子毒株来开发疫苗加强针是有必要的。
该论文于2024年4月19日发布于预印本平台bioRxiv后,受到WHO和国际学术界的大量关注,为今年秋冬季基于JN.1/KP.2的新冠疫苗更新提供了重要参考和指导。
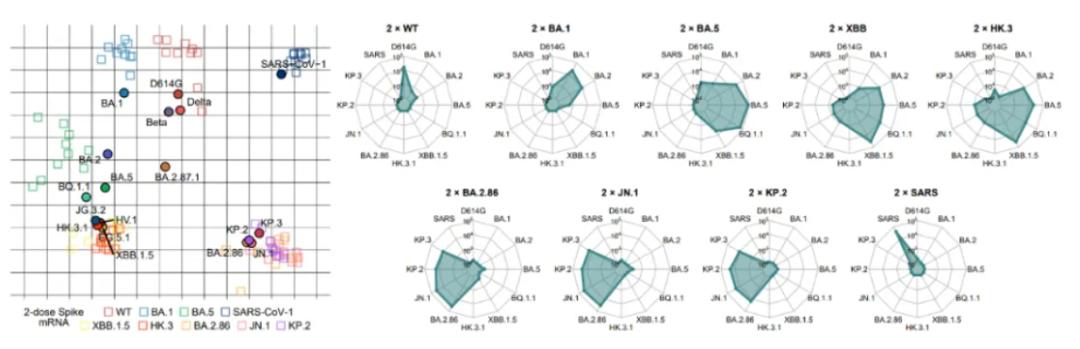
主要新冠突变株在小鼠免疫中显示的免疫原性与抗原性图谱
具体而言,研究团队首先使用编码S蛋白的mRNA免疫小鼠,利用突变株假病毒中和模型,全面研究了疫情以来多种主要新冠突变株在小鼠中的免疫原性与抗原性,系统绘制了新冠突变株的抗原性图谱。分析发现,尽管在进化上属于奥密克戎BA.2谱系,BA.2.86及其子突变株JN.1、KP.2、KP.3显示出与此前流行的BA.2/BA.5/XBB等谱系完全不同的免疫原性与抗原性,其差异之大甚至可与非典病毒(SARS-CoV-1)与新冠病毒的差距相比。SPR实验还证明了尽管JN.1和KP.2相比BA.2.86与受体ACE2的亲和力有所下降,但KP.3通过F456L与Q493E联合突变的组合效应,使得ACE2亲和力显著提升。这些发现进一步强调了研究新冠流行株从XBB到JN.1转变过程中人群体液免疫系统响应的重要性。
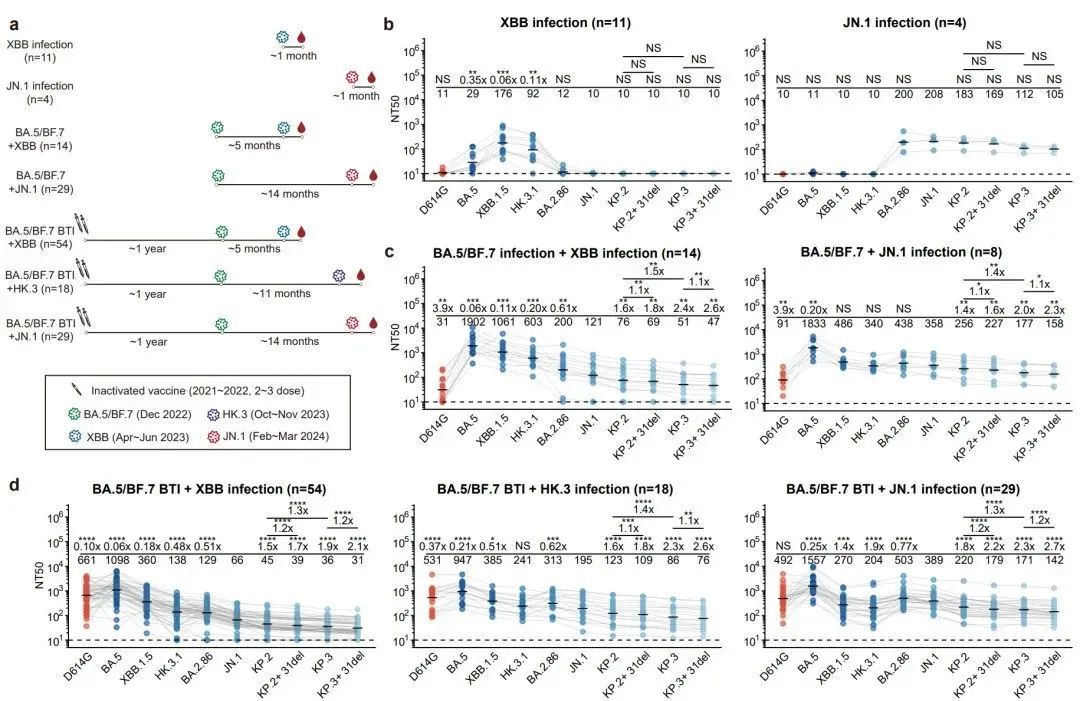
不同免疫背景人群对不同谱系新冠突变株的血浆中和滴度对比
因此,该研究从7种具有不同新冠相关免疫历史的人群中收集了外周血样本,并测试了其血浆对多种突变株的中和活性。结果表明,在未接种疫苗人群中,XBB支系的感染与JN.1支系的感染之间几乎不产生交叉中和的抗体,与小鼠免疫结果一致。然而,对于在感染XBB或JN.1前曾接种过灭活疫苗或经受过BA.5/BF.7突变株感染的人群,XBB和JN.1支系的感染能够产生更加相似的中和活性谱,反映出潜在广谱中和抗体的存在。同时研究发现,近期的KP.3.1.1(KP.3+S31del)对不同人群总是显示出最强的免疫逃逸能力,解释了其较高的增长优势。整体从血浆层面来看,JN.1的突破感染比XBB支系,包括HK.3的突破感染对近期流行的JN.1谱系突变株具有显著更高的中和抗体滴度,初步反映了基于JN.1谱系开发疫苗加强针的重要性。
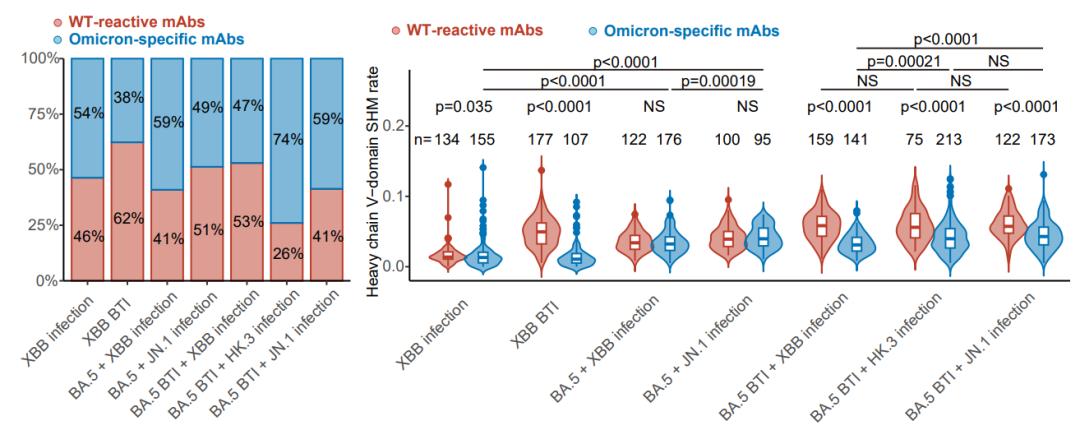
不同免疫背景的RBD特异性记忆B细胞所编码单抗的特异性与突变频率
为了进一步理解免疫背景的不同对XBB/JN.1谱系体液免疫应答造成的影响,确定对最新突变株有效的具体抗体组成类型,估计对未来突变株感染或疫苗的体液免疫响应,研究团队进一步从上述人群体内通过流式分选(FACS)分离了RBD特异性记忆B细胞,通过单细胞V(D)J测序确定了约2000条对应的BCR序列,并在体外表达为单克隆抗体。结果表明,不同免疫背景的人群体内记忆B细胞都包含能够与原始株交叉结合的抗体,以及特异性针对奥密克戎谱系的抗体。与此前报道的结果类似,由于免疫印记,XBB单次突破感染者的交叉结合抗体比例最高,而在接种灭活疫苗后重复感染不同突变株的人群体内,免疫印记的效应减弱。在接种过疫苗的人群体内,原始株交叉结合抗体的体细胞超频突变(SHM)率显著高于奥密克戎特异性抗体;而在未接种疫苗人群中无此现象,这也与预期相符。
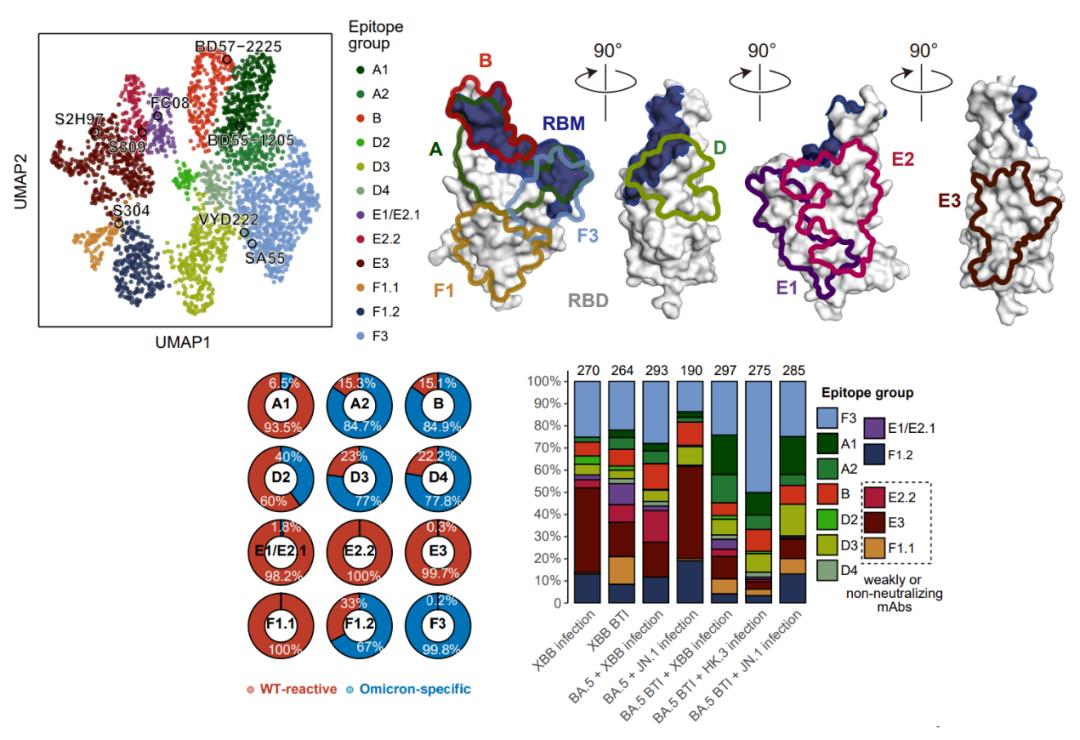
XBB.1.5与JN.1 RBD抗体的表位图谱与不同免疫背景人群的抗体表位分布
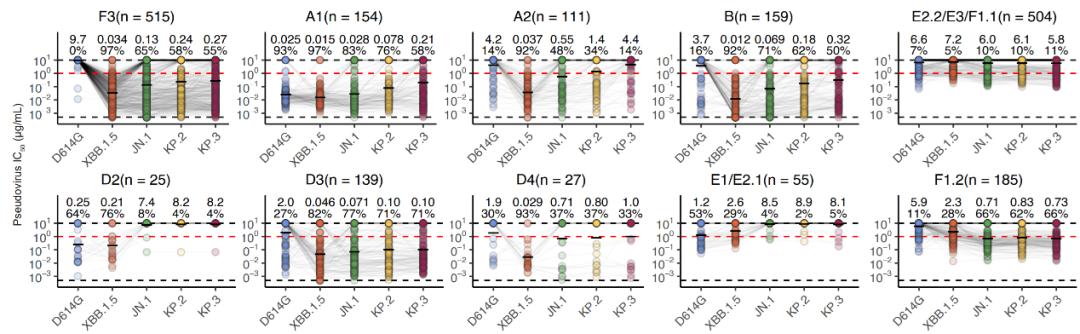
靶向不同表位RBD抗体对突变株的中和活性
接下来,作者将此前开发的高通量深度突变扫描(DMS)技术应用于XBB.1.5与JN.1 RBD的研究,建立了对应的酵母表面展示突变库,并确定了上述所得约2000种RBD特异单克隆抗体在抗原上的逃逸图谱,通过聚类分析注释出了RBD抗体的表位分组,得到不同人群体内RBD抗体的表位分布。在所得的12个表位组中,A1、D2、E1/E2.1、E2.2、E3、F1.1是以交叉结合抗体为主,而其余表位主要包含奥密克戎特异性抗体。可以看出,A1是唯一与原始株交叉结合的同时对新型突变株具有较强中和活性的表位。注意到,A1抗体的数目与经历过的免疫次数正相关,只有接种疫苗后又重复感染的群体,能够产生较多的A1类广谱中和抗体。在奥密克戎特异性抗体中,F3表位组是中和表现最好的,并在多个感染者群体中都能够产生。然而,此前有研究证明,mRNA疫苗接种者即使经过奥密克戎的重复暴露,也无法有效产生奥密克戎特异性抗体。为了进一步研究不同群体的有效中和抗体组分,特别是经历不同毒株再感染的人群,研究团队接下来分别关注了交叉结合抗体与奥密克戎特异性抗体对广谱中和的贡献。
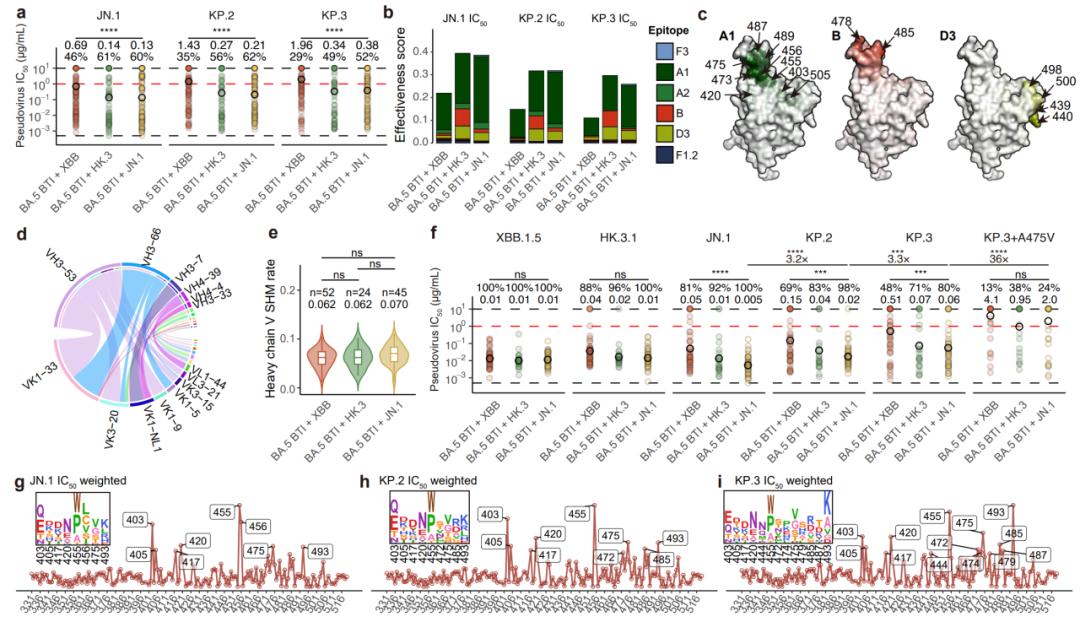
原始株交叉结合抗体对中和活性的贡献分布与广谱性
与前面分析一致,在原始株交叉结合的中和抗体中,A1类抗体对JN.1、KP.2、KP.3起到主要的中和作用,而B、D3两类中和抗体也有一定贡献。A1类主要是经典的Class 1使用IGHV3-53/3-66重链V基因的抗体,与受体ACE2的结合位点高度重合。这些发现与世界上A1特异性逃逸突变的高度增长优势是一致的。虽然KP.2和KP.3分别包含的F456L、Q493E等突变都位于此类抗体表位,但仍有较多的A1抗体保持高效中和。而HK.3/JN.1再感染来源的抗体相比XBB具有更好的广谱性,反映了其包含的突变能够有效富集广谱中和A1抗体。这些结果表明基于JN.1,甚至进一步包含A1表位突变的KP.2/KP.3开发疫苗,有助于富集A1类的广谱中和抗体。
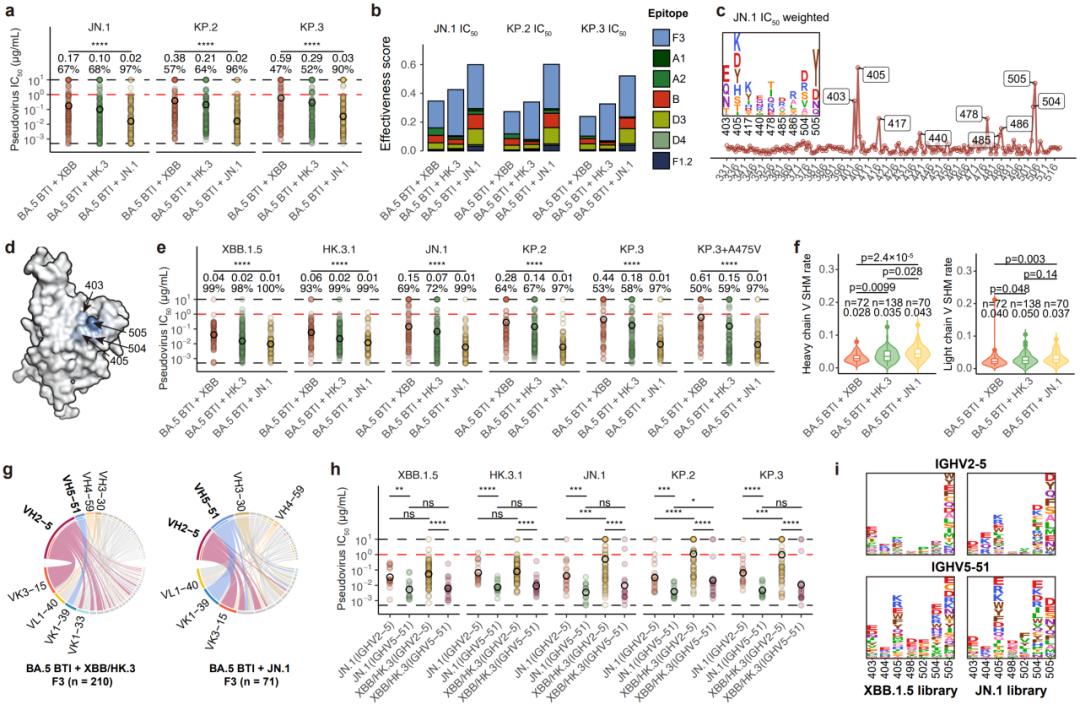
JN.1能够高效激活具有广谱中和活性的奥密克戎特异性F3类抗体
在奥密克戎特异性抗体中,F3类对JN.1谱系贡献了主要的中和作用,该表位在空间上与研究团队此前报道的广谱中和抗体SA55一致,但由于此类特异性F3与奥密克戎谱系特有的N405、H505等位点的相互作用,使其不能结合原始株RBD。有趣的是,除已被证明可能由于导致构象改变而不利的G504外,该类抗体主要的逃逸位点都是已经在奥密克戎突变过的位点,而这些位点的进一步突变有可能导致已被逃逸抗体的回复,可能也是不利的。这说明此类抗体可能是好的奥密克戎广谱中和抗体,难以被未来的突变株逃逸,特别是相比XBB/HK.3,JN.1感染激活的此类抗体对JN.1谱系的中和显著更好。研究团队发现,此类抗体主要由IGHV2-5与IGHV5-51两类基因形成,而IGHV5-51来源的F3抗体具有更好的广谱中和活性,而JN.1的再感染能更好地激活IGHV5-51 F3抗体。这些发现同样支持了基于JN.1谱系的疫苗研发。
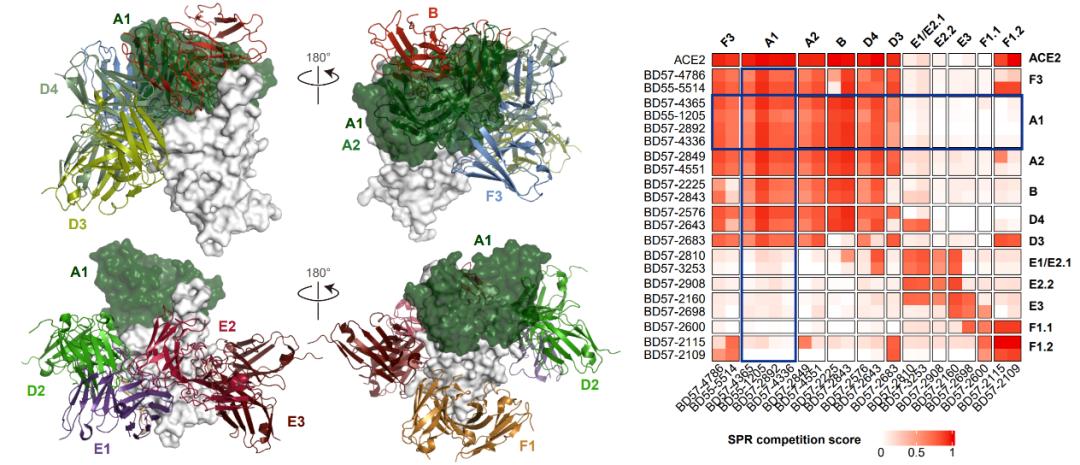
广谱的A1类公共抗体与所有奥密克戎特异性中和表位竞争
此前研究已经证明,mRNA疫苗在人类中产生的免疫印记不能通过奥密克戎重复暴露而消除,然而,这一现象在小鼠中并不存在。即使使用原始株mRNA疫苗免疫,重复奥密克戎免疫的小鼠也能高效产生奥密克戎特异性抗体。而人类与小鼠的体液免疫主要区别在于VDJ基因组成的不同。基于上述奥密克戎特异性抗体的表位分析,研究团队发现这些A1表位使用IGHV3-53/3-66的“公共抗体”能够与所有奥密克戎特异性中和表位竞争,并通过SPR实验验证了这一点。因此,研究团队提出了猜想——mRNA疫苗接种造成的强烈免疫印记与IGHV3-53/3-66公共抗体应答有关。
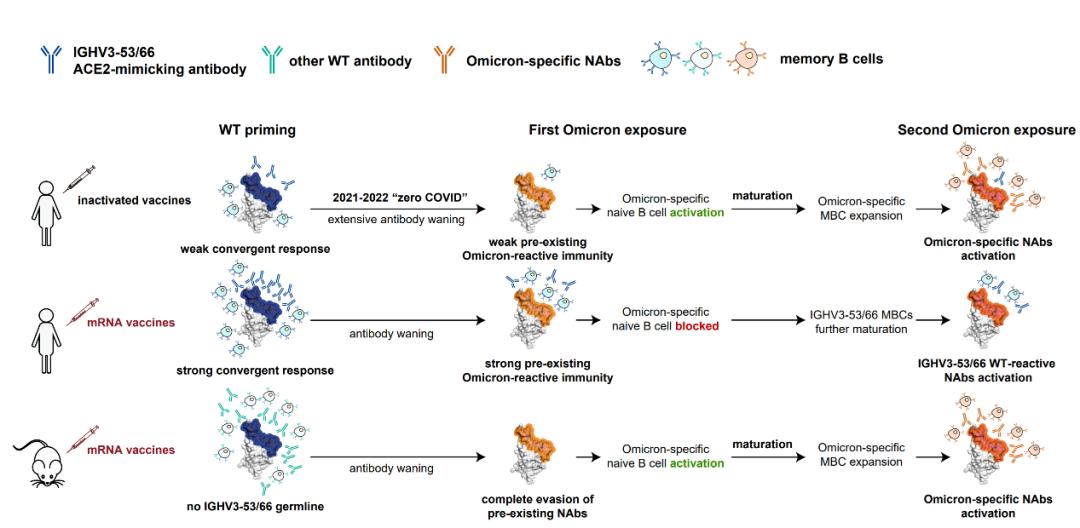
提出模型解释人类与小鼠的mRNA疫苗接种所造成免疫印记结果的不同
研究团队因此提出假说,由于mRNA疫苗具有强烈免疫原性,导致初始免疫时产生大量的IGHV3-53/3-66抗体响应并成熟,而此类抗体由于其高度的受体模拟能力,其表位上的逃逸突变具有限制,因此并不全部被奥密克戎突变株所逃逸。这些剩余的记忆B细胞在接受到初次奥密克戎免疫时被重新激活,而由于它们与奥密克戎特异性抗体竞争,形成了表位屏蔽,使得奥密克戎特异性的初始B细胞难以被激活和成熟,这样一来,即使继续受到奥密克戎暴露,也倾向于反复激活此类A1抗体,而不是产生与其表位竞争的全新特异性抗体。另一方面,我国主要接种灭活疫苗的人群无此现象,一是因为灭活疫苗的免疫原性弱于mRNA疫苗,二是在政策的影响下,长期的免疫衰减过程进一步降低了这类抗体记忆的作用。因此,该研究分析的接种灭活疫苗的人群受到奥密克戎感染时,剩余的A1类抗体不足以形成表位屏蔽,使得特异性抗体能够产生并成熟,进而在二次免疫时被重新激活。另一方面,小鼠体内不存在能够引起类似IGHV3-53/3-66免疫应答的基因,也不能有效阻止奥密克戎特异性抗体的产生,上述分析需要未来进一步实验研究的验证。
论文链接:
https://www.nature.com/articles/s41586-024-08315-x素材来源官方媒体/网络新闻
原标题:《Nature:曹云龙团队揭示新冠病毒流行谱系转变下的抗体免疫响应演化》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




