- +1
【前沿进展】Nat Commun | 胡家志课题组揭示线粒体DNA稳定及其潜在风险
近年来,基因编辑技术的迅猛发展为治疗遗传性疾病和癌症等复杂疾病提供了新的可能性。尤其是CRISPR-Cas9等技术的引入,使得对细胞核DNA的编辑变得更加精准和高效。这些技术的应用不仅促进了基础生物学研究的进展,也为新疗法的开发铺平了道路。除细胞核DNA外,哺乳动物细胞基因组还包含成百上千拷贝的线粒体DNA。线粒体DNA也携带着重要的遗传信息,其突变已被证实与多种人类遗传疾病相关,如线粒体肌病和某些神经退行性疾病等。因此,线粒体DNA逐渐成为新型基因编辑工具(如mitoTALEN和线粒体碱基编辑器DdCBE等)治疗遗传疾病的重要靶点【1】。
在基因编辑的临床应用中,确保安全性和有效性是首要任务。然而,随着研究的深入,科学家们发现基因编辑可能伴随着多种风险与挑战。除了脱靶效应,CRISPR-Cas核酸酶介导的核DNA编辑可能导致染色体异位和大片段缺失等异常结构【2】,这些变化严重威胁基因组的稳定性,并与癌症的发生发展密切相关。此外,基因编辑导致的T细胞染色体结构异常在输注至小鼠体内后,并不会随着时间的延长而消失,而是持续维持在较高水平并表现出明确的随机克隆扩增现象【3】。针对线粒体DNA的编辑也可能在细胞核DNA上引发严重的脱靶效应。
虽然线粒体DNA被包裹在双层膜结构的线粒体中,并与细胞核DNA在空间上相互隔绝,但研究发现二者之间可能存在密切的交流。在进化过程中,线粒体DNA片段逐渐转移至核DNA中,从而在人类核基因组中引入了数百个线粒体DNA 片段(NUMT)【4】。此外,新生个体或癌症细胞中新产生的NUMT的频率分别约为10-4和10-3。这些新产生的NUMT可能导致基因的异常表达,进而促进肿瘤进展、Pallister-Hall综合征和粘多糖症等【5】。然而,基因编辑对线粒体DNA稳定性的影响尚未得到深入研究,其与核DNA的互作关系仍不清楚。
2024年11月1日,北京大学生命科学学院和北大-清华生命科学联合中心胡家志课题组及合作者在Nature Communications发表了题为:Transfer of mitochondrial DNA into the nuclear genome during induced DNA breaks的研究论文。该研究发现,在所有测试的细胞类型及编辑位点,无论是针对核DNA还是线粒体DNA的编辑,都会引起线粒体DNA片段向核基因组的转移。针对这一潜在安全风险,该研究还提供了切实可行的解决方案,从而为基因编辑技术的安全应用提供了重要的科学依据和保障,并为理解NUMT的进化起源提供了新视角。

利用课题组前期开发的、可全面定量评估基因编辑产物的方法——PEM-seq以及优化的生物信息分析流程【6】,作者发现:在人HEK293T细胞中,多种核DNA编辑工具(如SpCas9、AsCas12a、LbCas12a、Un1Cas12f、CasMINI和CasMINI_ge4.1等)在全部12个编辑位点均诱导了线粒体DNA与核DNA的融合,其频率为103-105(图一A,B)。此外,即使使用SpCas9的高保真变体也无法有效降低或消除这种融合现象。在小鼠胚胎干细胞、人CAR-T细胞和小鼠TCR-T细胞中,核DNA编辑同样导致线粒体-核DNA融合,且这种融合在TCR-T细胞输入小鼠体内后表现出克隆扩增现象。然而,使用碱基编辑器(如BE3、BE4max和ABEmax等)可显著降低该融合现象,提示双链DNA断裂在二者融合过程中发挥着重要作用。为了验证这一点,作者在核DNA编辑的同时,通过施加线粒体压力,或利用mitoTALEN在线粒体DNA上定点诱导双链断裂,都能显著增加线粒体-核DNA融合的频率(图一C,D)。进一步证实整合了至核DNA的线粒体DNA片段确实来源于线粒体。作者也通过富集编辑位点处的DNA插入片段,证实了线粒体DNA整合至核DNA。
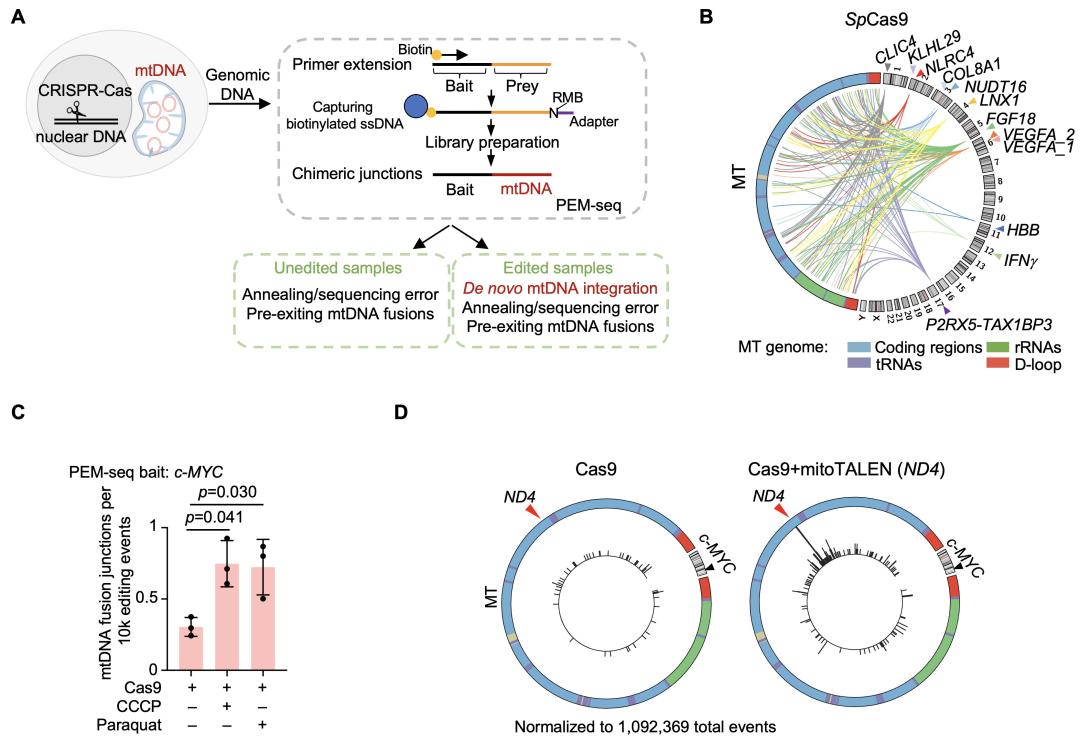
图一 PEM-seq检测线粒体DNA片段在核基因组靶向位点的插入
除了核DNA编辑外,作者还发现,单独使用线粒体DNA编辑工具(如mitoTALEN和DdCBE等)编辑线粒体DNA同样会导致线粒体-核DNA融合(图二A)。由于该融合具有潜在安全风险,为应对这一挑战,作者提出了一种切实可行解决方案:在DdCBE编辑过程中共表达核酸外切酶TREX1或TREX2,可以显著减少线粒体DNA向核基因组的转移(图二B)。
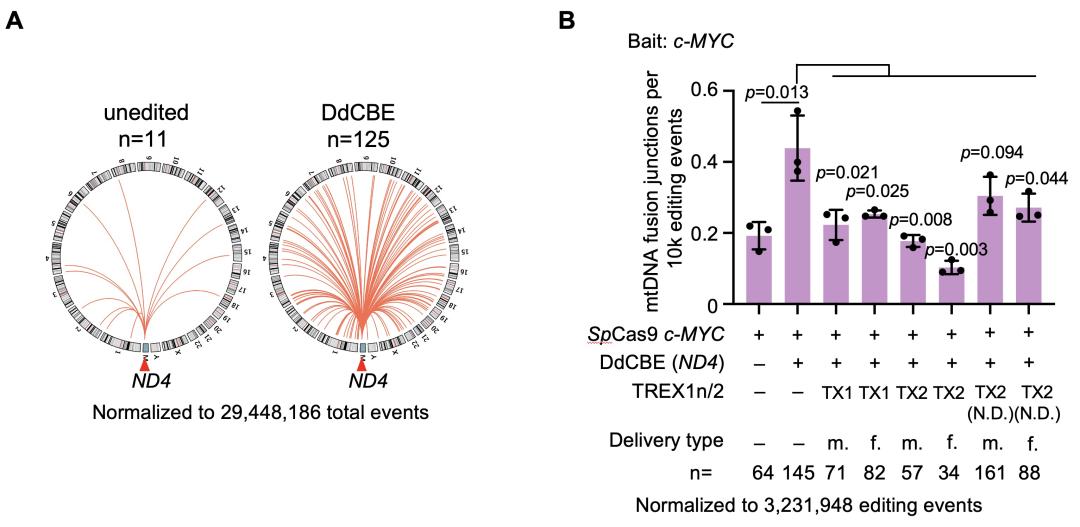
图二 线粒体编辑器引起线粒体DNA片段整合到核基因组
综上所述,该研究结果强调了在基因编辑过程中对线粒体DNA稳定性给予更多关注的重要性。鉴于基因编辑可能导致的线粒体DNA转移及其潜在后果,研究者应制定更为严格的标准和指南,以评估和管理这些风险。此外,科学界需要加强对线粒体DNA和核DNA相互作用的研究,以寻找有效的策略,进一步减少编辑过程中可能出现的负面影响。这不仅能够提升基因编辑技术的安全性,还将推动我们对线粒体功能和基因组稳定性的理解,最终为临床应用提供更为坚实的科学基础。
该工作由北京大学生命科学学院和北大-清华生命科学联合中心胡家志课题组和中国科学院遗传与发育研究所田烨课题组合作完成,胡家志研究员为该论文的通讯作者。北京大学前沿交叉学科研究院2023届毕业生吴锦淳、生命科学学院博士后刘阳(现为北京大学基础医学院PI)、2021级博士研究生欧丽琼及北京大学成都前沿交叉生物技术研究院甘婷婷博士为该论文的共同第一作者。
原文链接:
https://doi.org/10.1038/s41467-024-53806-0
胡家志实验室网址:https://hulab.pku.edu.cn/
制版人:十一
参考文献
1. Silva-Pinheiro, P. & Minczuk, M. The potential of mitochondrial genome engineering. Nat Rev Genet 23, 199-214 (2022).
2. Yin, J. & Hu, J. The origin of unwanted editing byproducts in gene editing. Acta Biochim Biophys Sin (Shanghai) 54, 767-781 (2022).
3. Wu, J. et al. CRISPR/Cas9-induced structural variations expand in T lymphocytes in vivo. Nucleic Acids Res 50, 11128-11137 (2022).
4. Wei, W. et al. Nuclear-mitochondrial DNA segments resemble paternally inherited mitochondrial DNA in humans. Nat Commun 11, 1740 (2020).
5. Kopinski, P.K., Singh, L.N., Zhang, S., Lott, M.T. & Wallace, D.C. Mitochondrial DNA variation and cancer. Nat Rev Cancer 21, 431-445 (2021).
6. Liu, Y. et al. PEM-seq comprehensively quantifies DNA repair outcomes during gene-editing and DSB repair. STAR Protocols 3, 101088 (2022).
原标题:《【前沿进展】Nat Commun | 胡家志课题组揭示线粒体DNA稳定及其潜在风险》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




