- +1
Cell:揭开CRISPR-Cas10的全新抗病毒免疫机制——牺牲自我,保护集体
原创 生物世界
撰文丨nagashi
编辑丨王多鱼
排版丨水成文
CRISPR技术自问世以来,就表现出无可比拟的优势,并深刻改变了基因编辑领域乃至整个生命科学的研究模式。CRISPR技术脱胎于天然存在于细菌/古菌中的CRISPR防御系统,例如CRISPR-Cas9和CRISPR-Cas13,这些CRISPR系统可以识别并切割外来DNA或RNA序列,从而保护细菌免受噬菌体的侵袭。
有趣的是,最近发表于 Cell 期刊上的一项研究揭示了另一种相对不为人知的CRISPR系统——III型CRISPR系统(CRISPR-Cas10),其采用一种完全不同的方式发挥抗病毒免疫以保护细菌。
该研究由洛克菲勒大学 Luciano A. Marraffini 团队领衔完成,论文题为:The CRISPR-associated adenosine deaminase Cad1 converts ATP to ITP to provide antiviral immunity.
该研究发现,当细菌被噬菌体感染时,III型CRISPR系统被激活并引发一系列分子事件,最终释放三磷酸肌苷(ITP)这一细胞毒性物质。ITP通过三磷酸腺苷(ATP)的脱胺作用产生,它可以抑制细菌的生长,从而阻止噬菌体在细菌中的扩散。这相当于被感染的细菌牺牲了自己,使得整个种群得以存活。

III型CRISPR系统编码一个效应复合体,其中Cas10是识别靶标RNA以触发两种活动的主要亚基:单链DNA(ssDNA)降解和第二信使环寡聚腺苷酸(cOA)的合成。第一种活性是由Cas10的HD结构域催化的,当噬菌体RNA在裂解周期的早期表达时,就足以提供抗噬菌体免疫。相比之下,cOA的产生是由Cas10的Palm结构域催化的,以ATP为底物产生3'-5'cOA分子,主要形式为cA4或cA6。当噬菌体感染进入裂解周期晚期时,这一通路对于细菌群体的免疫防御是至关重要的。
在这种情况下,免疫是通过cOA第二信使激活CRISPR相关的Rossman折叠(CARF)效应物来实现的。除了与cOA配体结合的CARF结构域外,这些效应物还具有引起细胞毒性的第二个结构域,该结构域可引起细胞毒性,阻止噬菌体的裂解周期。
在这项最新研究中,研究团队表征了CRISPR相关的腺苷脱氨酶1(Cad1)的结构和功能,这是一个由CARF结构域与腺苷脱氨酶结构域融合的效应蛋白。他们发现,在cA4或cA6与其CARF结构域结合后,Cad1在体内和体外均可将ATP转化为ITP。
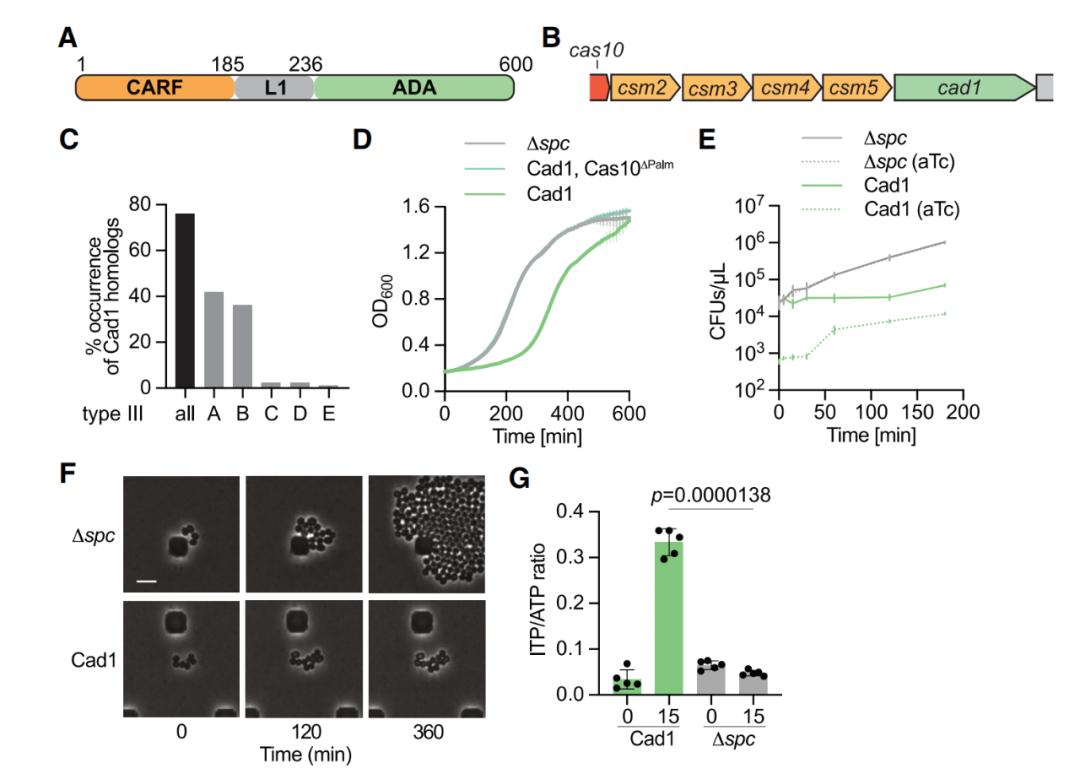
Cad1的激活会导致生长阻滞和高水平的细胞ITP
冷冻电镜(cryo-EM)对全长Cad1的结构研究显示,单个Cad1首先组成一个二聚体,然后三个二聚化的Cad1组装成一个六聚体复合物。Cad1具有两种活性位点,其中一个结构域间位点结合ATP,而另一个脱氨酶活性位点结合ATP/ITP。cOA的结合可以诱导脱氨酶活性位点的结构变化,将ATP转化为ITP。
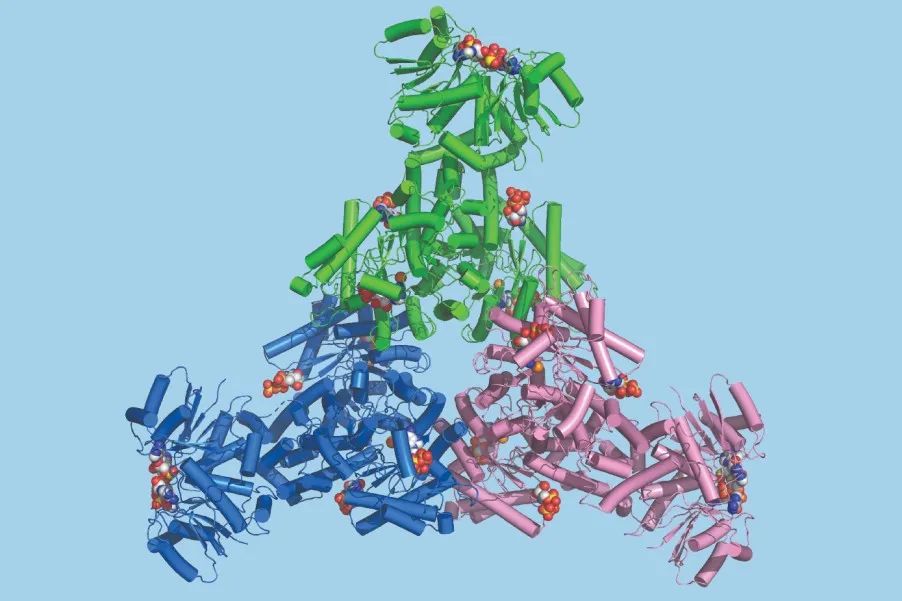
全长Cad1蛋白的三维结构
进一步研究显示,在噬菌体感染期间合成cOA后,Cad1激活并导致宿主细菌生长停滞,从而阻止噬菌体在细菌种群中的传播。打个形象的比喻,如果说最常见的CRISPR-Cas9的作用就像一把分子剪刀(molecular scissors),那么III型CRISPR系统的Cad1介导的细胞通路更像是分子熏蒸器(molecular fumigator)——释放有毒物质将宿主细菌和噬菌体一并杀死。
研究团队表示,Cad1介导的“毒性熏蒸”使得病毒被隔离在其中时,被感染的细菌牺牲了,但更大的细菌种群得以存活和延续。
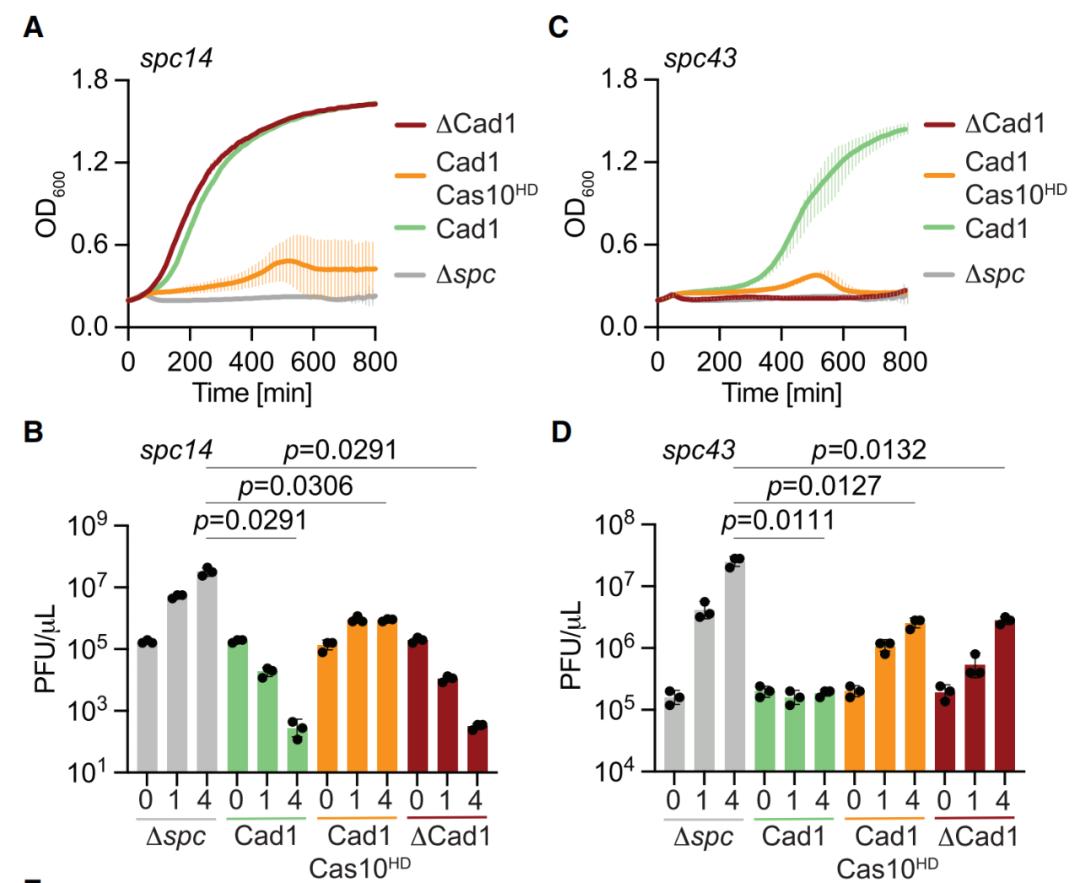
Cad1提供抗噬菌体免疫力
那么,为什么ITP对细菌有如此大的毒性呢?一种观点认为,过量的ITP会竞争蛋白质中通常由ATP或GTP占据的结合位点,这些结合位点对正常细胞功能至关重要;另一个观点认为,高水平的ITP会干扰DNA复制,从而同时抑制细菌和噬菌体。但这些观点都是推测,具体的分子机制还没有定论。
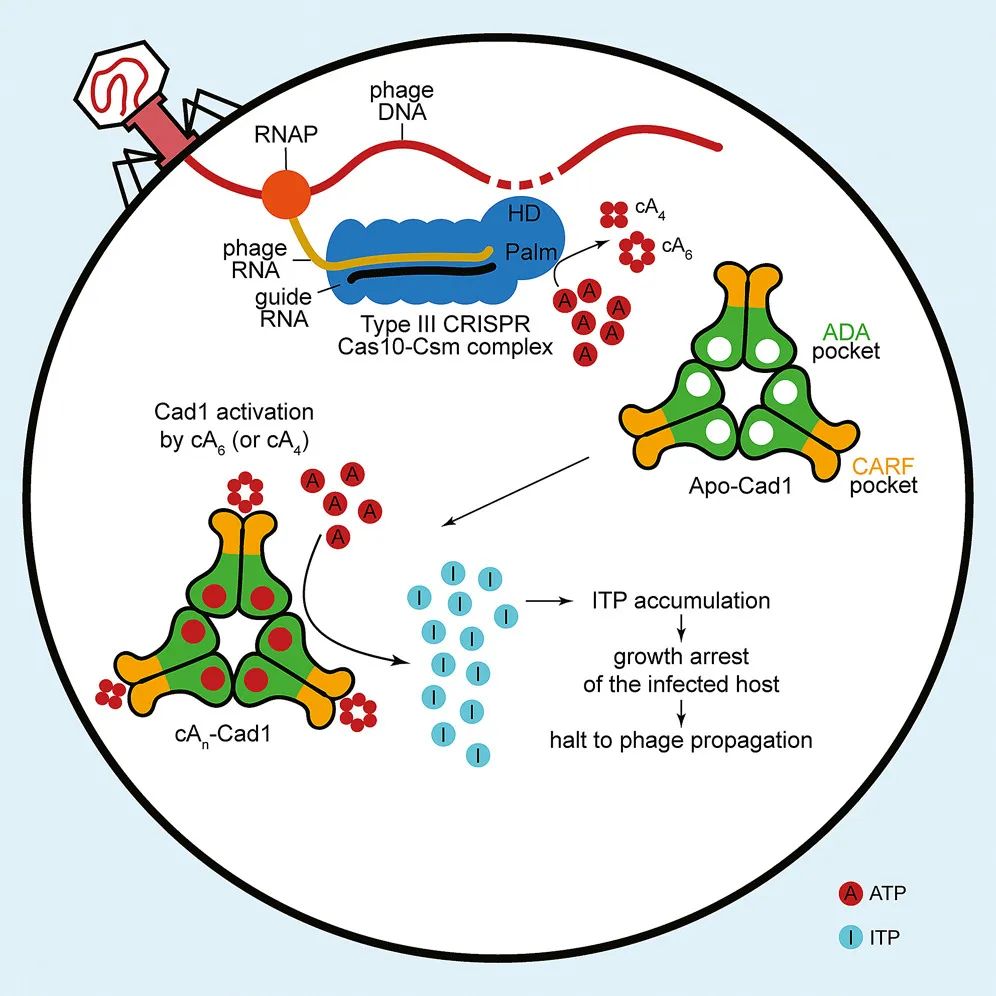
研究模式图
总的来说,这项发表于 Cell 的研究表明,III型CRISPR系统基于CRISPR相关腺苷脱氨酶1(Cad1)为宿主细菌提供了核酸降解以外的抵御噬菌体的适应性免疫机制。这一机制类似于哺乳动物先天免疫通路(例如cGAS-STING),通过产生环核苷酸以激活宿主的天然免疫反应。
此外,这项工作的一个潜在应用是作为病原体感染的诊断工具,一旦在反应体系中出现ITP,就表明样本中存在病原体转录物。这将促进基于RNA的体外诊断试剂盒的开发,类似于此前的DETECTR和SHERLOCK等分子诊断系统。
论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(24)01150-4

本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




