- +1
【科技前沿】Nature | 施一公团队首次揭示了IgE介导的FcεRI激活的分子机制
过敏性疾病影响着工业化国家四分之一以上的人,已成为重大的公共卫生问题。IgE的高亲和Fc受体(FcεRI)主要存在于肥大细胞和嗜碱性细胞中,在过敏性疾病中起重要作用。单体IgE结合FcεRI调控肥大细胞的存活、分化和成熟。然而,潜在的分子机制仍不清楚。
2024年10月23日,西湖大学施一公及宿强共同通讯在Nature在线发表题为“Molecular mechanism of IgE-mediated FcεRI activation”的研究论文,该研究首次揭示了IgE介导的FcεRI激活的分子机制。
该研究表明,在IgE结合之前,FcεRI主要以-二聚体形式存在于人肥大细胞膜上。人类FcεRI的结构证实了二聚体的结构,每个启动子包括一个α亚基、一个β亚基和两个γ亚基。α亚基的跨膜螺旋与γ和β亚基的跨膜螺旋呈层状排列。二聚体界面是由细胞内近膜区α和γ亚基的四螺旋束介导的。嵌入跨膜结构域的胆固醇样分子可以稳定二聚体的组装。在IgE结合后,二聚体FcεRI解离成两个原蛋白,每个原蛋白与一个IgE分子结合。重要的是,这一过程引发了大鼠嗜碱性细胞中Egr1/3和Ccl2的转录激活,这可以通过抑制FcεRI二聚体到单体的转变来减弱。总的来说,该研究揭示了抗原不依赖、IgE介导的FcεRI激活的机制。

过敏性疾病,如过敏性鼻炎、特应性皮炎、哮喘、食物和药物过敏,构成了近几十年来日益严峻的医疗挑战。肥大细胞和嗜碱性细胞是关键的效应因子。这些细胞表达高亲和力的IgE受体(FcεRI),可识别可溶性IgE。暴露于过敏原后,IgE结合的FcεRI发生交联,从而触发细胞活化并释放过敏介质,包括组胺、前列腺素和白三烯。立即过敏反应的特点是血管舒张,血管通透性增加,支气管收缩,全身性过敏反应。
FcεRI是20世纪80年代初发现的多聚体细胞表面受体。FcεRI与T细胞和B细胞受体一起属于抗原受体超家族。在人类肥大细胞和嗜碱性细胞中,FcεRI由1个α亚基、1个β亚基和2个γ亚基组成。当FcεRI与可溶性IgE和多价抗原结合时,ITAMs被Src家族酪氨酸激酶LYN磷酸化。这引发了一个快速的信号级联反应,导致预先形成的炎症介质在几分钟内释放。在这个过程中,γ亚基是主要的和不可缺少的信号成分,而β亚基放大了γ亚基产生的信号。
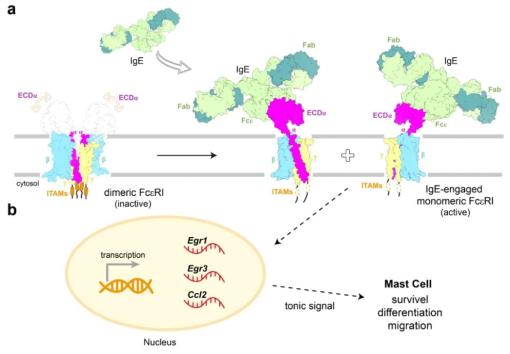
IgE介导FcεRI复合物激活的工作模型(图源自Nature )
IgE被认为是被动地附着在FcεRI上而不影响肥大细胞的功能。然而,最近的研究表明,在缺乏抗原的情况下,IgE介导的对肥大细胞有重要影响。例如,IgE通过稳定细胞表面的受体并阻止其内化来增加FcεRI的表达。此外,IgE在促进肥大细胞存活和活化中起着至关重要的作用。IgE介导的作用依赖于γ亚基中的ITAMs,并采用不同于抗原依赖性信号传导的途径。值得注意的是,这些IgE效应已经在不同的动物模型中得到验证,强调了它们在过敏条件下的重要性。
在这项研究中,作者报道了用冷冻电子显微镜(cryo-EM)在3.8 Å分辨率下的全长度FcεRI结构。通过实验分析,确定了一个功能重要的FcεRI二聚体到-单体在IgE结合上的转变。这种转变启动下游信号传导,可能有助于肥大细胞和嗜碱性粒细胞的存活和激活。这一突破性发现,不仅为理解过敏性疾病的发病机制提供了新的视角,也为开发针对IgE-FcεRI相互作用的治疗策略提供了科学依据。
西湖大学访问人员陈梦莹(清华大学已毕业博士生)为本研究的唯一第一作者,西湖大学未来产业研究中心、生命科学学院、西湖实验室施一公教授和深圳医学科学院特聘研究员宿强(原西湖大学助理研究员)为该文章的共同通讯作者。本研究获得了科技部、国家自然科学基金委、西湖教育基金会、西湖大学未来产业研究中心和西湖实验室的相关经费支持;同时得到了西湖大学未来产业研究中心生命原理技术平台、超级计算技术平台的技术支持。
论文链接: https://www.nature.com/articles/s41586-024-08229-8
本文转载自公众号“iNature”
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
原标题:《【科技前沿】Nature | 施一公团队首次揭示了IgE介导的FcεRI激活的分子机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




