- +1
Nature:施一公/宿强团队揭示过敏反应关键机制
编辑丨王多鱼
排版丨水成文
也许是生命本身就是敏感的,才会有那么多过于免疫的反应。过敏性疾病,例如哮喘、过敏性鼻炎和特应性皮炎,这些过度免疫引发的疾病无疑经常会出现在你我身上,或者身边。
在工业化国家,超过四分之一的人患有过敏性疾病,这已成为一个重大公共卫生问题。IgE高亲和力受体(FcεRI)主要存在于肥大细胞和嗜碱性粒细胞上,在过敏性疾病中发挥重要作用。与FcεRI结合的单体IgE调节肥大细胞的存活、分化和成熟。然而,其潜在的分子机制尚不清楚。
2024年10月23日,西湖大学未来产业研究中心、生命科学学院、西湖实验室施一公团队和深圳医学科学院宿强团队合作,在 Nature 期刊发表了题为:Molecular mechanism of IgE-mediated FcεRI activation(IgE介导的高亲和力受体FcεRI激活的分子机制)的研究论文。
该研究首次报道了人源IgE高亲和力受体(FcεRI)的二聚化结构,并通过多种生化、细胞和流式实验,证明了IgE结合能诱导受体从二聚体转变为单体,同时揭示了这种构象变化对受体激活的影响。
这一发现不仅为理解IgE-FcεRI在过敏反应中的关键机制提供了重要见解,也为开发新型抗过敏疗法开辟了新方向。

IgE与过敏反应
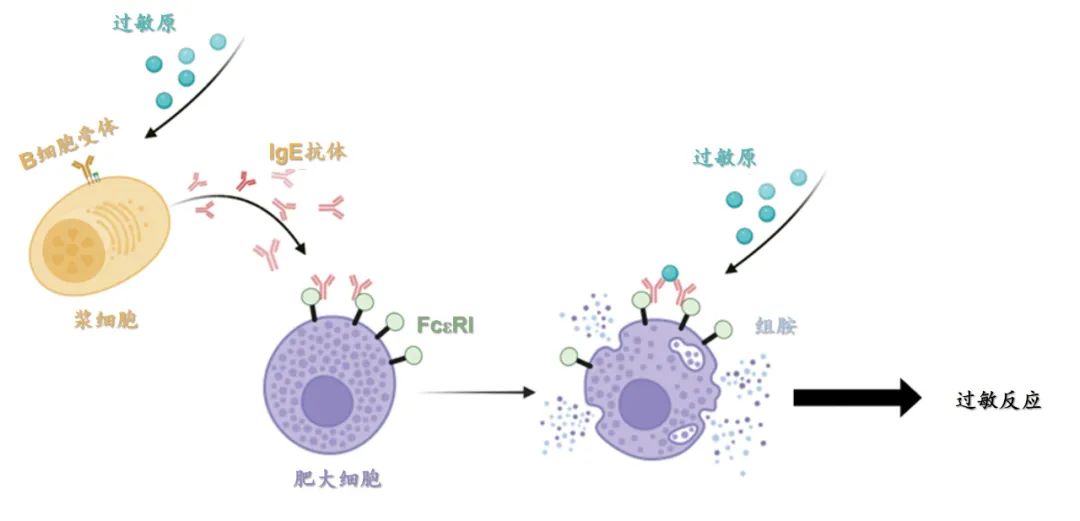
IgE介导的过敏反应概略示意图
IgE是过敏反应的核心免疫球蛋白,其与高亲和力受体FcεRI的相互作用至关重要。
FcεRI由FcεRIα、FcεRIβ和FcεRIγ亚基组成,其中α亚基负责识别IgE,β和γ亚基则在受体激活后启动下游信号通路。FcεRI在肥大细胞和嗜碱性粒细胞表面高表达,形成αβγ2四聚复合物。
过往研究认为,过敏原诱导IgE结合的FcεRI发生交联,引起肥大细胞的脱颗粒反应,推动过敏性疾病的发生。而靶向破坏IgE与FcεRI结合的药物被认为是有效的抗过敏治疗策略。
尽管IgE与FcεRI的识别机制已被研究得较为清晰,但关于FcεRI的跨膜区的研究仍较为薄弱。研究表明,IgE与FcεRI结合不仅影响受体激活,还影响肥大细胞的存活、分化和成熟,而IgE诱导FcεRI激活的具体分子机制仍不明确。
二聚体的“钥匙”
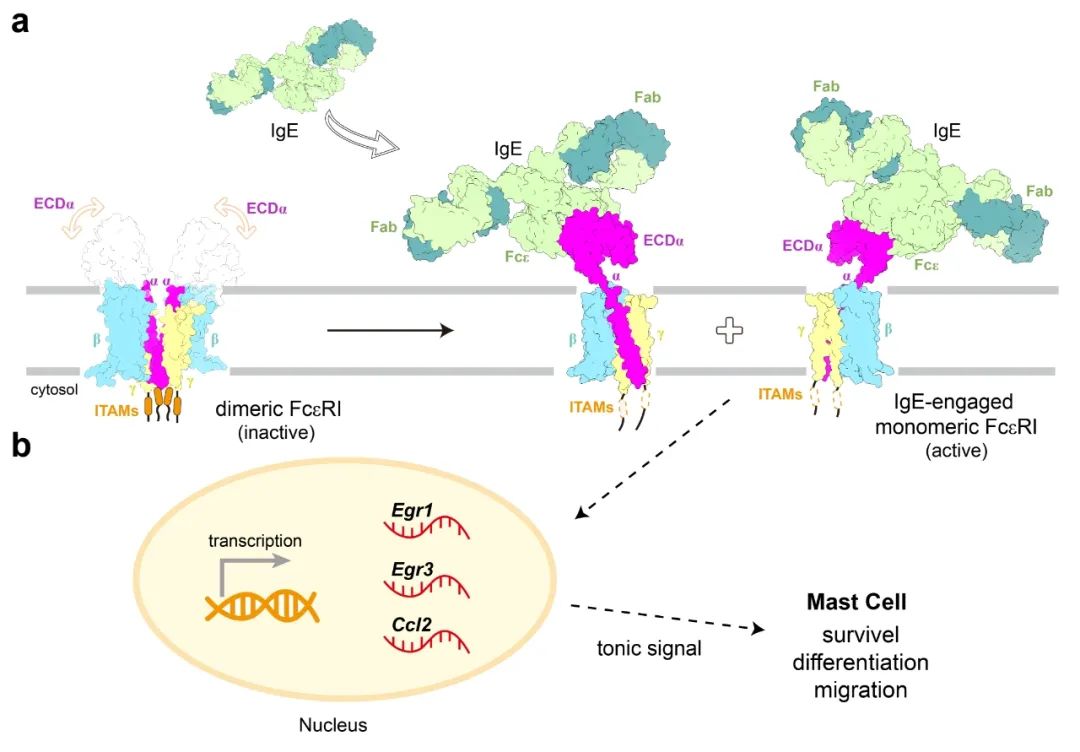
IgE介导FcεRI复合物激活的工作模型
研究团队设计了一系列实验,结合生化、细胞和免疫等多种技术,揭示了FcεRI在生理状态下以二聚体形式存在。
二聚体,顾名思义,就是两个相同的单体,“拼合”在一起。
首先,通过分析型超速离心(AUC)和非变性聚丙烯酰胺凝胶(Native-PAGE)分析,研究团队发现FcεRI复合物存在单体(αβγ2)和二聚体 [(αβγ2)2]两种状态。
此外,荧光寿命成像显微镜-荧光共振能量转移(FLIM-FRET)技术也检测到了在细胞膜上FCERI之间距离很近,很有可能肩并肩地以二聚体的形式存在。
后续研究表明,FcεRI的二聚化是由α和γ亚基在细胞内形成的四螺旋束界面介导的,胆固醇样分子在稳定二聚体过程中发挥了重要作用。
进一步,研究团队通过体外生化和体内细胞实验,证实IgE结合能够促使FcεRI从二聚体状态转变为单体形式。
IgE的结合,像一把钥匙,成为打开二聚体的关键。
从结构角度看,二聚化的FcεRI不利于下游信号的激活,而IgE结合的FcεRI则以单体形式存在,这种构象转变有助于暴露FcεRIβ和FcεRIγ亚基胞内段的ITAMs,从而更有效地激活下游信号通路。
此后,研究团队构建了多种稳转细胞系,包括野生型(WT-FcεRI)、组成型二聚体 (GCN4-FcεRI)和阴性对照(DA-FcεRI)。利用流式细胞术、RNA测序、qPCR等多种实验手段,系统验证了不同状态下FcεRI激活效应的差异。
最终,研究团队提出了IgE介导FcεRI复合物激活的工作模型,为理解IgE与FcεRI的相互作用及其在过敏反应中的作用提供了全新视角。
该研究得到了审稿人的高度评价,他们认为,FcεRI二聚体的发现为IgE-FcεRI的功能研究提供了关键机制见解,并称赞此工作为未来抗过敏疗法研究奠定了重要基础。这一突破性发现,不仅为理解过敏性疾病的发病机制提供了新的视角,也为开发针对IgE-FcεRI相互作用的治疗策略提供了科学依据。
西湖大学访问人员陈梦莹(清华大学已毕业博士生)为论文唯一第一作者,西湖大学施一公教授和深圳医学科学院特聘研究员宿强(原西湖大学助理研究员)为论文共同通讯作者。该研究获得了科技部、国家自然科学基金委、西湖教育基金会、西湖大学未来产业研究中心和西湖实验室的相关经费支持;同时得到了西湖大学未来产业研究中心生命原理技术平台、超级计算技术平台的技术支持。
论文链接:
https://www.nature.com/articles/s41586-024-08229-8
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




